浸麻芽孢杆菌环糊精葡糖基转移酶的克隆与表达
王晓玉,刘 飞,颜 震,张 莉,朱希强,郭学平,凌沛学
(1.山东大学药学院,山东 济南 250012;2.山东省药学科学院生物技术中心,山东 济南 250101)
浸麻芽孢杆菌环糊精葡糖基转移酶的克隆与表达
王晓玉1,2,刘 飞2,颜 震2,张 莉2,朱希强2,郭学平2,凌沛学1,2
(1.山东大学药学院,山东 济南 250012;2.山东省药学科学院生物技术中心,山东 济南 250101)
目的 获取浸麻芽孢杆菌环糊精葡糖基转移酶基因并在大肠杆菌中表达。方法 构建浸麻芽孢杆菌环糊精葡糖基转移酶表达质粒,转化大肠杆菌DH5α,筛选获得阳性重组菌株。经42℃诱导后,检测酶活性。结果浸麻芽孢杆菌环糊精葡糖基转移酶在大肠杆菌中成功表达,表达量达3 U/mL。结论 浸麻芽孢杆菌环糊精葡糖基转移酶可以在大肠杆菌中高效表达。
环糊精葡糖基转移酶;浸麻芽孢杆菌;表达;大肠杆菌
环糊精葡糖基转移酶(CGTase,EC 2.4.1.19)是α-淀粉酶家族的重要成员,能将淀粉通过环化反应转化为环糊精[1],且还可通过逆反应将环糊精与维生素C结合生成维生素C葡糖苷[2]。环糊精在食品、医药、农业、纺织、环保和分析化学等领域具有广泛的应用[3],维生素C葡糖苷也是化妆品生产领域重要的原料之一[4]。环糊精和维生素C葡糖苷的工业化生产均采用酶法合成,但由于野生菌株的产酶能力普遍较低,CGTase的产量远不能满足工业化生产的要求,其应用受到了很大限制,必须提高CGTase产量和活性。因此,基因工程方法生产CGTase越来越得到重视。目前已有利用大肠杆菌(E.coli)表达CGTase的报道,但多为包涵体,活性不高。本研究将浸麻芽孢杆菌(Bacillus macerans)的CGTase插入高效表达载体pBV220,对其表达情况进行研究。
1 材料
1.1 菌株和质粒
Bacillus macerans为革兰阳性菌购自中国工业微生物菌种保藏中心;E.coli、DH5α克隆载体pUC19[Amp(氨苄青霉素)抗性]和表达载体pBV220(Amp抗性)均为山东省药学科学院生物技术中心保存。
1.2 工具酶和试剂(盒)
T4连接酶、限制性内切酶、Taq酶和Probest高保真酶分别购于 Fermentas和Takara公司。细菌基因组抽提试剂盒、质粒抽提试剂盒、回收试剂盒购于天根生化科技有限公司和北京百泰克生物技术有限公司。
2 方法
2.1 引物设计和CGTase基因的克隆
根据NCBI数据库中Bacillus macerans CGTase基因cgt的序列设计引物cgt1和cgt2(表1),以Bacillus macerans基因组为模板进行PCR扩增,从而获得含有起始密码子(ATG)和终止密码子(TAG)的DNA片段。PCR扩增的反应条件:94℃变性5 min;94℃变性1 min,58℃退火1 min,72℃延伸3 min,30个循环;72℃延伸10 min。琼脂糖电泳后,回收大小正确的DNA片段,并与质粒pUC19连接,得到质粒pUC-cgt,测序。

表1 克隆和表达cgt所需的引物Tab.1 The primers for clone and expression of cgt
2.2 表达载体的构建
pBV220是一个高效表达载体,有3 666 bp,具有一个强启动子,SD序列后紧接多克隆位点和强终止子,同时它受clts857基因调控。在温度调控下,能大量表达目的蛋白。以质粒pUC-cgt为模板,扩增cgt基因,引物为cgt3~6(表1),其中cgt3和cgt5为上引,cgt4和cgt6为下引。上引含有Eco RⅠ酶切位点,下引含有Bam HⅠ酶切位点。引物 cgt3和cgt4扩增的是去掉信号肽的成熟肽,引物cgt5和cgt6扩增的片段含有信号肽。通过Eco RⅠ和Bam HⅠ双酶切,将 PCR扩增获得的外源片段插入pBV220的 λP1启动子的下游,带有起始密码子ATG的外源片段直接插在质粒pBV220的SD序列的后面,得到质粒 PBV-cgt,转化 E.coli DH5α,可表达非融合蛋白,结构如图1。
2.3 CGTase基因工程菌的诱导表达
挑取一个转化子单菌落接种于LB培养基5 mL中,37℃培养过夜。次日以2%接种量接于LB培养基200 mL中,30℃培养3~4 h,然后将温度升至42℃,诱导4 h。
2.4 CGTase粗酶液的制备
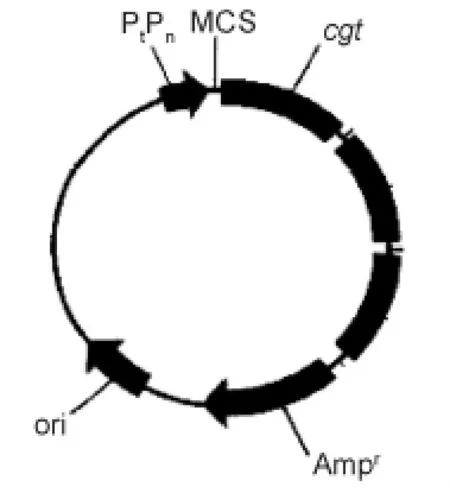
图1 大肠杆菌表达CGTase的质粒Fig.1 The plasmid of CGTase gene in E.coli
将42℃诱导后的菌液4℃离心收集菌体,用0.05 mol/L的磷酸缓冲液(pH 7.0)洗涤两次,再重悬于20 mL该缓冲液中,超声波破碎菌体,离心收集上清,即得到粗酶液。
2.5 CGTase的酶活性测定方法
甲基橙法:取粗酶液0.1 mL,加入装有预先用50 mmol/L磷酸缓冲液(pH 7.0)配制的10 g/L可溶性淀粉溶液0.9 mL的试管中,在40℃下反应10 min后,加入1 mol/L盐酸溶液1 mL终止反应,再加入用50 mmol/L磷酸缓冲液配制的0.1 mmol/L甲基橙溶液1 mL,在20℃下保温15 min,在505 nm波长处测定吸光度。对应α-环糊精标准曲线计算出环糊精浓度,1个酶活性单位定义为在上述条件下每1 min生成1μmol的α-环糊精所需的酶量。
3 结果
3.1 CGTase基因的鉴定
利用引物cgt1和cgt2得到一条2.2 kb左右的DNA片段(见图2),测序结果表明它含有编码714个氨基酸的蛋白ORF,与理论值相符,N端含有27个氨基酸的信号肽。

图2 CGTase基因PCR产物电泳结果Fig.2 The electrophoresis result of cgt PCR products
与NCBI数据库已报道的序列有所不同(图3),在420~500 bp左右发生了移码突变,导致编码的氨基酸序列也随之发生变化。这表明同一个种Bacillus macerans的CGTase基因也略有不同。但这部分肽段不是保守区,对活性影响不会很大。
3.2 CGTase的表达
筛选含有目的质粒的阳性克隆,42℃诱导表达后,对表达产物进行SDS-PAGE分析,结果表明所表达的蛋白质的相对分子质量(Mr)约为70×103(图4),与根据核苷酸序列推测的蛋白质Mr基本一致。取发酵液上清和菌体超声波破碎后的上清,分别检测酶活性。其中不带有信号肽的发酵液上清检测不到活性,菌体超声破碎上清活性较高,约为3 U/mL。带有信号肽的发酵液上清能检测到活性,但较低,约0.1 U/mL,菌体超声破碎后上清检测不到活性。这说明Bacillus macerans的信号肽在E.coli也适用,但是效率很低,分泌到胞外的很少,同时带有信号肽也影响了蛋白的表达量。把信号肽去掉更适合在E.coli中表达。

图3 cgt克隆基因与NCBI报道的序列比较Fig.3 The sequence comparisons of cgt cloning result and report in NCBI
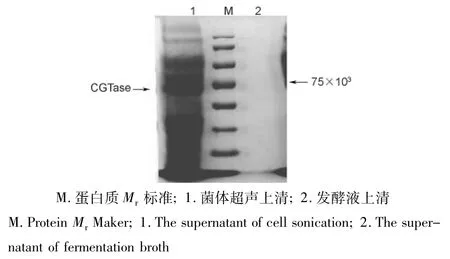
图4 SDS-PAGE结果Fig.4 The SDS-PAGE result of expression products

图5 CGTase酶活性随诱导时间的变化情况Fig.5 The time-independent status of CGTase activity
3.3 诱导时间对CGTase表达量的影响
42℃诱导表达后间隔一定时间取样,测定菌体超声波破碎后上清的酶活性。由图5可以看出,随着诱导时间的延长,酶活性逐渐升高,4 h时达到最高,此后活性基本没有变化。为了减少成本,将诱导时间确定为4 h。
4 讨论
野生型菌株生产CGTase存在一些问题,产量和活性低,纯化工艺较复杂,一直制约着工业化生产。利用基因工程技术可以提高CGTase的产量,但要选择好合适的表达系统。目前表达系统很多,有E.coli表达系统、枯草芽孢杆菌表达系统、酵母表达系统以及动物细胞表达系统等等。针对Bacillus macerans的CGTase,E.coli表达系统使用简便,周期短,更有利于产量和活性的提高。E.coli表达系统有多种表达载体,目前已有利用PET系列的载体对Bacillus macerans的CGTase进行了表达,活性不高,约0.8 U/mL[5]。我们利用表达载体 pBV220 对 Bacillus macerans的CGTase成功实现了在E.coli中的表达,活性达到3 U/mL,约为之前报道的4倍,为以后发酵罐规模制备CGTase奠定了基础。
[1]Kitahata S,Tsuyama N,Okada S.Purification and some properties of cyclodextrin glycosyltransferase from a strain of Bacillus species[J].Agric Biol Chem,1974,38:387-393.
[2]Aga H,Yoneyama M,Sakai S,et al.Synthesis of 2-O-α-D-glucopyranosyl-L-ascorbic acid by cyclomaltodextrin glucanotransferase from Bacillus stearothermophilus[J].Agric Biol Chem,1991,55:1751-1756.
[3]Szejtli J.The cyclodextrins and their applications in biotechnology[J].Carbohydr Polym,1990,12:375-392.
[4]Jun H K,Bae K M,Kim SK.Production of 2-O-α-D-glucopyranosyl-L-ascorbic acid using cyclodextrin glucanotransferase from Paenibacillus sp[J].Biotech Lett,2001,23:1793-1797.
[5]Kim C I,Kim M D,Park Y C,et al.Refolding of Bacillus macerans cyclodextrin glucanotransferase expressed as inclusion bodies in recombinant Escherichia coli[J].Microbiol Biotechnol,2000,10:632-637.
Clone and expression of cyclodextrin glycosyltransferase from Bacillus macerans in Escherichia coli
WANG Xiao-yu1,2,LIU Fei2,YAN Zhen2,ZHANG Li2,ZHU Xi-qiang2,GUO Xue-ping2,LING Pei-xue1,2
(1.School of Pharmaceutical Science,Shandong University,Jinan 250012,China;2.Biotechnology Center,Shandong Academy of Pharmaceutical Science,Jinan 250101,China)
Purpose To obtain the gene of cyclodextrin glycosyltransferase from Bacillusmacerans and to express it in Escherichia coli.Methods The expression plasmid of cyclodextrin glycosyltransferase from Bacillus macerans was constructed,then it was transferred into Escherichia coli DH5α,and positive clones were obtained by screening.After induction,the enzyme activity was detected.Results The cyclodextrin glycosyltransferase from Bacillus macerans was successfully expressed in Escherichia coli,and the enzyme activity was 3 U/mL.Conclusion The cyclodextrin glycosyltransferase from Bacillus macerans can be expressed efficiently in Escherichia coli.
cyclodextrin glycosyltransferase;Bacillus macerans;expression;Escherichia coli
Q78
A
1005-1678(2012)01-0046-03
2010-11-23
“泰山学者”建设工程专项经费资助
王晓玉,女,硕士研究生,微生物与生化药学专业,E-mail:xiaoyuw26@hotmail.com;凌沛学,通信作者,研究员,博士生导师,Tel:0531-81213003,E-mail:lpx@sdfmg.com。
- 中国生化药物杂志的其它文章
- 黄原胶纯化工艺研究进展

