重组毕赤酵母胸腺肽α1-人血清白蛋白基因工程菌高密度发酵及分离纯化
马娇颖,章成昌,仇黎鹏,姜玉涛,闫璐颖,陈 菁,陈建华
(中国药科大学 生命科学与技术学院,江苏 南京 210009)
重组毕赤酵母胸腺肽α1-人血清白蛋白基因工程菌高密度发酵及分离纯化
马娇颖,章成昌,仇黎鹏,姜玉涛,闫璐颖,陈 菁,陈建华
(中国药科大学 生命科学与技术学院,江苏 南京 210009)
目的 研究重组毕赤酵母胸腺肽α1-人血清白蛋白(Tα1-HSA)基因工程菌在30 L发酵罐中高密度发酵表达Tα1-HSA融合蛋白的发酵工艺及产物的分离纯化方法。方法 采用两步发酵法进行重组毕赤酵母Tα1-HSA基因工程菌的高密度发酵。发酵液经超滤浓缩,阴离子交换色谱,亲和色谱,凝胶过滤色谱等步骤进行分离纯化。结果 发酵结束后,菌体细胞湿重达到350 g/L,发酵液中蛋白产量达到2.0 g/L。发酵液经分离纯化后获得了纯度较高的重组Tα1-HSA融合蛋白,HPLC分析纯度达97.5%。结论 重组毕赤酵母Tα1-HSA基因工程菌高密度发酵的成功及分离纯化方法的建立为Tα1-HSA的进一步研究和开发奠定了基础。
胸腺肽α1;人血清白蛋白;毕赤酵母;高密度发酵;分离纯化
胸腺肽是胸腺分泌的具有生物活性的多种多肽类物质的统称,亦称胸腺素。胸腺肽α1(Tα1)是最早从胸腺素组分5(TF5)中分离出来的一种小分子活性多肽,由28个氨基酸残基组成,分子质量为3 108.37,是TF5的主要活性成分,具有很高的免疫增强活性。
Tα1主要用于治疗癌症、乙型肝炎、丙型肝炎以及HIV的感染[1],另外Tα1在治疗严重败血症疾病[2-3]、急性呼吸窘迫综合征(ARDS)[4]、严重急性呼吸器官综合症(SARS)[5]及全身感染性疾病等均有显著效果。目前,市场的 Tα1主要为化学合成[6],但化学合成的 Tα1成本较高,采用基因工程方法表达胸腺肽是一种简洁有效的途径,但是多肽表达后往往纯化困难,难以实现产业化。
人血清白蛋白(HSA)是血浆的重要成分,利用HSA在体内较长的半衰期,将Tα1与HSA融合表达,无需酶切即可得到具有生物活性的大分子重组蛋白,纯化方便,而且胸腺肽的半衰期得到延长。
巴斯德毕赤酵母是一种能高效表达外源蛋白的表达系统,具有遗传稳定性好、表达水平高、蛋白可翻译后加工、产物可分泌、可高密度发酵等许多优点,本研究中的Tα1-HSA融合蛋白可利用毕赤酵母表达系统进行分泌表达。相信利用基因工程技术进行Tα1-HSA融合蛋白的研究与生产将具有非常重要的意义。
1 材料
重组毕赤酵母Tα1-HSA基因工程菌,本实验室构建保存。
酵母提取物、酪蛋白胨,英国Oxiod公司;Bradford蛋白含量测定试剂盒,南京建成生物工程研究所。
YPD培养基:1%酵母提取物,2%胰蛋白胨,2%葡萄糖;发酵基础培养基:85%H3PO426.7 mL/L,CaSO4·2H2O 0.93 g/L,K2SO418.2 g/L,MgSO4·7H2O 14.9 g/L,KOH 4.13 g/L,甘油 40.0 g/L,组氨酸 0.15g/L,微量元素(PTM1)4.0 mL/L。
PTM1:CuSO4·5H2O 6.0 g/L,KI 0.088 g/L,MnSO43.0 g/L,Na2MoO4·2H2O 0.2 g/L,H3BO30.02 g/L,ZnCl220.0 g/L,FeSO4·7H2O 65.0 g/L,CoCl20.5 g/L,Biotin 0.2 g/L,H2SO45 mL/L。
30 L发酵罐,德国Biostar公司;超滤仪器,Millipore公司;蛋白电泳仪、凝胶成像仪,Bio-rad公司;Agilent 1100高效液相色谱仪,美国Agilent公司。
2 方法
2.1 重组毕赤酵母Tα1-HSA基因工程菌高密度发酵
2.1.1 种子培养 从新鲜YPD平板挑取重组毕赤酵母Tα1-HSA基因工程菌单菌落接种于YPD液体培养基100 mL中,于30℃ 恒温、220 r/min摇床培养18~20 h,转接于YPD液体培养基1.2 L中,于30℃ 恒温、220 r/min摇床培养18~20 h。
2.1.2 高密度发酵 配制发酵培养基12 L,加入30 L发酵罐,121℃、30 min高压灭菌培养基、发酵罐及管道。待发酵罐内培养基冷却到室温时,加入PTM1 24 mL,并接入种子培养液1.2 L,设置初始参数,启动发酵程序。待培养基中甘油耗尽,向培养基中流加甘油溶液,至菌体湿重达到350 g/L左右停止补加甘油,开始流加甲醇诱导。发酵过程始终控制温度在30℃,发酵液pH值为5.0,以调节搅拌转速和通气量的方式控制发酵液的溶氧为30%左右。诱导表达96 h后,结束发酵,发酵液4℃、8 000 r/min离心20 min,上清用于分离纯化。
2.2 重组Tα1-HSA融合蛋白分离纯化
2.2.1 超滤浓缩 参考蔡立涛等[7]的方法,使用孔径截留相对分子质量为30 kD的超滤膜进行超滤,至终体积为原发酵液体积的1/10。
2.2.2 DEAE Cellulose-52 阴离子交换色谱 柱体积30 mL,使用平衡缓冲液A(10 mmol/L磷酸缓冲液,pH 7.0)平衡色谱柱,上样后用平衡缓冲液A冲洗至基线平衡,再用平衡缓冲液A和洗脱液B(10 mmol/L 磷酸缓冲液,pH 7.0,1.5 mol/L NaCl)进行0~1.5 mol/L NaCl梯度洗脱,收集融合蛋白峰。
2.2.3 Sephadex G-25凝胶过滤色谱 柱体积150 mL,使用平衡缓冲液C(50 mmol/L磷酸缓冲液,pH 7.0)平衡色谱柱,上样后用平衡缓冲液冲洗,收集融合蛋白峰。
2.2.4 Blue Sepharose 6 Fast Flow亲和色谱 柱体积30 mL,使用平衡缓冲液C平衡色谱柱,上样后用平衡缓冲液冲洗至基线平衡,然后用洗脱缓冲液(50 mmol/L 磷酸缓冲液,pH 7.0,1.5 mol/L NaCl)洗脱融合蛋白。
2.2.5 Sephadex G-200凝胶过滤色谱 柱体积150 mL,用水平衡色谱柱,上样后用水冲洗,收集融合蛋白峰,将所得融合蛋白冷冻干燥,-20℃ 保存。
2.3 重组Tα1-HSA融合蛋白纯度分析
2.3.1 SDS-聚丙烯酰胺凝胶电泳法(SDS-PAGE)Tα1-HSA融合蛋白的电泳纯度测定采用SDSPAGE进行检测。分离胶浓度为10%,浓缩胶浓度为5%,上样量20μL,考马斯亮蓝R250染色,对电泳结果用凝胶成像仪成像,应用分析软件分析各条带的百分比,计算目的蛋白所占百分比。
2.3.2 高效液相色谱法(HPLC) 采用HPLC对Tα1-HSA融合蛋白进行纯度检测。色谱柱:Agilent ZORBAX SB-C18柱(4.6 mm ×250 mm,5 μm)。流动相A:10%乙腈溶液(含0.1%三氟乙酸);流动相B:90%乙腈溶液(含0.1%三氟乙酸),梯度洗脱:0~25 min,20% ~80% 流动相 B。流速:1.0 mL/min,柱温:25℃,检测波长:280 nm。以重组 Tα1-HSA融合蛋白色谱峰计算理论板数应不低于1 000。按面积归一化法计算重组 Tα1-HSA融合蛋白的纯度。
3 结果
3.1 重组毕赤酵母Tα1-HSA基因工程菌高密度发酵
发酵结束时,收获发酵上清液20 L,菌体湿重为350 g/L。诱导6 h时,发酵上清中就有重组Tα1-HSA融合蛋白表达,随着诱导时间的增加蛋白表达量也不断增加,细胞湿重曲线及融合蛋白表达曲线见图1。Bradford法测定蛋白浓度显示,经诱导表达96 h后,发酵液中蛋白的含量为2.0 g/L,成功实现了30 L发酵罐高密度发酵生产重组Tα1-HSA融合蛋白。表达产物的SDS-PAGE结果如图2。
3.2 重组Tα1-HSA融合蛋白分离纯化
发酵上清液经超滤处理后,可去除无机盐分子及一些小分子代谢产物,总蛋白浓度为发酵上清的8.6倍,目的蛋白回收率为91.8%。经DEAE Cellulose-52阴离子交换色谱,Sephadex G-25凝胶过滤色谱,Blue Sepharose6 Fast Flow亲和色谱,Sephadex G-200凝胶过滤色谱,经过整个纯化过程,重组Tα1-HSA融合蛋白的纯度由初始的70.0%提高到了97.5%,目的蛋白收率为40%,见表1。

图1 细胞湿重曲线及融合蛋白表达曲线Fig.1 Curves for cell wet weight and protein expression in recombinant P.pastoris cultivation

图2 不同诱导时间下融合蛋白表达情况的SDS-PAGE分析Fig.2 SDS-PAGE analysis for expression of protein in different time
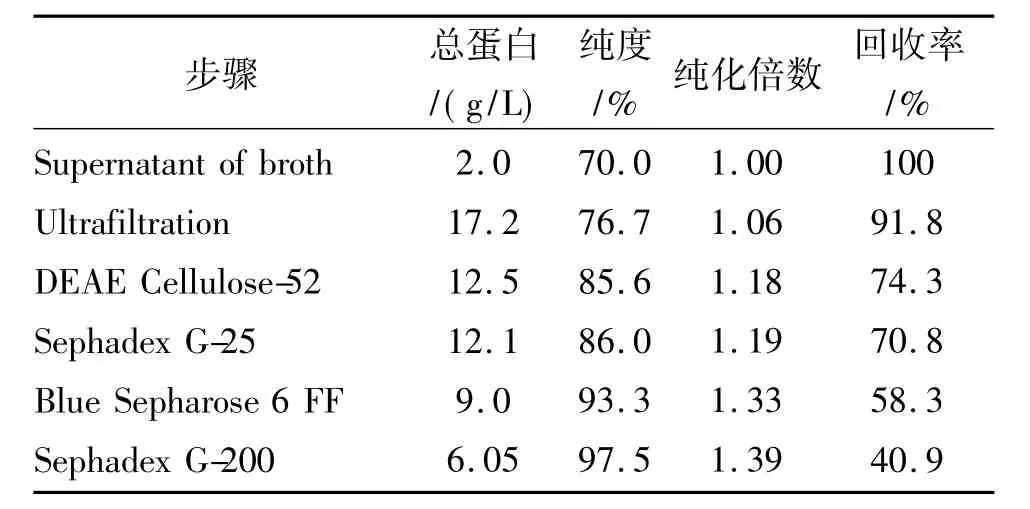
表1 Tα1-HSA纯化结果Tab.1 Result of purified Tα1-HSA
3.2.1 DEAE Cellulose-52阴离子交换色谱 超滤后浓缩液经DEAE Cellulose-52阴离子交换色谱,得到三个组分P1、P2、P3(如图3),电泳鉴定P1为少量杂蛋白,P2为色素和大部分杂蛋白,P3为目的蛋白,合并P3峰。
3.2.2 Blue Sepharose 6 Fast Flow亲和色谱 将上一步合并的目的蛋白溶液经Sephadex G-25凝胶过滤色谱脱盐,再经Blue Sepharose 6 Fast Flow亲和色谱,得到两个组分P1和P2(如图4),电泳鉴定P1为杂蛋白,P2为目的蛋白,合并P2峰。

图3 DEAE-52色谱纯化Tα1-HSAFig.3 DEAE-52 chromatography of Tα1-HAS

图4 Blue Sepharose 6 FF色谱纯化Tα1-HSAFig.4 Blue Sepharose 6 FF chromatography of Tα1-HSA
3.2.3 Sephadex G-200凝胶过滤色谱 将上一步合并的目的蛋白融合经Sephadex G-200凝胶过滤色谱,得到两个组分P1和P2(如图5),电泳鉴定P1为杂蛋白,P2为目的蛋白,合并P2峰。

图5 Sephadex G-200色谱纯化Tα1-HSAFig.5 Sephadex G-200 chromatography of Tα1-HSA
3.3 纯化过程中重组Tα1-HSA融合蛋白纯度鉴定
SDS-PAGE检测,纯化后的重组Tα1-HSA融合蛋白为单一条带(如图6)。融合蛋白纯度经HPLC分析为纯度为97.5%(如图7)。结果表明发酵液中的重组Tα1-HSA融合蛋白经过以上分离纯化过程,取得了较好的纯化效果。
4 讨论
Tα1作为一种免疫调节物质,具有很高的临床应用价值,但是作为一种小分子活性多肽,其在体内易被代谢和清除,半衰期较短[8]。谢琦等[9]将Tα1于胸腺5肽融合,使Tα1和胸腺5肽发挥协同作用,但Tα1的半衰期并未提高。本研究将Tα1与HSA融合表达,不仅Tα1的自身活性不受影响,而且其半衰期得到延长,易于纯化。高密度发酵是基因工程菌提高外源蛋白表达水平的一种重要策略,毕赤酵母高密度发酵表达外源蛋白是工业化生产重组蛋白的重要途径,目前已有多种重组蛋白通过毕赤酵母高密度发酵高效表达。酵母工程菌株的发酵主要分为3个阶段:第一阶段,在基础培养基中生长;第二阶段,流加甘油阶段,此阶段菌体迅速积累;第三阶段,使用甲醇作为碳源进行诱导表达,此时融合蛋白开始大量表达,耗氧量迅速增加。

图6 纯化过程中Tα1-HSA的SDS-PAGE分析Fig.6 SDS-PAGE analysis of Tα1-HSA after each step of purification

图7 HPLC分析Tα1-HSAFig.7 HPLC analysis of Tα1-HSA
本研究实现了重组Tα1-HSA融合蛋白在毕赤酵母中高效表达。在30 L多参数全自动发酵罐中,菌体细胞湿重达到350 g/L,诱导96 h后蛋白产量达到2.0 g/L,并且通过SDS-PAGE验证目的蛋白并无明显降解,蛋白酶的表达及活性得到抑制,目的蛋白高效表达。
对于生物大分子的分离,只使用单一的色谱方法很难将待分离物质完全分离,通常将几种原理不同的色谱技术组合起来以获得理想的纯化效果[10]。本文建立了重组Tα1-HSA融合蛋白纯化方法,总回收率为40%。其中超滤浓缩去除了部分小分子杂质及色素,成本低,可处理大量样品。DEAE Cellulose-52阴离子交换色谱可有效的去除大量色素及杂蛋白,具有载量大、分辨率好、流速高等优点。Blue Sepharose 6 Fast Flow亲和色谱可特异性结合目的蛋白,使目的蛋白纯度得到进一步提高,且稳定性好,基团脱落少,使用方便,可用于规模化生产应用。Sephadex G-200凝胶过滤色谱用于精制目的蛋白。经超滤、DEAE Cellulose-52阴离子交换色谱,Sephadex G-25凝胶过滤色谱,Blue Sepharose 6 Fast Flow亲和色谱,Sephadex G-200凝胶过滤色谱等步骤,重组Tα1-HSA融合蛋白纯度达97.5%。在重组Tα1-HSA融合蛋白的分离纯化过程中,本研究根据实际需要将不同纯化方法整合,不但使目的蛋白损失降低,而且纯度得到提高,本工艺路线步骤少、目的蛋白回收率高、操作方便、工艺稳定、易于放大、易于自动控制,具有工业化潜力。
本研究中的新型胸腺肽实现了Tα1的高效表达,并且建立了纯化路线,然而要将其开发成为新一代的长效药物,还需对其生物学活性和药代动力学特征进行进一步的考察和确定。
[1]Juan Lia,Chun Huiliua,Wang Fengshan.Thymosin alpha 1:Biological activities,applications and genetic engineering production[J].Peptides,2010,31(11):2151-2158.
[2]俞 杨,田金徽,杨克虎,等.胸腺肽α1治疗脓毒症的系统评价[J].中国危重病急救医学,2009,21(1):21-24.
[3]Yumin L,Hao C,Xun L,et al.A new immunomodulatory therapy for severe sepsis:ulinastatin plus thymosin(alpha)1 [J].JIntensive Care Med,2009,24(1):47-53.
[4]Ji SM,Li L S,Sun QQ,et al.Immunoregulation of thymosin alpha 1 treatment of cytomegalovirus infection accompanied with acute respiratory distress syndrome after renal transplantation [J].Transplant Proc,2007,39(1):115-119.
[5]高占成,朱继宏,孙 焱,等.医院内SARS暴发流行的临床分析[J].中国危重病急救医学,2003,15(6):332-335.
[6]李 洁,王晓杰,邹素兰.胸腺肽的临床应用与研究进展[J].中国药房,2008,19(14):1108-1109.
[7]蔡立涛,徐 祥,王婷婷,等.纳豆激酶基因在毕赤酵母中的表达纯化及抗体制备[J].中国生化药物杂志,2010,31(1):10-13.
[8]Qingfeng Liu,He Zhang,Guichen Zhou,et al.In vitro and in vivo study of thymosin alphal biodegradable in situ forming poly(lactide-co-glycolide)implants[J].Int J Pharm,2010,397(1-2):122-129.
[9]谢 琦,李 娟,王凤山.胸腺素α1-胸腺五肽在大肠杆菌中的表达及表达条件优化[J].中国生化药物杂志,2011,32(4):265-268.
[10]刘 睿,李友宾,段金廒.现代生物技术在动物药研究中的应用[J].中国生化药物杂志,2008,29(4):287-290.
High cell density fermentation and purification of recombinant Pichia Pastoris Tα1-HSA genetically engineered bacteria
MA Jiao-ying,ZHANG Cheng-chang,QIU Li-peng,JIANG Yu-tao,YAN Lu-ying,CHEN Jing,CHEN Jian-hua
(School of Life Science and Technology,China Pharmaceutical University,Nanjing 210009,China)
Purpose To study the high cell density fermentation of recombinant Pichia Pastoris Tα1-HSA genetically engineered bacteria,and the purification of expressed target protein.Methods A two-step fermentation is taken for the high cell density fermentation of recombinant Pichia Pastoris Ta1-HSA genetically engineered bacteria.Tα1-HSA was purified from fermentation broth by ultrafiltration,anion excha-nge chromatography,affinity chromatography and gel filtration chromatography.Results Through the control and optimization of fermentation conditions,the bacterial cell wet weight could reach 350 g/L and the productivity of expressed Tα1-HSA could reach 2.0 g/L in 30 L fermentor.High purity recombinant Ta1-of HSA fusion protein is obtained after separation and purification.The HPLC analysis shows that the purified Tα1-HSA has an overall purity of 97.5%.Conclusion The success of the high cell density fermentation and purification has laid a foundation for the further research and development of Tα1-HSA.
Tα1;HSA;Pichiα pastoris;high cell density fermentation;purification
TQ929;Q78
A
1005-1678(2012)06-0720-05
2012-03-22
马娇颖,女,硕士研究生,E-mail:majiaoying@163.com;陈建华,男,通信作者,教授,硕士生导师,Tel:025-83271265,E-mail:jhchen@cpu.ed.cn。

