高效液相色谱法快速测定脑梗塞模型大鼠脑组织中多胺的含量
何颖娜,尚京川,杨志强
(1.河北医科大学中医学院,河北 石家庄 050091;2.重庆医科大学药物化学和生物材料研究室,重庆 400016;3.河北瑞洲生物科技有限公司,河北 石家庄 050021)
高效液相色谱法快速测定脑梗塞模型大鼠脑组织中多胺的含量
何颖娜1,尚京川2△,杨志强*
(1.河北医科大学中医学院,河北 石家庄 050091;2.重庆医科大学药物化学和生物材料研究室,重庆 400016;3.河北瑞洲生物科技有限公司,河北 石家庄 050021)
目的:建立一种简便、灵敏和快速分离测定大鼠脑组织中腐胺、精脒和精胺等多胺含量的高效液相色谱法。方法:采用苯甲酰氯作为衍生化试剂,以1,6-己二胺为内标,采用polygocyl(250×4.6 mm 5 μm)C18色谱柱,流动相为甲醇-水(62:38 V/V),流速1.0 mL/min,检测波长229 nm。结果:本法线性范围是1~2 000/mL,回收率大于90%。日内和日间变异系数为1.5%~4.2%。最低定量浓度为1 nmol/mL。结论:该方法符合生物样品分析要求,为脑组织中多胺的含量测定提供了一种简便、准确、灵敏度高的分析方法。
多胺;高效液相色谱;固相萃取
多胺(polyamines)是指以腐胺(putrescine)、精胺(spermine)和精眯(spermidine)为代表的多个氨基的生物原物质。多胺做为体内促进细胞生长的重要物质之一,对细胞的生长、增殖及组织的再生起着关键性作用。在多种病理情况下(如肿瘤、脑损伤等),多胺的代谢可发生明显的紊乱。近年来的研究表明:脑组织的中多胺代谢的紊乱与多种脑损伤有密切关系,且损伤的程度不同变化不一,因此可以作为脑损伤严重程度的敏感指标[1]。为了探讨脑梗塞后脑组织中多胺的含量变化,本文提出一种简便、灵敏、快速的多胺检测方法,用于大鼠脑组织中多胺含量的测定,获得满意的结果。
1 材料与方法
1.1 材料
美国Angilent 1100高效液相色谱仪,UV 1100紫外检测器,Model TJ-R离心机(美国贝克曼公司),QL-901漩涡混匀器(江苏海门市琪琳医用仪器厂),固相萃取仪(美国安捷伦公司),Bond-Elut C18固相萃取小柱(美国安捷伦公司)。腐胺、精胺和精眯对照品(瑞士FluKa公司纯度99.9%)、1,6-己二胺(色谱纯)、苯甲酰氯(分析纯)、甲醇(色谱纯,美国天地公司)其余试剂均为分析纯。
样品收集方法:健康雄性Wistar大鼠40只,体重180~220 g(由重庆医科大学实验动物中心提供),随机分为对照组和脑梗塞组,脑梗塞组采用光化学诱导法制备大鼠局灶性脑梗塞模型。然后分别于梗塞后5 min、8 h、和24 h,将大鼠迅速断头处死,取梗塞周围脑组织约100 mg,液氮中保存,待检。对照组除不经过光照处理造成脑梗塞之外,其他处理同脑梗塞组。
1.2 方法
1.2.1 溶液配制对照品溶液:精密称取腐胺、精眯、精胺对照品8.8、14.7、20.2 mg(分别相当于腐胺、精眯、精胺100 mmol),置100 mL量瓶中,以5%HClO4溶解并定容,得1.0 mmol/mL的多胺对照品溶液。
对照品工作液:依次用5%HClO4稀释制成1、3、10、30、100、500、2 000 nmol/mL的多胺系列浓度对照品溶液。
内标溶液:精密称取1,6-己二胺对照品25.0 mg,置25 mL量瓶中,以5%HClO4溶解并定容,得1.0 mg/mL的内标溶液
内标工作液:再用5%HClO4稀释成50 μg/mL的内标工作液。
1.2.2 组织样品预处理取出液氮保存的脑组织,准确称量0.5 g,加入内标溶液10 μL和5%HClO45 mL,冰浴下匀浆(3 000 r/min)1 min,离心(13 000 r/min 4℃)10 min,顷出上清液,沉淀部分加入等量5%HClO4,混匀后,离心(13 000 r/min 4℃)10 min,合并两次提取液,加入等体积2.5 mol/LNaOH,待衍生。
1.2.3 衍生化反应和固相萃取在待衍生溶液中加入苯甲酰氯7 μL,涡旋混匀,40℃水浴中反应30 min,然后用6 mol/L HCl调节pH值为7左右,加在C18固相萃取柱(预先用甲醇3 mL活化,3 mL水平衡)上,依次用15 mL双蒸水、15 mL 15%甲醇和1 mL苯冲洗小柱,洗去极性杂质,抽干,以0.5 mL甲醇洗脱待测组分,混匀后取100 μL进行HPLC分析,以内标法定量。
1.2.4 色谱条件色谱柱:polygocyl C18(250×4.6 mm 5μm)(大连色谱中心填装);流动相:甲醇-水(62:38 V/V);流速:1.0 mL/min;检测波长:229 nm;柱温:25℃。
1.3 统计学分析
2 结果
2.1 多胺的色谱分离
多胺的标准品和样品按方法处理项操作,色谱图见图1,在此色谱条件下多胺分离较好,在线扫描显示标准多胺和样品多胺衍生物的紫外吸收光谱一致,最大吸收波长(λ max)为229 nm,以此为检测波长。
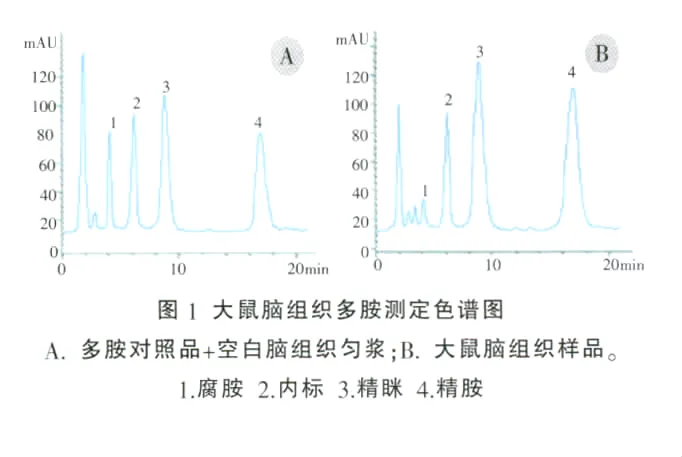
2.2 标准曲线、回收率及精密度
2.2.1 标准曲线取系列腐胺、精眯、精胺对照品溶液,按“样品处理方法”项下操作,以多胺的峰高和内标峰高之比(Hi/Hs)为横坐标,以多胺的浓度(C)为纵坐标,用加权最小二乘法(1/c2)进行回归,得到腐胺、精眯、精胺的回归方程分别为:
腐胺:C1=0.03129+4.496 Hi1/Hs1r=0.9955;(n=6)
精眯:C2=0.04789+4.591 Hi2/Hs2r=0.9996;(n=6)
精胺:C3=0.02321+5.495 Hi3/Hs3r=0.9993;(n=6)
结果表明:多胺的浓度在1~2 000 nmol/mL之间,C与Hi/Hs之间线性关系良好,最低定量限为1 nmol/mL。
2.2.2 回收率和精密度取多胺对照品溶液,加入内标溶液,按“样品处理方法”项下操作,根据峰高比计算多胺在脑组织中的回收率,测得回归率分别为:腐胺96.47%,精眯95.39%,精胺92.11%(n=6)。
日内误差和日间误差按回收率方法,对每个脑组织样品分别在日内各做5次,并在连续5d内分别各做一次,测得日内和日间精密度的变异系数在1.5%~4.2%之间。
2.3 大鼠脑组织中多胺的含量比较
采用本方法对和脑梗塞模型大鼠脑组织中多胺的含量进行测定(表1),结果表明:与对照组相比,梗塞后8 h和24 h大鼠脑组织中腐胺的含量明显增高(P<0.05),并且随着时间的延长,脑组织中多胺的含量有逐渐增高的趋势;而精胺和精眯的含量虽然有较大程度的增高,但大多数没有显著性差异。
表1 大鼠脑组织多胺的含量(±snmol/g)
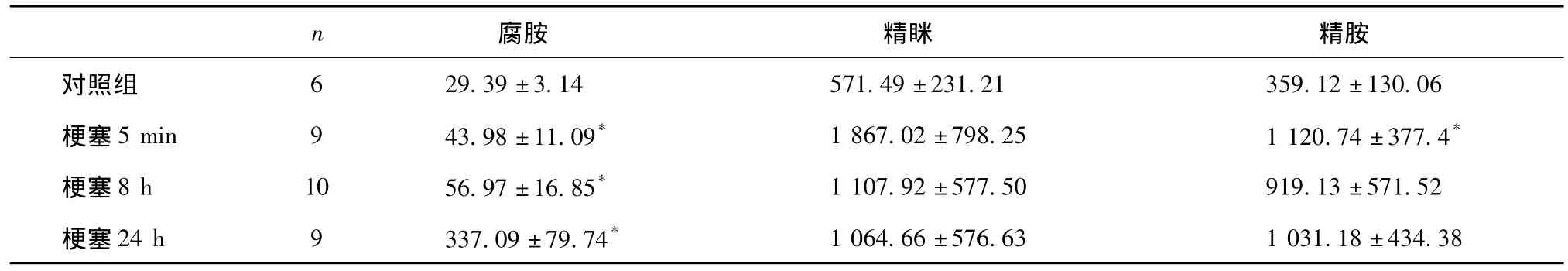
表1 大鼠脑组织多胺的含量(±snmol/g)
*:P<0.05,与对照组相比。
对照组 29.39±3.14571.49±231.21359.12±130.06梗塞5 min943.98±11.09*1 867.02±798.251 120.74±377.4*梗塞8 h1056.97±16.85*1 107.92±577.50919.13±571.52梗塞24 h9337.09±79.74*6 1 064.66±576.631 031.18±434.38
3 讨论
脑组织中生化的改变是反映神经损伤的敏感指标。其发生在损伤的早期和神经组织发生形态学改变之前。生化改变是神经系统功能紊乱的基础。精眯在体内具有广泛的生物学调控作用,促进细胞分化、增殖、生长、稳定细胞和亚细胞器结构、调控体内核酸、蛋白质的生物合成、修饰蛋白激酶等,是评价脑组织发育的有用指标。在动物和人体内鸟氨酸经脱羧酶作用生成腐胺,腐胺再进一步转化生成精眯、精胺等。成年动物脑中多胺的合成,在多种病理情况下会明显增加,尤其是在不同的病理阶段,多胺的合成对不同脑受损的应激状态这种敏感性,可作为脑损伤严重程度的敏感指标[2-3]。本实验的研究显示,缺血后脑组织中的腐胺含量明显增加,并且随着缺血时间的延长,含量成倍增长,提示腐胺的含量变化与缺血时间密切相关,而精胺和精眯的变化却不显著。
多胺的测定方法可分成化学法和生物法两类。虽然酶法和免疫法已有报道,但这些方法至今尚未完善。HPLC法具有分析速度快、检测灵敏度高、定量分析准确的特点,是目前临床疾病中多胺含量分析测定的主要手段。其中,反相高效液相色谱(RPHPLC)法被多数研究者选择用于多胺的分离和定量分析。多胺在可见和紫外区域既没有满意的吸收,也没有荧光成分,所以在采用HPLC测定时,一般需要对多胺进行化学衍化处理。根据其所用检测器的不同,可以将多胺的测定方法分为紫外检测法,荧光检测法以及电化学检测法,荧光检测法及电化学检测法的灵敏度较紫外法高,但是荧光检测法和电化学检测法衍生反应较慢,一般需要梯度洗脱,流动相消耗较大且时间很长,一般在40 min以上[4],而紫外检测法则具有衍生反应迅速、衍生产物稳定且使用等度洗脱、所用时间短等优点,因此适用于多胺的快速测定。
本方法以苯甲酰氯作为衍生试剂,衍生反应快速、稳定,采用等度洗脱、紫外检测。方法稳定性好,分析时间在20 min内,与荧光检测或者电化学检测法相比,分析时间大大缩短。
实验过程中采取直接称取脑组织,加入内标,然后进行匀浆的处理方法,不仅缩短前处理时间,还避免反复冻融脑组织样品对多胺含量的影响,保证结果的准确性脑组织样品经低温匀浆后,进行衍生化反应,然后经固相萃取,除去杂质,即可进行HPLC测定,前处理方法简便、快速,而且可以批量处理样品,满足脑组织中多胺快速测定的要求。
[1]Kim GH,Komotar RJ,McCullough-Hicks ME,et al.The role of polyamine metabolism in neuronal injury following cerebral ischemia[J].Can J Neurol Sci,2009,36(1):14-19
[2]Li J,Doyle KM,Tatlisumak T.Polyamines in the brain:distribution,biological interactions,and their potential therapeutic role in brain ischaemia[J].Curr Med Chem,2007,14(17):1807-1813
[3]Takano K,Ogura M,Nakamura Y,et al.Neuronal and glial responses to polyamines in the ischemic brain[J].Curr Neurovasc Res,2005,2(3):213-223
[4]Fu S,Xiao C,Zhao W,et al.Polyamines analysis by HPLC and their application as tumor markers[J].Front Biosci(Elite Ed),2012,(4):1795-1801
Rapid high performance liquid chromatography assay of polyamines in rat brains
HE Ying-na1,SHANG Jing-chuan2△,YANG Zhi-qiang3
(1.Traditional Chinese Medical College,Hebei Medical University,Shijiazhuang 050091,Hebei;2.Research Institute of Pharmic Chemistry and Biomaterials,Chongqing university of Medical Science,Chongqing 400016,Chongqing;3.Hebei Natural Co.Ltd.Shijiazhuang 050021,Hebei,China)
Objective:To develop a simple,sensitive and fast method for determination of putrescine,spermidine and spermine in mouse rat brains.MethodsWith the benzoyl chlorides as the derivation reagent and 1,6-Hexanediamine as the internal standard,the polyamines were separated on the polygocyl C18(250×4.6 mm 5μm)column using methanol-water(62:38 V/V)as the mobile phase(flow rate 1.0 mL/min)with UV detector at wavelength 229 nm.Results:The standard curve was linear in the content range 1-2000 nmol·mL-1.The recoveries were higher than 90%and the RSD was in the range from 1.5%to 4.2%.The low limits of quantification were one nmol/mL.Conclusion:The proposed method was suitable for screening polyamines in rat brains.
Polyamines;High performance liquid chromatography(HPLC);Solid-phase extraction(SPE)
1005-3697(2012)06-0538-04
R741
A
10.3969/j.issn.1005-3697.2012.06.004
河北科技支撑计划资助项目(11230908D-4-2)
2012-08-20
何颖娜(1977-),女,医学博士,讲师,主要从事药物代谢动力学研究。
△通讯作者:尚京川,E-mail:heyingna2002@163.com网络出版时间:2012-11-1217∶14
http://www.cnki.net/kcms/detail/51.1254.R.20121112.1714.020.html

