高效稠油降解菌DL1-G的筛选及降解特性
任妍君 ,陈梅梅 ,岳 勇 ,王 磊 ,王 靖 ,王万福 (.中国石油集团安全环保技术研究院,北京049;.中国石油大学化工学院,北京 0008;.中国农业大学生物学院,北京 0009)
石油泄漏进入环境后,少量组分挥发或降解,而大部分成分包括长链饱和烃、多环芳烃等组分不易挥发、有毒、难降解[1],且能随食物链富集[2].稠油成分复杂,长链饱和烃、芳烃、沥青质等重质组分含量较高,对生态环境和人体健康构成严重威胁. 研究表明,微生物降解是环境中石油去除的主要途径[3],与隔离、焚烧、填埋、化学氧化等方法相比,微生物处理法具有成本低、二次污染少等优点.
微生物是生物修复的执行者,筛选高效的石油降解菌是重心.目前有研究以纯烃(芴、芘等)为唯一碳源筛选出微嗜酸寡养单胞菌[4]和芽孢杆菌属[5],这些微生物能降解芴、芘、萘、菲、蒽等部分石油烃组分;袁红莉等[6]从辽河渣油中分离出一些石油降解菌,如微杆菌属、假单胞菌属等,但是这些菌只能对原油中部分长链烷烃、环烷烃、少数芳烃成分如烷基萘系物具有降解作用,降解范围较窄.目前对于重质成分含量较高的稠油的降解(尤其是结构较复杂的萜族化合物、三环以上的多环芳烃成分)鲜见报道.本研究从大连保税库区污染土壤中分离出 1株高效稠油降解菌 DL1-G,对其进行鉴定,并探讨了其对稠油及稠油不同组分的降解特性,以期为稠油污染的生物修复提供理论依据与技术支持.
1 材料与方法
1.1 材料
1.1.1 土壤样品 采自大连保税库区稠油污染园区,pH 值为6~6.5、含水率 0.003%、含油率0.37%、总有机质含量6.087g/kg.
1.1.2 原油 采自大连新港溢油事故区域,送至中国石油化工股份有限公司石油化工科学研究院测定其动力黏度为1196mPa⋅s,相对密度为0.976g/cm3,根据中国稠油分类标准,本实验所用原油为普通稠油.采用SY/T5119-1995石油天然气行业标准[7]规定的氧化铝吸附柱层析法确定稠油族组分组成及含量分别为:饱和烃 37.51%±0.08%,芳香烃 33.58%±0.90%,沥青质 9.84%±1.66%,非烃 15.93%±0.41%.
1.1.3 培养基 (1)无机盐培养基:KH2PO41.0g、K2HPO4·3H2O 2.5g、NaNO32.0g、NH4Cl 1.0g、MgSO4·7H2O 0.25g、CaCl20.01g、FeSO4·7H2O 0.01g、CuSO4·5H2O 0.01g、MnSO4·H2O 0.01g、NaCl 10.0g、去离子水1000mL, pH=6.5. (2)含油固体培养基:在无机盐培养液中加 1.4%琼脂(m/V),待培养基冷却后,取稠油均匀平铺其表面.(3)LB固体培养基:胰蛋白胨10.0g、酵母浸粉5.0g、NaCl 5.0g、琼脂20.0g、去离子水1000mL,pH=7.0.
1.2 稠油降解菌的富集、分离与复筛
取 10%土样(m/V)加到以稠油为唯一碳源的无机盐培养基中,180r/min、30℃培养 7d,取 5%富集液(V/V)转到含油量为1%(m/V)的无机盐培养基中,相同条件下培养,如此连续富集3次.吸取终富集液稀释涂布到含油固体培养基上,30℃培养 10d,观察到培养基上石油层变薄且出现透明圈,挑取透明圈处菌落,转接到LB固体培养基上,多次划线纯化,分离出单菌落.
1.3 菌株鉴定
1.3.1 形态及生理生化特性分析 通过平板方法观察菌落形态、光学显微镜结合结晶紫染色法观察菌体形态,并结合BIOLOG检测菌株生理生化特性[8],对分离到的DL1-G菌株进行鉴定.
1.3.2 16S rRNA 基因序列分析 (1)提取纯培养菌株基因组DNA[9];(2)PCR扩增16S rRNA基因[10]:以27F和1492R为引物,PCR扩增16SrRNA序列,获得约1.5kb的产物.具体PCR反应体系如下:1μL100倍稀释DNA模板,10×PCR反应缓冲液5μL,25mmol/LdNTP混合溶液 4μL,20pmol/L引物27F1μL,20pmol/L引物1492R1μL,Taq 酶(5U/μL)0.25μL,加灭菌去离子水至总体积为50μL.PCR扩增程序:94℃预变性5min,94℃变性1min,55℃退火1min,72℃延伸2min,35个循环,然后72℃延15min;30℃3min.PCR反应产物用2%琼脂糖凝胶电泳检测. (3)16S rRNA基因序列测定:纯化后的PCR产物送至博迈德测序公司进行序列测定,两个反应双向测通,用ContigExpress进行双向序列拼接. (4)序列同源性分析:序列信息输入EzTaxon Server 2.1数据库与标准菌株进行同源性比对,利用软件MEGA4.l,选择neighbor-joining方式,Kimura 2-parameter模型,自展1000次,构建发育树.
1.4 降解特性分析
接种5%(m/V)菌株DL1-G于含油0.1%的无机盐培养基中,180r/min、30℃培养9d,采用二氯甲烷萃取残油,利用氧化铝吸附柱层析法分析DL1-G菌降解前后的稠油族组分(饱和烃、芳香烃、沥青质和非烃)含量变化,根据稠油降解前后质量计算稠油降解率[11].该组实验设3个平行.
收集氧化铝层析柱分离出的饱和烃和芳香烃,采用Agilent 6890-5975c气相色谱-质谱联用仪加内标法对饱和烃、芳香烃成分进行分析,烷烃内标为氘代正构二十四烷,芳香烃内标为氘代二苯并噻吩.具体测试条件:色谱载气:99.999%氦气;进样口:300℃;传输线:280℃;色谱柱:HP-5MS弹性石英毛细柱(60m×0.25mm×0.25μm);升温程序:50℃保持1min;再以15℃/min升至120℃,以30℃/min升至300℃,保持25min;载气流速:1mL/min.质谱EI源,绝对电压1047V;全扫描和离子扫描同步进行.
2 结果与讨论
2.1 稠油高效降解菌DL1-G的筛选与形态特征
从大连保税库区污染土壤中富集分离出一株稠油高效降解菌(命名 DL1-G),在筛选培养过程中,稠油被分散成细小油滴,培养液表面未出现连成片的油膜,溶液浓稠、呈深褐色.石油烃被乳化分散成小油滴,增大了油水接触面积,有利于微生物摄取代谢[12].
用LB固体培养基对菌株DL1-G的形态进行观察,菌落颜色为米白色,圆形,稍微隆起,湿润光滑,无荧光,不透明,边缘整齐略带微小毛刺;光学显微镜观察该菌株细胞形态为杆状,椭圆型芽孢中生.
2.2 菌株DL1-G鉴定分析
2.2.1 生理生化鉴定分析基于微生物利用不同碳源进行新陈代谢过程中的颜色变化,用BIOLOG全自动微生物鉴定系统对菌株DL1-G进行鉴定分析,结果显示该菌株与Bacillus flexus相似性最高,属于好氧型革兰阳性细菌.具体碳源利用情况见表1.

表1 DL1-G菌对不同碳源利用情况Table 1 The utilization of different carbon sources by strain DL1-G
2.2.2 16S rRNA 序列分析及系统发育树构建将16S rRNA基因序列进行比对分析,结果显示与菌株DL1-G同源相似性大于98%的都是Bacillus属菌株,结合生理生化特点,推断该菌株属于芽孢杆菌属Bacillus sp..其中与DL1-G相似性最高的菌株是 Bacillus flexus(100%,登录号:AB021185),其次为Bacillus aryabhattai(98.927%,登录号:EF114313)和Bacillus megaterium(98.927%,登录号:D16273).
基于neighbour-joining构建系统发育树(图1),菌株 DL1-G与菌株 Bacillus flexus、Bacillus aryabhattai、Bacillus megaterium等同源性>95%的15个芽孢杆菌属的菌种共同构成连贯的集群,菌株DL1-G与Bacillus flexus位于同一发育分支.自1989年被报道以来, Bacillus flexus被发现对硝基苯、邻硝基甲苯、3-硝基苯、4-硝基苯的降解能力[13],未见有关其降解石油烃的报道.
2.3 稠油高效降解菌DL1-G的降解特性
2.3.1 总烃及族组分分析 重量法测定菌株DL1-G 9d对稠油(饱和烃37.58%,芳烃32.68%)的降解率达39.89%+1.43%;与史继诚等[14]报道的假单胞菌对沙特油田重质油(饱和烃 81.24%,芳烃12.49%)18d降解率42.8%相当,也与何丽媛等[15]报道的4株单菌对奥斯柏格轻质油的降解率相当(单菌及其降解率分别为洋葱伯克霍尔德氏菌40.23%、鞘氨醇单胞菌42.2%、假单胞菌48.45%、Pandoraea pnomenusa 30.52%).本实验原油为稠油,其饱和烃含量较低,而芳香烃等重质成分含量较高,因此,菌株 DL1-G对稠油具有较好的降解潜力.
对DL1-G菌降解前后稠油进行族组成分析,结果见表2.稠油经菌株DL1-G作用后,饱和烃、芳香烃含量明显降低,分别降低67.40%、69.29%,二者含量总和与降解前相比降低了68.30%,而非烃、沥青质的含量有所增加.可见,降解前后稠油族组分波动较大,这显示了菌株DL1-G对稠油中不同组分的代谢利用具有选择性[16].对于菌作用后非烃、沥青质含量增加的现象,可能是微生物代谢过程中产生了大量高碳有机酸等非烃类物质所致[17-18].

图1 基于16S rRNA序列建立的DL1-G菌与相关菌的系统发育树Fig.1pHylogenetic tree of strain DL1-G and the related strains based on 16S rRNA gene sequence

表2 降解前后稠油族组分含量变化Table2 The variation in proportion of group compositions in heavy oil before and after the degradation by strain DL1-G
2.3.2 饱和烃和芳香烃组成分析 进一步确定DL1-G菌作用下饱和烃和芳香烃具体组成的变化,将族组分分离得到的饱和烃与芳香烃进行气相色谱-质谱分析,用内标法计算降解前后稠油中各烃组分的含量.

图2 降解前、后饱和烃总离子流谱Fig.2 The spectra of saturated hydrocarbons before and after the degradation by strain DL1-G
饱和烃组分分析:由GC-MS结果分析可知(图2),饱和烃经DL1-G菌作用后,组成及含量发生较大变化(表 3 ).保留时间 34min之前的峰全部消失,饱和烃降解了 95.75%,其中,nC11~nC38、nC6~nC30-烷基环已烷及姥鲛烷(27.179min)、植烷(30.657min)均未检出,C14~C16二环倍半萜烷降解率达99.38%,8α(H)-补身烷、8β(H)-补身烷、8β(H)-升补身烷降解率达99.59%,13β(H),14α(H)-C19~C29三环萜烷降解率达36.32%,11种甾烷类化合物(表4)降解率达 12.04%,而未见藿烷类化合物有明显的降解.可见,菌株 DL1-G不仅对正构烷烃有较好的降解效果,而且对结构较复杂的环烷烃、萜族化合物也有降解效果,但对不同化合物的降解能力不同,为正构烷烃、环烷烃、类异戊二烯烃、二环倍半萜烷、补身烷>三环萜烷、甾烷>藿烷,与包建平等[19]的研究结果(补身烷>甾烷>藿烷系列>三环萜烷、四环萜烷和伽马蜡烷)一致.对于姥鲛烷等难降解的生物标志物,菌株DL1-G也表现出较好的降解作用,这可能是由于稠油中的正构烷烃的含量较低,使得微生物从培养初期就大量利用重质成分[20],导致其含量不断降低;已有研究表明[21-24],在不同环境条件下,包括姥鲛烷、植烷、霍烷、甾烷在内的多种生物标志物能被微生物降解利用.
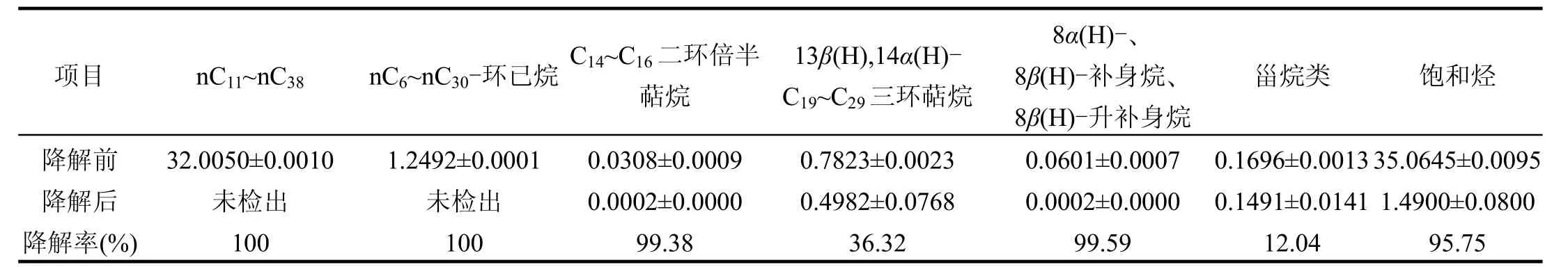
表3 菌株DL1-G作用前后饱和烃组成及相对含量变化(μg/mg)Table 3 The changes in the relative contents of saturated hydrocarbons under the action of strain DL1-G(μg/mg)
由 GC-MS分析结果可知(图3),芳香烃经DL1-G作用后,烃组分的相对含量发生了很大变化(图4).保留时间44min之前的峰几乎全部消失,萘系物、芴系物、二苯并噻吩系物、菲系物等化合物占总检出物的85.68%,其总降解率为81.62%,单个物质的降解率分别为98.61%、98.34%、93.01%、72.83%;蒽、联苯系物、二苯并呋喃系物、萤蒽、芘、苯并[a]芴、苯并[b]荧蒽、苯并[b]芴、甲基芘系物、苯并[a]蒽及苯并[k]荧蒽占总检出物的7.45%,其总降解率为53.28%,单个物质的降解率分别为98.55%、89.55%、83.42%、73.78%、64.85%、51.38%、50.27%、42.45%、29.23%、25.25%、10.03%.可见菌株 DL1-G对多种芳烃组分都有降解能力,但对不同化合物的降解具有选择性,使得降解率出现差异,如图4所示,化合物分子量与降解率总体成负相关,低分子量化合物优先被降解.从图4中还可以看出,菌株DL1-G对分子量较大的苯并[b]荧蒽的降解率也较好,说明芳香烃的可降解性还与其分子结构有关.

图3 降解前、后芳烃总离子流谱Fig.3 The spectra of aromatic hydrocarbons before and after the degradation by strain DL1-G

图4 芳烃及多环芳烃组分相对含量变化及降解率Fig.4 Degradation rate and variation in the relative content of aromatic hydrocarbons and polycyclic aromatic hydrocarbons
本研究筛选的降解菌DL1-G对16种USEPA优控多环芳烃中的多种成分都有较好的降解效果(图4b),其对蒽、菲、芴、芘、萘降解率均达到60%以上,分别为98.55%、97.16%、82.98%、64.85%、63.61%.由此可见,菌株DL1-G对多环芳烃的降解范围较大、降解效果较好,而且降解过程克服了稠油中其他复杂成分的影响,具有较好的应用前景.
3 结论
3.1 研究筛选出一株具有较好稠油降解能力的菌株DL1-G,鉴定为弯曲芽孢杆菌.9d内菌株DL1-G对稠油的降解率达39.89%.
3.2 菌株 DL1-G不仅对正构烷烃有较好的降解效果,而且对结构较复杂的环烷烃和萜族化合物降解效果也较好,饱和烃中nC11~nC38、nC6~nC30-烷基环已烷、姥鲛烷、植烷及部分萜族化合物几乎被完全降解.
3.3 菌株 DL1-G对芳烃降解能力较高,其中萘系物、芴系物、二苯并噻吩系物、菲系物、联苯系物等组分的降解率均达到70%以上;对16种多环芳烃中的萘、芴、蒽、菲、芘的降解率均达60%以上,对苯并[b]荧蒽也有较好的降解效果,降解率达50.27%.
[1]魏晓芳,张忠智,罗一菁,等.重质石油污染土壤的生物修复 [J].化学与生物工程, 2005,7:7-9.
[2]Sartoros C, Yerushalmi L, Béron P, et al. Effects of surfactant and temperature on biotransformation kinetics of anthracene and pyrene [J]. Chemosphere, 2005,61(7):1042-1050.
[3]Venosa A D, Zhu X. Biodegradation of crude oil contaminating marine shorelines and freshwater wetlands [J]. Spill Science and Technology Bulletin, 2003,8(2):163-178.
[4]唐玉斌,王晓朝,陈芳艳,等.芴降解优势菌的筛选鉴定及降解特性研究 [J]. 中国环境科学, 2010,30(8):1086-1090.
[5]Ling J Y, Zhang G Y, Sun H B, et al. Isolation and characterization of a novel pyrene-degrading Bacillus vallismortis strain JY3A [J]. Science of the Total Environment, 2011, 409(10):1994-2000.
[6]袁红莉,杨金水,王占生,等.降解石油微生物菌种的筛选及降解特性 [J]. 中国环境科学, 2003,23(2):157-161.
[7]SY/T5119-1995 中华人民共和国石油天然气行业标准 [S].
[8]邵宗泽,许 晔,马迎飞,等.2株海洋石油降解细菌的降解能力[J]. 环境科学, 2004,25(5):133-137.
[9]Marmur J. A procedure for the isolation of deoxyribonucleic acid from micro-organisms [J]. Journal of Molecular Biology, 1961,3(2):208-218.
[10]Duckworth A W, Grant W D, Jones B E, et al. Phylogenetic diversity of soda lake alkaliphiles [J]. FEMS Microbiology Ecology, 1996, 3(19):181-191.
[11]李 慧,陈冠雄,张 颖,等.高效石油烃降解菌的分离鉴定及降解特性 [J]. 哈尔滨工业大学学报, 2007,39(10):1164-1169.
[12]苏荣国,牟伯中,王修林,等.微生物对石油烃的降解机理及影响因素 [J]. 化工环保, 2001,21(4):205-208.
[13]Mulla S I, Manjunatha T P, Hoskeri R S, et al. Biodegradation of 3-nitrobenzoate by Bacillus flexus strain XJU-4 [J]. World Journal of Microbiology and Biotechnology, 2011,27(7):1587-1592.
[14]史继诚,贾凌云.微生物降解重油的初步研究 [J]. 化工环保,2005,25(6):427-429.
[15]何丽媛,党 志,唐 霞,等.混合菌对原油的降解及其降解性能的研究 [J]. 环境科学学报, 2010,30(6):1220-1227.
[16]张廷山,兰光志,邓 莉,等.微生物降解稠油及提高采收率实验研究 [J]. 石油学报, 2001,22(1):54-57.
[17]黄 学,伍晓琳,侯兆伟,短芽孢杆菌和蜡状芽孢杆菌降解原油烃机制研究 [J]. 石油学报, 2006,27(5):92-95.
[18]陈传平,梅博文,易绍金等.砂岩储层中原油微生物降解的模拟实验研究 [J]. 沉积物学报, 1997,15(1):135-140.
[19]包建平,朱翠山,马安来,等.微生物降解原油中生物标志物组成的定量研究 [J]. 江汉石油学院学报, 2002,24(2):22-26.
[20]郭利果,梁生康,陆金仁,等.2种原油中烃类生物标志物生物降解性评价 [J]. 环境科学, 2010,31(8):1898-1903.
[21]Elmendorf D L, Haith C E, Douglas G S, et al. Relative rates of biodegradation of substituted polycyclic aromatic hydrocarbons[C]// Hinchee R E, Leeson A, Semprini L, et al (eds.).Bioremediation of chlorinated and polycyclic aromatic hydrocarbon compounds. Boca Raton, FL: Lewis Publishers,1994:188-202.
[22]Venosa A D, Haines J R, Holder E L. Rates of hydrocarbon biodegradation in the field compared to the laboratory [C]//In-situ and On-site Bioremediation. Columbus O H: Battelle Press,1997,4:359-364.
[23]贾群超,郭楚玲,卢桂宁,等.两株稠油高效降解菌的筛选鉴定及其降解性能研究 [J]. 环境工程学报, 2011,5(5):1181-1185.
[24]Frontera-Suau R, Bost F D, Mcdonald T J, et al. Aerobic biodegradation of hopanes and other biomarkers by crude oil-degrading enrichment cultures [J]. Environmental Science and Technology, 2002, 36(21):4585-4592.

