益生菌混合菌种在发酵豆乳中的优化
高凤祥, 张艳杰
(1.北华大学 公共卫生学院,吉林省 吉林市 132013;2.北华大学 后勤管理处,吉林省 吉林市 132013;3.北华大学 附属医院,吉林省 吉林市 132013)
益生菌混合菌种在发酵豆乳中的优化
高凤祥1,2, 张艳杰3
(1.北华大学 公共卫生学院,吉林省 吉林市 132013;2.北华大学 后勤管理处,吉林省 吉林市 132013;3.北华大学 附属医院,吉林省 吉林市 132013)
采用益生菌混合物AST和TLB分别在42℃进行豆乳的发酵,在发酵豆乳的发酵和贮存过程中(4℃下28 d),观察p H值和活菌数的变化情况。在AST益生菌混合物(嗜酸性乳杆菌,双歧杆菌和嗜热链球菌)的培育下,42℃下发酵时间减少到8 h。但嗜酸性乳杆菌在冷藏的过程中生存状态较差,其活菌数在冷藏后一周后未达到标准。将豆乳在42℃下用TLB益生菌(嗜热链球菌,保加利亚乳杆菌和动物双歧杆菌乳酸亚种Bb12)进行发酵,结果发酵时间缩短到4 h,双歧杆菌活菌数目的对数增加了约一半,而且经过28 d的冷藏,细菌数仍然维持在107CFU/m L以上。
发酵豆乳;益生菌;乳杆菌;双歧杆菌;存活性
基于营养和健康的因素,豆乳制品越来越受到欢迎。我国是大豆的故乡,大豆中含有丰富的脂肪酸、蛋白质、多种维生素、矿物质和其它各种营养素。在中国,牛乳制品占主导地位,这对消费者而言,可供选择的种类单一,尤其对牛乳过敏的消费者和素食主义者更是望而却步。豆乳含有丰富的低聚糖,是促乳酸菌特别是双歧杆菌生长的良好益生元[1],而发酵豆乳既能发挥大豆的营养功效又能去除大豆中的抗营养因子,这是一种集大豆营养与乳酸菌功效于一体的新型保健产品[2]。
目前,最常见的益生菌基本都属于乳酸菌和双歧杆菌菌属[3]。采用单一益生菌进行豆乳发酵,如鼠李糖乳杆菌(Lactobaci lus acidophillus GG)或动物双歧杆菌乳酸亚种(Bifidobacterium animalis subsp.lactisBb12),发酵时间一般要18 h以上[4]。因此,为了缩短发酵时间,Bozanic等人[5]采用了BCT混合益生菌培养物(含有双歧杆菌Bifidobacterium spp.,干酪乳杆菌Lactobacillus casei和嗜热链球菌Streptococcus thermophilus)进行发酵,发酵时间缩短为6~7 h,但是其发酵产物中活菌数并未明显增加。
本研究的目的是在合适的时间内进行发酵并在最后的发酵产物产生足够的活益生菌(单种益生菌数>106 CFU/m L),并且能够稳定冷藏超过28 d,这也是我国益生菌产品的基本要求[6]。作者采用了两种不同的益生菌混合培养物进行发酵,首先采用3种益生菌混合菌种(AST组合)嗜酸性乳杆菌,双歧杆菌和嗜热链球菌,随后用又采用了嗜热链球菌、动物双歧杆菌乳酸亚种Bb12和保加利亚乳杆菌(TLB组合)来进行发酵,就是为了在缩短发酵时间的基础上来获得足够多的活益生菌。
1 材料与方法
1.1 材料
嗜酸性乳杆菌(Lactobacillus acidophilus,简称L.acidophilus),双歧杆菌(Bifidobacterium spp.,简称B.spp)和嗜热链球菌(Streptococcus thermophilus,简称S.thermophilus)、动物双歧杆菌乳酸亚种Bifidobacterium animalis subsp.lactisBb12,简称B.animalisBb12)和保加利亚乳杆菌(Lactobacillus bulgaricus,以下简称L.bulgari-cus):均由科·汉森(中国)有限公司提供。脱脂脱腥大豆粉:购自山东万得福实业集团有限公司;其他试剂均为分析纯。
1.2 器材
PHSJ-4A型p H计:上海精密科学仪器有限公司;恒温恒湿箱 ws/08-01:同济大学机电厂;LD5-2A离心机:北京医用离心机厂;Cary 300紫外分光光度仪:美国 Varian公司;NSC-ⅡA-1200型无菌工作台:日本。
1.3 实验方法
1.3.1 菌种活化将菌株接种于10 g/d L无菌脱脂乳培养基中,分别按最适温度培养,产酸凝乳后即进行传代。经过2~3次活化,菌种活力充分恢复后用于后续试验。
1.3.2 发酵豆乳的制作复原豆乳(脱脂脱腥大豆粉为6 g/d L,葡萄糖为1.5 g/d L)预热至65℃,20 MPa均质,95℃杀菌5 min,冷却至42℃进行培养。接入发酵剂时先接入发酵剂AST(3种益生菌接种量都为1×106CFU/g豆乳),观察记录过程中的变化;接入发酵剂TLB(3种益生菌接种量都为1×106CFU/g豆乳)时,恒温发酵培养至p H 4.6时,终止发酵[7],冷藏于4℃。发酵期间每2小时、冷藏期间每7天取样,用于样品p H值游离氨基氮(FAN)以及活菌数的检测。
1.3.3 pH值的测定精密p H计测量。
1.3.4 游离氨基氮质量浓度的测定游离氨基氮(FAN)的测定采用邻苯二甲醛衍生比色法,参照Lemieux等[8]和 Church等[9]的方法,在340 nm 下用分光光度计测定吸光值,确定游离氨基氮质量浓度。
1.3.5 活菌数的测定样品用1 g/d L灭菌蛋白胨水梯度稀释至一定浓度后,采用培养基平板倾注法,测定发酵豆乳样品中各种益生菌的活菌数。
1.4 数据统计分析
每个实验重复3次,结果数据以平均值±标准差的形式表示。
2 结果与分析
2.1 豆乳在AST混合益生菌中发酵过程及贮存过程中的变化
2.1.1 AST混合益生菌发酵过程中的化学和微生物变化采用AST混合益生菌的在42℃条件下,p H达到4.6时发酵时间只需8 h,较单菌发酵时间大大的减少。p H变化和FAN变化见图1(a),p H值在第4小时开始下降明显,此变化与FAN的变化趋势相同。
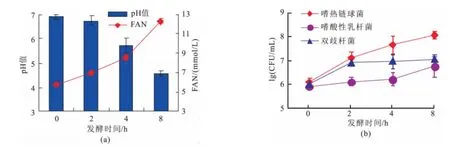
图1 豆乳在AST混合益生菌中发酵期间的p H、FAN(a)及活菌数(b)变化Fig.1 Time-course of pH,FAN value(a)and viable cells count(lg CFU/mL)(b)3 probiotic bacteria during soymilk fermentation with AST culture
在发酵结束后,对各时间点所取样品进行活菌数检测。发酵豆乳中各种益生菌的活菌数的变化如图1(b)所示,以嗜热链球菌(S.thermophilus)增加的比较明显(1.13×108CFU/m L),但嗜酸性乳杆菌(L.acidophilus)和双歧杆菌(B.spp)的活菌数 相 对 较 少 (1.11 × 107CFU/m L),尤 其L.acidophilus的活菌数仅为5.42×106CFU/m L,仅比接入的原始活菌数1.0×106CFU/m L高一点。
2.1.2 AST混合益生菌发酵后贮藏过程中的化学和微生物变化AST混合益生菌的发酵样品在4℃贮藏28 d后,p H变化和FAN变化见图2。p H值在28 d内基本保持不变,游离氨基氮在前7天出现了较明显的下降,7~28 d的FAN有所回升。
为检测益生菌产品的稳定性,对贮藏期发酵豆乳的活菌数需进行检测。发酵豆乳中各种益生菌的活菌数的变化见表1。S.thermophilus和B.spp的活菌数相对比较稳定,但L.acidophilus在14 d后的活菌数已经降到1.0×106CFU/m L的水平线下。

图2 AST发酵豆乳在贮藏期间的p H和FAN变化Fig.2 Time-course of pH and FAN during 28 days of cold storage of fermented soymilk with AST culture
表1 AST 3种益生菌在发酵豆乳的贮藏过程中活菌数测定结果Tab.1 Viable cells count(lg CFU/mL)of 3 probiotic bacteria during 28 days of cold storage of soymilk fermented with AST culture (n=3,±SD)

表1 AST 3种益生菌在发酵豆乳的贮藏过程中活菌数测定结果Tab.1 Viable cells count(lg CFU/mL)of 3 probiotic bacteria during 28 days of cold storage of soymilk fermented with AST culture (n=3,±SD)
发酵菌株贮藏过程中的活菌数/lg(CFU/m L)1 d 7 d 14 d 21 d 28 dS.thermophilus 8.07±0.03 8.13±0.078.24±0.01L.acidophilus 6.62±0.028.17±0.13 8.09±0.116.12±0.12B.spp .7.03±0.095.75±0.065.32±0.31 4.94±0.026.83±0.217.12±0.197.08±0.03 6.91±0.05
2.2 豆乳在TLB混合益生菌中发酵过程及贮存过程中的变化
基于AST混合益生菌的发酵结果,可看出虽然发酵时间可明显缩短,但L.acidophilus在豆乳中发酵的生存状态较差,所以,又研究了新的益生菌搭配,采用了酸乳酪培养物TLB(含有保加利亚乳杆菌)进行发酵研究。
2.2.1 TLB混合益生菌发酵过程中的化学和微生物变化采用TLB混合益生菌进行发酵,发酵时间只需4 h,较AST混合物发酵时间又进一步的减少了。其过程中的p H变化和FAN变化见图3(a),p H值在第2小时就开始有明显的下降。
TLB混合物发酵的豆乳中各种益生菌的活菌数的变化见图3(b)所示。依然以嗜热链球菌(S.thermophilus)增加的明显(7.76×108CFU/m L),乳杆菌的生长也和AST培养物中类似,是生长最慢的一种益生菌,但在4 h后,保加利亚乳杆菌(L.bulgaricus)和 动 物 双 歧 杆 菌 乳 酸 亚 种(B.animalisBb12)的活菌数也分别达到或者接近了107CFU/m L。

图3 豆乳在TLB混合益生菌中发酵期间的p H、FAN(a)及活菌数(b)变化Fig.3 Time-course of pH,FAN value (a)and viable cells count(lg(CFU/mL))(b)3 probiotic bacteria during soymilk fermentation with TLB culture
2.2.2 TLB混合益生菌发酵后贮藏过程中的化学和微生物变化TLB混合益生菌发酵后的样品贮藏28 d后,p H变化和FAN变化见图4。p H值在这28 d内保持不变,游离氨基氮在前7天下降的较在AST培养物中缓和,整个过程基本能保持平稳。
TLB混合物种的3种益生菌在发酵豆乳贮藏28 d后活菌数的变化见表2。S.thermophilus的活菌数贮藏28 d后出现了小幅度的增加,突破了109CFU/m L,L.bulgaricus略微下降,约5.45×106CFU/m L,B.animalisBb12在此期间维持的相对平稳,约5.5×107CFU/m L。可见,此环境下的益生菌生长状态还明显好于AST培养混合物,而且发酵时间更短。

图4 TLB发酵豆乳在贮藏期间的p H和FAN变化Fig.4 pH and FAN value of during 28 days of cold storage of soymilk fermented with TLB culture
3 结语
随着发酵豆乳的需求日益增大,人们积极研究在豆乳发酵中所用的益生菌搭配,以求获得最优的豆乳饮品[10]。在豆乳发酵中有着2个关键的因素分别是发酵时间和发酵后及贮藏中的活菌数的含量。
作者分别通过2种不同的益生菌搭配组成相应的培养物,分别是AST混合菌及TLB混合菌,在42℃的条件下发酵时间分别是8 h和4 h。Bozanic等[11]通过研究发现,豆乳在42℃下比37℃下发酵时间能短1~2 h,而且,双歧杆菌以及酸奶酪益生菌(如保加利亚乳杆菌)在42℃下更适合生长。B.animalisBb12是一种能显著利用蔗糖的益生菌,也可能是产生相对多的乳酸而造成TLB益生菌混合物发酵豆乳中的p H值下降更快的一个原因。.
表2 TLB 3种益生菌在发酵豆乳的贮藏过程中活菌数测定结果Tab.2 Viable cells count(lg((CFU/mL))of 3 probiotic bacteria during 28 days of cold storage of soymilk fermented with TLB culture (n=3,±SD)
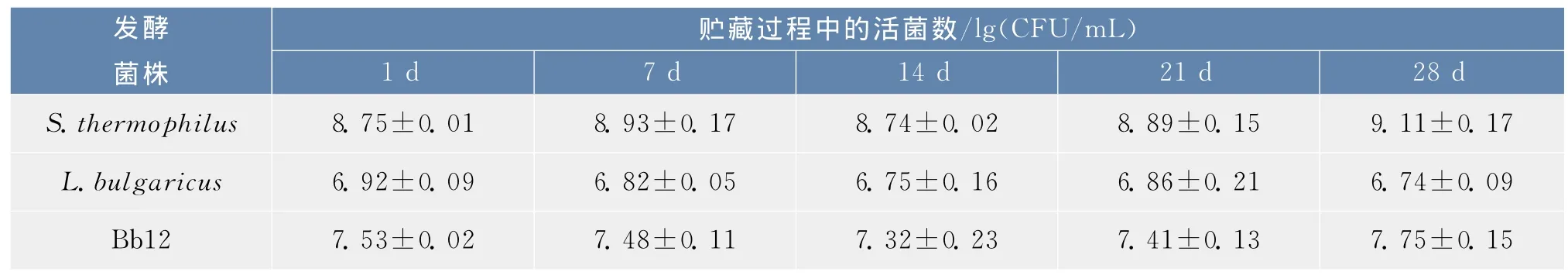
表2 TLB 3种益生菌在发酵豆乳的贮藏过程中活菌数测定结果Tab.2 Viable cells count(lg((CFU/mL))of 3 probiotic bacteria during 28 days of cold storage of soymilk fermented with TLB culture (n=3,±SD)
发酵菌株贮藏过程中的活菌数/lg(CFU/m L)1 d 7 d 14 d 21 d 28 dS.thermophilus 8.75±0.01 8.93±0.178.74±0.02L.bulgaricus 6.92±0.098.89±0.15 9.11±0.176.82±0.05Bb127.53±0.026.75±0.166.86±0.21 6.74±0.097.48±0.117.32±0.237.41±0.13 7.75±0.15
TLB益生菌混合物能将发酵时间缩短为4 h,极大的提高了生产酸豆奶的生产效率,并提高了设备利用率,而且还保证了发酵豆乳中益生菌的数量能维持在107CFU/m L以上,下一步实验将研究各益生菌中的配比问题,争取获得一个最佳比例的搭配。本研究为工业化生产发酵大豆酸乳产品及其推广应用提供了科学依据,同时为研制和开发其它多功能益生菌豆乳制品提供了新的思路和方法。
(References):
[1]张勇,刘勇,张和平.世界益生菌产品研究和发展趋势[J].中国微生态学杂志,2009,21(2):185-193.
ZHANG Y,LIU Y,ZHNAG H P.Research and development of probiotics product in world[J].Chinese Journal of Microecology,2009,21(2):185-193.(in Chinese)
[2]Wang Y C,Yu R C,Yang H Y,et al.Growth and survival of bifidobacteria and lactic acid bacteria during fermentation and storage of cultured soymilk drinks[J].Food Microbiology,2002,19:501-508.
[3]Tamime A Y,Saarela M,Korslund Sondergaard A,et al.Production and maintenance of viability of probiotic micro-organisms in dairy products[J].Probiotic Dairy Products,2005:39-72.
[4]Božanic,Brletic S,Lovkovic S.Influence of temperature and sugar addition on soymilk fermentation by probiotic bacteria[J].Mljekarstvo,2008,58:61-68.
[5].Božanic R,pletikapic g,Lovkovic S.Influence of temperature and glucose addition on growth and survival of BCT culture in soymilk[J].Mljekarstvo,2008,58:171-179.
[6]张青,王记成,魏爱彬,等.益生菌干酪乳杆菌Zhang和双歧杆菌V9发酵豆乳的研究[J].乳业科学与技术,2010,33(1):1-5.
ZHANG Qing,WANG Ji-cheng,Wei Ai-bin,et al.Investigation of the growth and survival activities of probioticsLactobacillus caseizhang andBifidobacterium animalisV9 in soymilk[J].Journal of Dairy Science and Technology,2010,33(1):1-5.(in Chinese)
[7]Vissesanguan W,Benjakul S,Potachareon W,et al.Accelerated proteolysis of soy proteins during fermentation of Thua-Nao innoculated withBacillus subtilis[J].Journal of Food Biochemistry,2005,29:349-366.
[8]Lemieux L,Puchades R.Free amino acids in cheddar cheese:comparison of quantitation methods[J].Journal of Food Science,1990,55(6):1552-1554.
[9]Church F C,Swaisgood H E,Catignani G L.Spectrophotometric assay using o-phthaldialdehyde for determination proteolysis in milk and isolated milk proteins[J].Journal of Dairy Science,1983,66(6):1219-1227.
[10]陈健凯,潘裕添,林洵,等.活性乳酸菌乳饮料高活菌数发酵工艺的优化 [J].食品与生物技术学报,2009,28(4),559-563.
CHEN Jian-kai,PAN Yu-tian,LIN Xun,et al.Optimized the fermentation conditions for highly activeLactococcusin fermented milk beverage[J].Journal of Food Science and Biotechnology,2009,28(4),559-563.(in Chinese)
[11]Božanic R,Lovkovic S,Jelicic I.Optimising fermentation of soymilk with probiotic bacteria[J].Czech J Food Sc,2011,29(1):51-56.
Optimizing Fermentation of Soymilk with Combination of Probiotic Bacteria
GAO Feng-xiang1,2,ZHANG Yan-jie3
(1.College of Public Health,Beihua University,Jilin 132013,China;2.Logistics Management Office,Beihua University,Jilin 132013,China;3.Affiliated Hospital,Beihua University,Jilin 132013,China)
The objective of this study is to produce a probiotic fermented soymilk with the aim of shortening the fermentation time.For this,soymilk was fermented with probiotic culture AST and yoghurt culture TLB at 42℃,during the fermentation and storage of the fermented soymilk(28 days at 4℃,the changes in pH-value and viable cells count were observed.Fermentation time significantly reduces to 8 h at 42℃ with AST culture(Lactobacillus acidophilus,Bifidobacterium spp.,and Streptococcus thermophilus).However,Lactobacillus acidophilus survived poorly during cold storage and the viable cells count was under the probiotic minimum as soon as after the first week of storage.Soymilk was fermented at 42℃ with TLB culture(Streptococcus thermophilus,Lactobacillus bulgaricus,Bifidobacterium animalis subsp.lactis Bb12).Consequently,the fermentation time was shortened to 4 hours whereby the viable cells count of bifidobacteria increased during fermentation for the half of the logarithm scale approximately.During 28 days of cold storage,bacterial count remained over 107 cfu/m L.
fermentation of soymilk,probiotic strain,Lactobacillus,Bifidobacterium,survival
高凤祥(1971-),男,吉林省吉林市人,工程师,主要从事食品工程方面的研究。E-mail:583419733@qq.com
TQ 920.1
A
1673-1689(2012)04-0443-05
2011-03-08

