海洋放线菌不同分离方法的比较研究
常显波, 刘文正, 尹 琦, 张晓华
(1. 中国海洋大学 海洋生命学院, 山东 青岛 266003; 2. 烟台大学 环境与材料工程学院, 山东 烟台264005)
海洋放线菌不同分离方法的比较研究
常显波1,2, 刘文正1, 尹 琦1, 张晓华1
(1. 中国海洋大学 海洋生命学院, 山东 青岛 266003; 2. 烟台大学 环境与材料工程学院, 山东 烟台264005)
采用平板涂布法, 以青岛海区潮间带沉积物为对象进行海洋放线菌的分离方法研究。具体分析了不同样品预处理方式、稀释液、海水浓度和培养基种类等对分离效果的影响。结果表明, 55℃预处理样品6 min能有效减少细菌数量, 利于潮间带沉积物中放线菌的分离; 以1/4 林格氏溶液稀释样品、纯海水配置培养基, 可以分离得到较多的放线菌; 不同培养基对沉积物中放线菌的分离效果差别很大,本实验设置的M1~M9培养基中, M1、M6、M7和M8培养基的分离效果优于其他5种。
海洋沉积物; 放线菌; 分离方法
随着从海洋环境中发现越来越多的新放线菌和活性产物, 海洋放线菌成为新药开发和天然活性产物的重要来源[1-2]。由于海洋环境的特殊性, 目前对海洋放线菌的分离和培养仍然存在一些技术问题,有很大一部分海洋放线菌未能培养出来。因此从海洋环境中有效分离放线菌是放线菌研究的重要内容。目前海洋放线菌的分离方法基本借鉴于陆生放线菌, 尚未有一个被广泛接受的方法。本研究以青岛海区潮间带沉积物为对象, 探索和比较放线菌分离方法, 寻求适合于沉积物中放线菌分离的有效方法。
1 材料和方法
1.1 样品采集
样品采自青岛第一海水浴场附近潮间带沉积物,去掉表层约5 cm, 用无菌的样品勺采集5~20 cm处沉积物样品1份, 用无菌三角烧瓶盛放, 放于冰盒保存, 并立即带回实验室进行实验研究。
1.2 不同因素对放线菌分离效果的影响实验
1.2.1 样品预处理
采用3种方法预处理样品: 将1 g样品平铺于无菌培养皿内, 真空干燥约24 h, 磨细成粉末; 将1 g样品在55℃水浴中加热6 min; 将1 g样品平铺于无菌培养皿内, 在 120℃干燥箱中加热 1 h。分别将预处理后沉积物样品, 用1/4林格氏溶液稀释, 在纯海水配置的M1培养基上进行放线菌的分离。
1.2.2 培养基中海水浓度
采用 5种浓度(0、25%、50%、75%、100%)海水配置M1培养基。将经过55℃水浴6 min的样品,用1/4林格氏溶液稀释, 分别涂布于不同浓度海水配置的M1培养基上进行放线菌的分离。
1.2.3 样品稀释液
采用3种稀释液进行样品稀释: 无菌海水、无菌生理盐水(0.85 % NaCl)、无菌1/4 林格氏溶液(0.9 %NaCl、0.04 % CaCl2、0.04 % KCl)。将经过 55℃水浴6 min的样品, 分别用3种稀释液进行稀释, 在纯海水配置的M1培养基上进行放线菌的分离。
1.2.4 培养基
放线菌分离效果比较用的 9种培养基基础成分示于表1。将样品55℃水浴6 min, 用1/4 林格氏溶液稀释, 分别涂布于纯海水配制的不同培养基上进行放线菌的分离。
所有分离培养基中均添加终质量浓度为 25 mg/L的萘啶酮酸以抑制快速生长的细菌。同时添加终质量浓度为100 mg/L的制霉菌素溶液以抑制真菌的生长[3]。

表1 沉积物海洋放线菌分离培养基Tab. 1 Media for the isolation of marine actinobacteria from sediments
1.3 放线菌菌株分离方法
放线菌的分离采用平板涂布法[5]。均称取样品10 g, 分别加入装有玻璃珠的90 mL 无菌稀释液中,150 r/min震荡20 min后, 静置30 min, 取上清液, 逐级稀释至10-3, 各取100 μL涂布平板, 每个处理设3个重复, 28℃培养箱中培养7~15 d后进行放线菌菌落计数。
1.4 数据统计分析
所有统计分析均在 SPSS 17.0 (SPSS Inc, Chicago, USA)上完成。
2 结果
2.1 不同预处理方式对样品中放线菌分离效果的影响
从表 2可以看出, 用不同方式预处理底泥样品对放线菌的分离有较大影响, 放线菌数量与不同预处理样品方式间有显著差异。其中, 样品经过 55℃水浴6 min所获得的放线菌数量最多, 虽然还存在一定数量的细菌, 但细菌数量不会影响到放线菌的分离。样品经过120℃加热处理1 h可以明显地减少细菌数量, 但目标放线菌的数量也随之减少。样品经过真空干燥处理后细菌数量有明显的减少, 但放线菌数量也比新鲜底泥中放线菌数量有所降低。样品经过 55℃水浴6 min分离到的放线菌数量与真空干燥和120℃加热1 h处理样品间差异显著, 但3种方式预处理样品对细菌数量的影响差异不显著。
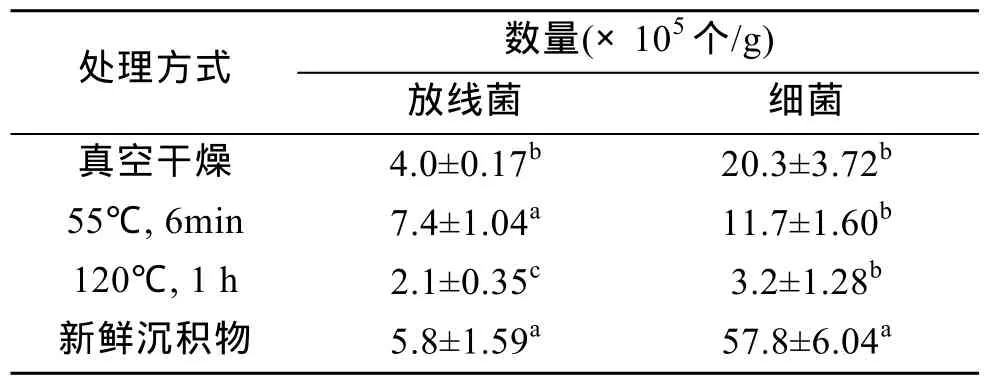
表2 不同预处理方式对放线菌分离效果的影响Tab. 2 Influence of different pretreaments on the isolation of marine actinomycetes
2.2 海水浓度对放线菌分离效果的影响
从表 2可以看出, 随着培养基中海水比例的增加, 放线菌数量和细菌数量呈增加的趋势, 但放线菌和细菌数量与培养基中海水比例之间没有显著差异。用100%海水配置的培养基中分离到的放线菌数量最多, 其次是 75%和 50%海水配置的培养基, 用蒸馏水和 25%海水配置的培养基中分离到的放线菌数量最少。
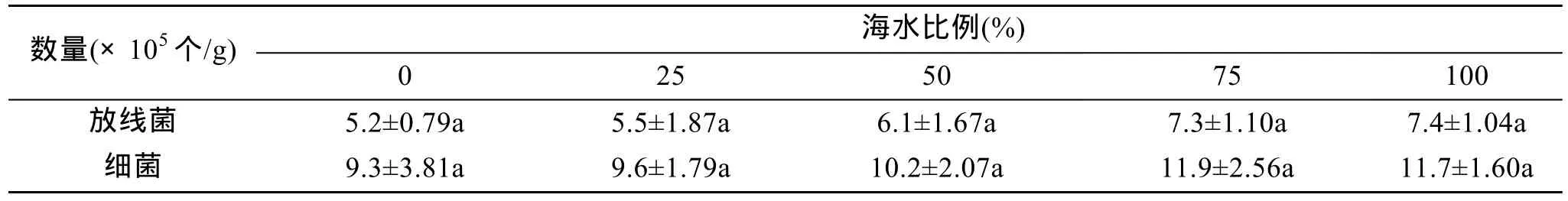
表3 海水浓度对放线菌分离效果的影响Tab. 3 Influence of seawater percentage level on the isolation of marine actinomycetes
2.3 不同稀释液对放线菌分离效果的影响
从表 4可以看出, 不同稀释液对放线菌的分离有影响, 但放线菌和细菌数量与稀释液种类之间没有显著差异。1/4 林格氏溶液稀释样品获得的放线菌数量最多, 而后依次为纯海水和生理盐水。
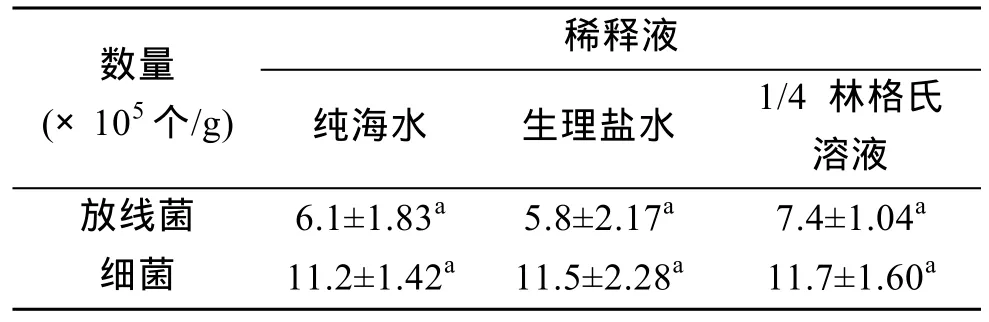
表4 不同稀释液对放线菌分离效果的影响Tab. 4 Influence of different dilutents on the isolation of marine actinomycetes
2.4 不同培养基对放线菌分离效果的影响
表 5显示了不同培养基分离到的放线菌数量。可见不同培养基对放线菌的分离效果差别很大, 放线菌数量与培养基种类有显著差异。分离到放线菌数目较多的培养基为M1, 其次是M6、M8和M7, 而培养基M5和M9分离到的放线菌数量最少。培养基M1分离的放线菌数量除与培养基M6差异不显著外,与其余各种参试培养基的差异均达到显著水平。
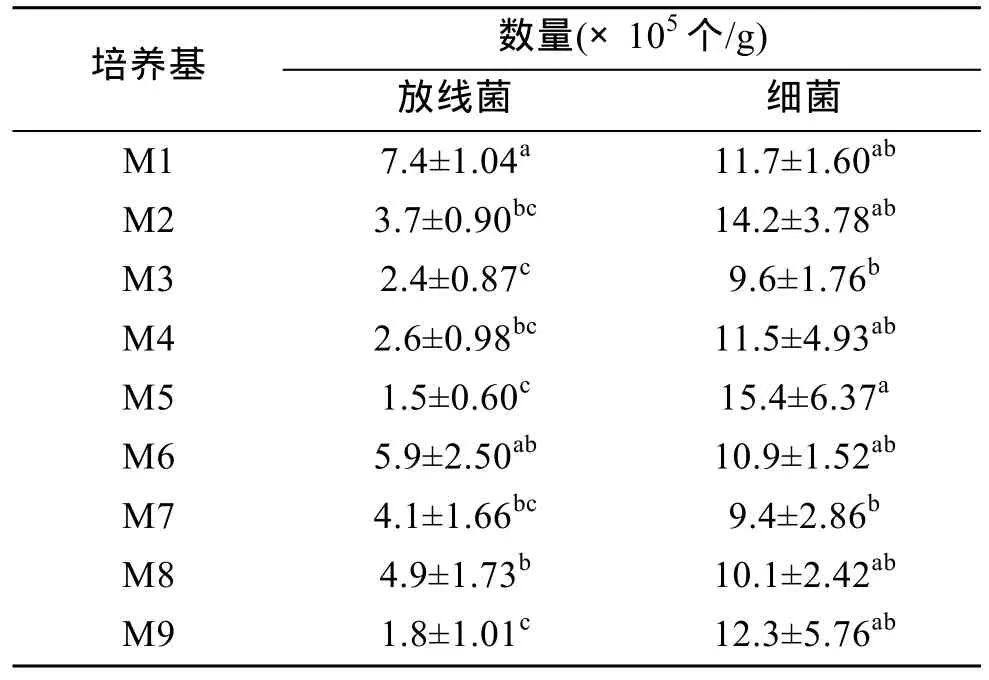
表5 不同培养基对放线菌的分离效果的影响Tab. 5 Influence of different media on the isolation of marine actinomycetes
3 讨论
目前从海洋环境中分离放线菌, 通常通过一些物理、化学方法预处理样品。其优点一方面可以选择性分离稀有放线菌, 另一方面可以有效抑制杂菌的生长。放线菌是一类革兰氏阳性细菌, 细胞壁较厚,主要以孢子形式萌发, 其孢子具有耐热、耐干燥的性质, 适当的温度处理能刺激放线菌孢子萌发。而一般细菌细胞壁相对较薄, 对热、干燥环境比较敏感, 易发生质壁分离而失去生命力。王海雁等[6]对南麂岛海域沉积物样品进行了真空干燥、热预处理发现, 海洋沉积物经干燥处理、50℃热处理20 min均能有效地减少细菌数量, 利于海洋沉积物中放线菌的分离。Michael等[7]通过加热和苯酚预处理海洋沉积物样品,可以很好地抑制竞争性细菌的生长。本研究中, 底泥样品经过55℃处理6 min, 放线菌的分离效果明显好于 120℃加热处理 1h和真空干燥预处理, 样品经过55℃处理6 min有利于放线菌孢子的萌发, 提高放线菌的检出率, 同时对细菌的生长有一定的抑制作用。研究认为, 放线菌的菌丝体会与环境样品缠绕在一起形成团粒结构, 如何打破团粒结构束缚、使菌丝体释放出来, 是放线菌分离的重要条件之一。Maldonado等[8]利用分散差速离心(Dispersion and Differential Centrifugation, DDC)方法预处理海泥样品, 结果表明 DDC法能很好地分散底泥样品, 比传统的震荡分离方法更有效、是比较理想的海泥样品预处理方法。
海水浓度能影响海洋放线菌生长环境的渗透压,在配置海洋放线菌培养基时应该考虑所用海水的浓度。王海雁等[6]用不同比例海水配置培养基分离放线菌, 结果显示 60%陈海水配置的培养基中, 放线菌分离数量明显高于纯海水配置的培养基。但在本研究中用不同比例海水配置的培养基分离到的放线菌数量有差异, 但差异不显著。为了模拟海洋环境, 提高盐度和渗透压, 更多地分离出海洋放线菌, 用纯海水配置培养基是比较好的选择。
放线菌的分离培养基多种多样, 培养基中营养物质组成和比例对于放线菌的分离效果有着重要影响。Abdelmohsen等[9]利用8种培养基对11种海绵来源放线菌多样性进行了研究, 结果表明不同种类培养基在分离放线菌的数量和多样性上有很大差异,用培养基M1分离出11个属、27株放线菌, 而培养基MA仅分离出1属、2株放线菌。Jensen等[3]利用加入了沉积物和海砂洗脱液培养基对关岛海底沉积物进行研究, 结果表明分离的菌株中有高比例(82%~91%)的放线菌属于海洋特有放线菌。同时他们还发现, 在培养基中加入低比例的营养成分能分离出更多的海洋特有放线菌。在本研究的 9种分离培养基中, 培养基M1、M6、M7和M8上分离到的放线菌菌数量较多, 其中M1和M6的主要碳源为可溶性淀粉和棉子糖, 这是放线菌偏好的营养成分[10]。M8中含有放线菌比较喜好的两种营养成分: 精氨酸和甘油[11], 分离得到放线菌的数量也比较高, 很多研究者也都发现甘油-精氨酸培养基的分离效果较好[12-14]。在M7中含有能抑制真菌生长的丙酸钠[15], 有利于放线菌的分离。培养基M1和M9的分离效果差别很大, 其营养成分的主要差别是KNO3和K2HPO4的含量, 可能由于M1培养基中含有较高比例的K、P等必须离子的无机盐, 有利于放线菌生长繁殖。
本实验指出, 用 1/4 林格氏溶液稀释样品的分离效果好于用纯海水和生理盐水稀释。在国外很多对海洋放线菌的研究中[4,16], 均采用1/4 林格氏溶液稀释样品, 相比较纯海水和生理盐水, 1/4 林格氏溶液稀释样品可能更有利于活化放线菌的休眠孢子,但具体机制尚待研究。
作者利用上述分离方法研究了黄海冷水团和北极海区沉积物中放线菌的多样性, 取得了很好的分离效果, 并从黄海冷水团沉积物中分离到一个海洋放线菌新属[17]。研究结果表明, 在这两个海区中存在着丰富的放线菌和新菌资源, 许多菌株对病原菌有抑菌活性并能产生多种胞外酶,具有非常巨大的开发利用前景。
[1]Goodfellow M, Fiedler H P. A guide to successful bioprospecting: informed by actinobacterial systematic[J].Antonie van Leeuwenhoek, 2010, 98: 119-142.
[2]Solanki R, Khanna M, Lal R. Bioactive compounds from marine actinomycetes[J]. Indian J Microbiol, 2008,48: 410-431.
[3]Jensen P R, Gontang E, Mafans C, et al. Culturable marine actinomycete diversity from tropical Pacific Ocean sediments[J]. Environ Microbiol, 2005, 7:1039-1048.
[4]Maldonado L A, Frangoso Y D, Perez-Garcia A, et al.Actinobacterial diversity from marine sediments collected in Mexico[J]. Antonie van Leeuwenhoek, 2009,5: 111-120.
[5]周德庆. 微生物学实验教程[M].北京: 高等教育出版社, 2006.
[6]王海雁, 刘健, 赵淑江. 南麂岛海域沉积物中海洋放线菌的分离研究[J].海洋科学, 2010, 34(1): 48-51.
[7]Michael A P, Michael J S, Madelyn M L. Application of pretreatments for the isolation of bioactive actinomycetes from marine sediments[J]. Appl Microbiol Biotechnol, 1986, 25: 285-288.
[8]Maldonado L A, Stach J E, Pathom-aree W, et al. Diversity of cultivable actinobacteria in geographically widespread marine sediments[J]. Antonie van Leeuwenhoek, 2005, 87: 11-18.
[9]Abdelmohsen U R, Pimentel-Elardo S M, Hanora A, et al. Isolation, phylogenetic analysis and anti-infective activity screening of marine sponge-associated actinomycetes[J]. Mar Drugs, 2010, 8: 399-412.
[10]杨宇容, 徐丽华, 李启任, 等. 放线菌分离方法的研究[J].微生物学通报, 1995, 22(2): 88-91.
[11]Takahashi Y, Omura S. Isolation of new actinomycete strains for the screening of new bioactive compounds[J].J Gen Appl Microbiol, 2003, 49: 141-154.
[12]Sun W, Dai S K, Jiang S M, et al. Culture-dependent and culture-independent diversity of actinobacteria associated with the marine spongeHymeniacidon perlevefrom the South China Sea[J]. Antonie van Leeuwenhoek, 2010, 98: 65-75.
[13]王宏梅, 赵心清. 可培养海洋放线菌生物多样性的研究进展[J]. 微生物学通报, 2007, 34(5): 996-1000.
[14]Zhang H, Lee Y K, Zhang W, et al. Culturable actinobacteria from the marine spongeHymeniacidon perleve: isolation and phylogenetic diversity by 16S rRNA gene-RFLP analysis[J]. Antonie Van Leeuwenhoek, 2006, 90(2): 159-169.
[15]Zakharova O S, Zenova G M, Zvyagintsev D G. Some Approaches to the selective isolation of actinomycetes of the genus Actinomadura from soil[J]. Microbiology,2003, 72: 110-113.
[16]Bredholdt H, Galatenko O A, Engelhardt K, et al. Rare actinomycete bacteria from the shallow water sediments of the Trondheim fjord, Norway: isolation, diversity and biological activity[J]. Environ Microbiol,2007, 9: 2756-2764.
[17]Chang X B, Liu W Z, Zhang X H.Spinactinospora alkalitoleransgen. nov. sp. nov., a novel marine actinomycete isolated from sediment near the Yellow Sea Cold Water Mass, China[J]. Int J Syst Evol Microbiol,2012, 62: 954-959.
Comparative study of different methods for isolation of marine actinomycetes
CHANG Xian-bo1,2, LIU Wen-zheng1, YIN Qi1, ZHANG Xiao-Hua1
(1. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China; 2. College of Environmental & Material Engineering, Yantai University, Yantai 264005, China)
May, 4, 2011
marine sediment; actinomycete; isolation method
The isolation techniques for marine actinomycetes from the inter-tidal sediment at Qingdao were studied by using the series dilution and plate spreading methods. The impacts of different pretreatments, diluents, seawater concentrations and media on the isolation of actinomycetes were investigated. The results showed that the growth of bacteria were obviously restrained in the samples when pretreated with 55°C for 6 minutes, which enhanced the isolation of actinomycetes from the inter-tidal sediment; dilution of the samples with 1/4 Ringer's solution and spreading them on the media prepared with pure seawater could improve the isolation of actinomycetes. The 9 media exhibited significant differences on the number of actinomycetes recovered, with media M1, M6, M7 and M8 being more effective than others.
P736. 2; Q939. 1
A
1000-3096(2012)08-0035-05
2011-05-04;
2011-11-14
国家高技术研究发展计划资助项目(2007AA09Z434); 国家海洋局海洋生物活性物质与现代分析技术重点实验室开放基金资助项目(MBSMAT-2010-02); 烟台大学博士启动基金资助项目(HJ11B26)
常显波(1978-), 女, 山东即墨人, 讲师, 在读博士, 从事放线菌资源与应用研究 ,电 话:15063835727, E-mail:cxb780806@126.com; 张晓华, 通信作者, 教授, E-mail:xhzhang@ouc.edu.cn
谭雪静)

