羧基化磁性纳米微球的表面生物修饰方法
石 良, 王锡昌, 刘 源, 卢 瑛
(上海海洋大学 食品学院,上海 201306)
羧基化磁性纳米微球的表面生物修饰方法
石 良, 王锡昌, 刘 源, 卢 瑛*
(上海海洋大学 食品学院,上海 201306)
采用A和B两种羧基化磁珠,以山羊抗小鼠IgG为模式蛋白,优化了EDC/sulfo-NHS法的羧基磁珠表面抗体的修饰条件,对比分析了抗体修饰前后磁珠粒径和多分散系数(PDI)的变化,并利用竞争性免疫层析法评价了磁珠表面修饰抗体的生物学活性。优化结果显示,不同粒径和厂家的羧基磁珠,其表面的最佳抗体修饰条件是不同的。磁珠A抗体修饰前后的平均水力学粒径变化率为6.55%,PDI分别为0.011和0.046,变化微小,而磁珠B在抗体修饰前后的平均水力学粒径变化率为135.55%,分散性能变差。生物学活性评价结果显示优化条件下制备的磁珠A和B表面的抗体均具有较好的抗原结合活性,磁珠B的磁信号强于磁珠A。综上所述,抗体修饰磁珠用于免疫层析检测时,抗体修饰前后磁珠粒径和分散性能的变化、材料的磁响应性能对于检测灵敏度和层析速度具有重要意义。
磁珠;生物修饰 ;EDC;免疫层析
超顺磁性纳米微球(Superparamagnetic nanoparticles,SMNs,简称磁珠)的主要特点是在外加磁场的作用下可以被磁化而显示出磁性,能够被迅速分离出来。当外加磁场撤离后它没有剩磁因而又可重新分散到液体中,其生物相溶性和悬浮稳定性较好[1-2]。生物活性分子可通过磁珠表面的官能基团结合到SMNs上,应用于分离、检测和临床诊断等领域中[1,3-6],是医学、分子生物学、免疫学等研究中的重要载体工具。另外,研究显示SMNs结合免疫层析技术和磁性分析系统可以实现定量的快速检测,目前在人促绒毛性腺激素、心肌肌钙蛋白及HIV病毒等的快速检测中已有相应报道[7-9]。
根据表面化学基团的不同,磁珠可采用不同的化学交联剂,如醛类(甲醛、戊二醛等)、碳化二亚胺类、双环氧类物质以及氰异酸盐等[10]进行生物分子的修饰。羧基化磁珠表面生物分子的修饰以碳二亚胺类中的1-乙基-(3-二甲基氨基丙基(EDC)缩合法最为常用。Gélinas等[11]成功地将 Diethylenetriamine(DETA)配体固定到羧基化磁珠的表面,并发现蛋白质在功能化磁珠表面的偶联率、生物学活性及磁珠粒径的变化均会直接影响到其应用效果[11-12]。作 者 以 山 羊 抗 小 鼠 (Goat anti-mouse,GAM)IgG为模式蛋白,以EDC与磺酸基琥珀酰亚胺 (sulfo-NHS)为交联剂,对羧基化磁珠表面抗体的修饰条件进行了优化。此外,通过比较不同种类磁珠在修饰甲壳类主要过敏原原肌球蛋白(Tropomyosin,Tm)特异性抗体后的生物学活性,探讨了适用于免疫层析检测的羧基化磁珠的表面生物修饰方法。
1 材料与方法
1.1 材料
刀额新对虾(Metapenaeus ensis):购自上海泥城集贸市场。EDC、sulfo-NHS:上海延长生化公司产品;BSA:上海生工产品、无水吗啉乙磺酸:MES,Shanghai Mdmy Science&Technology公司产品;山羊抗鼠IgG:杭州隆基生物公司产品;其它均为国产分析纯试剂;原肌球蛋白及抗原肌球蛋白单抗为实验室自行制备纯化;Protein G亲和层析柱:GE公司产品;羧基化磁珠A、样品垫、结合垫、硝化纤维膜、吸水纸、PVC底板:美国Magna Biosciences公司产品;羧基化磁珠B:上海奥润微纳公司产品。
磁信号检测仪(Magnetic assay reader,MAR):美国Magna Biosciences公司产品;HPPS5001高性能纳米粒度分析仪:英国Malvern公司产品。
1.2 方法
1.2.1 原肌球蛋白及其特异性单克隆抗体的分离纯化虾类主要过敏原Tm的纯化参照蔡秋凤等[13]的方法并稍作修改。抗Tm的单抗[14]为实验室前期研究成果,采用Protein G亲和层析柱,按照产品所附操作说明进行纯化。
1.2.2 磁珠的表面生物修饰羧基化磁珠的表面GAM Ig G生物修饰采用EDC和NHS的化学交联方法,其反应原理如图1所示。EDC与磁珠表面的羧基反应,形成氨基反应活性的O-酰基脲中间体,抗体的伯胺可与磁珠的该中间体反应而修饰磁珠(途径1);另外该中间体在水溶液中不稳定,易于水解,可重新生成羧基磁珠(途径2),可通过加入sulfo-NHS可以将该中间体转化为氨基反应活性的NHS酯,加快与伯胺结合(途径3)。具体操作流程如下:(1)活化反应:取1 mg羧基磁珠于2 m L离心管中,用250μL 5 mmol/L MES 溶液含0.05 g/d LTween-20(简称MEST)作为活化缓冲溶液洗涤2次后,加入EDC与sulfo-NHS,其最终反应体积为250μL,混合均匀后室温旋转反应30 min。(2)偶联反应:以1 mmol/L的硼酸盐溶液含0.05 g/d L Tween-20(简称BST)作为偶联缓冲液,先用BST溶液洗涤磁珠2次,然后用适量BST溶液重悬磁珠,加入100μg GAM IgG抗体,最终反应体积为250μL,室温旋转反应4 h后回收反应上清用于蛋白定量。(3)封闭处理:偶联结束后加入250μL含有1 g/d L BSA的BST溶液(简称BST-BSA)室温反应30 min,以封闭残留的活化基团。最后用250 μL含0.02 g/d L Na3N 的 BST-BSA 重悬磁珠,4℃冷藏备用。

图1 羧基磁珠的EDC/sulfo-NHS法表面抗体修饰原理图Fig.1 Scheme of antibody modification on the surface of SMNs by EDC and sulfo-NHS method
1.2.3 磁性纳米微球表面抗体修饰的条件优化为探讨最佳的抗体修饰条件,作者分别对不同p H值 (3.0~7.0)的 MEST活化缓冲液,不同活化反应时间(10~50 min),不同交联剂EDC的质量分数(0.125~2%),不同EDC/sulfo-NHS质量比(4∶1~1∶4),不同p H 值(7.0~9.5)的BST偶联缓冲液,不同偶联反应时间(1~6 h)及不同抗体加入量(25~150μg)均做了3次平行优化实验,并通过检测抗体修饰后羧基表面的抗体量即偶联量进行修饰效果的评价,具体实验操作同1.2.2所述。
1.2.4 磁珠粒径分布检测生物修饰前后羧基磁珠的水力学粒径分布状况和描述聚合物试样相对摩尔质量多分散程度的多分散系数(Polydispersity index,PDI)采用HPPS5001型高性能纳米粒度分析仪进行检测,它基于悬浮液中颗粒的无规则运动(布朗运动)和对激光束的光散射原理,水力学尺寸是包括颗粒表面水化层在内的粒径分布,其中PDI值 越小,颗粒分散性越好。测量条件为:λ=632.8 nm,T=25℃。
1.2.5 抗体偶联量的测定羧基磁珠表面抗体修饰后的蛋白质含量以偶联反应后的回收上清液为样本,采用经典的Bradford法[15]检测蛋白质含量。抗体偶联量按下述公式进行计算:
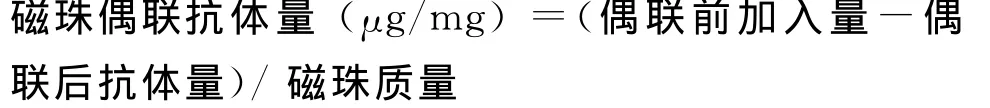
1.2.6 抗体修饰磁珠的生物学活性评价为评价磁珠表面所修饰抗体的生物学活性,利用优化后的反应条件制备过敏原Tm的特异性单抗修饰磁珠,并以此作为标记载体构建了竞争性免疫层析试纸条。实验所用的免疫层析试纸条由PVC底板、样品垫、结合垫、硝化纤维膜和吸水纸构建而成;分别以PBS溶液(A1和 B1)、含0.05 mg/m L BSA 的PBS溶液(A2和B2)、含0.05 mg/m L过敏原 Tm的PBS溶液(A3~A4、B3~B4)(图5)喷点在硝化纤维膜上作为检测线T线,2 mg/m L羊抗鼠IgG喷点在硝化纤维膜形成控制线C线对磁珠表面修饰的抗体活性进行了评价。T线和C线的喷点量均为1.0μL/cm。检测时先取5μL单抗修饰磁珠(2 mg/m L)点于试纸条的结合垫处,然后在样品垫处加入100μL PBS溶液或者含纯化后的过敏原Tm的PBS待测溶液,室温层析20 min后用MAR仪定量检测C线和T线的磁信号。
2 结果与分析
2.1 活化反应条件对抗体偶联量的影响
不同活化反应条件对羧基磁珠A和B表面抗体偶联量的影响如图2所示。由图2(a)可知,磁珠A和B表面的抗体偶联量随p H值的升高均呈现下降趋势;在相同p H值时,磁珠A的抗体偶联量高于磁珠B,说明磁珠A的抗体修饰效果好于磁珠B。随着活化反应时间的增加,磁珠A和B表面的偶联量均显示出先显著增加后逐渐下降趋势,但是在相同的活化时间,磁珠A表面抗体偶联量高于磁珠B,且两种磁珠表面的最高抗体偶联量所需要的活化反应时间也是不同的。磁珠A在活化反应20 min时其抗体偶联量最高,而磁珠B则在活化反应30 min时抗体偶联量最高(图2b)。相同偶联条件下,磁珠A表面抗体偶联量大于磁珠B,这是因为磁珠表面羧基含量与抗体偶联量直接相关。磁珠A表面羧基含量为350μmol/g大于磁珠B的200 μmol/g。由图1反应原理图可知羧基含量高使较多的活性集团能与抗体伯胺进行交联。
在低p H时交联剂EDC与羧酸形成的中间体不稳定,容易分解[16],但p H值过高时,部分不稳定中间物水解可能会释放出EDC或者使半稳定的氨基反应活性中间物的产量减少从而造成蛋白质与中间物的取代反应速度下降,使蛋白质偶联量下降[17]。因此在后续优化实验中,磁珠A的活化反应条件为:p H 5.0 MEST活化反应20 min;磁珠B的活化反应条件为:p H 5.0 MEST活化反应30 min。
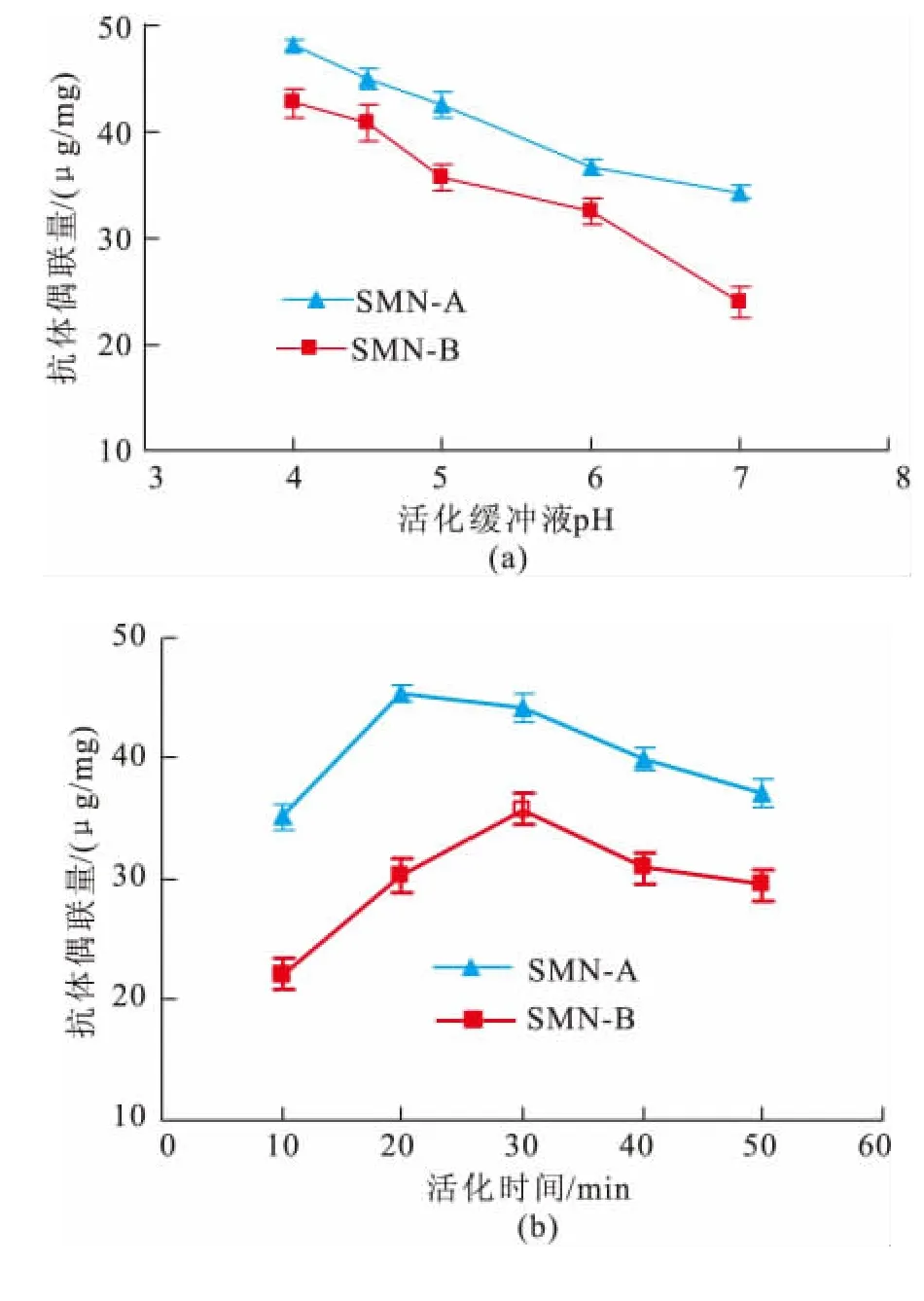
图2 活化缓冲液pH(a)和活化时间(b)对抗体偶联量的影响Fig.2 Effect of activation solution pH (a),activation time(b)on antibody coupling amount
2.2 交联剂对抗体偶联量的影响
交联剂对磁珠表面抗体偶联量的影响实验结果如图3所示。由图3(a)可知,不论是磁珠A还是磁珠B,当交联剂EDC质量浓度小于0.5 g/d L时,抗体偶联量呈现上升趋势,在0.5 g/d L时达到最高值,其后随着EDC质量浓度的增加抗体偶联量呈现下降趋势。对于相同质量浓度的EDC,磁珠A的抗体偶联量高于磁珠B。对于EDC和NHS的不同质量比,磁珠A和B均呈现出随着质量比的增加其抗体偶联量也增加,并在1∶1后呈现饱和趋势(图3b)。根据上述结果,在后续优化实验中EDC浓度选择为0.5 g/d L,交联剂 EDC和sulfo-NHS质量比则为1∶1。

图3 EDC质量浓度(a)和EDC/sulfo-NHS质量比(b)对抗体偶联量的影响Fig.3 Effect of EDC concentration(a),EDC and sulfo-NHS mass ratio(b)on antibody coupling amount
2.3 偶联反应条件对抗体偶联量的影响
偶联反应条件对磁珠表面抗体偶联量的影响结果如图4所示。由图可见,磁珠A和B的表面抗体偶联量均随着偶联缓冲液p H值的增加而增加,达到最大值后又降低,磁珠A和磁珠B分别在p H8.5和p H9.0时达最大抗体偶联量。另外,磁珠A和磁珠B随着抗体加入量和偶联反应时间的增加而增加,并逐渐趋向饱和。磁珠A在抗体加入125μg、偶联反应4 h时其抗体偶联量最高,而磁珠B则在100μg抗体、偶联反应5h时出现最高偶联量。在任一偶联反应点,磁珠A的抗体偶联量均高于磁珠B。根据上述结果,后续的优化实验中磁珠A和B的偶联缓冲液p H值分别选择8.5和9.0,磁珠A的最适偶联反应时间选择了4 h,而磁珠B则为5 h。考虑到单抗较难制备且价格较贵,因此作者认为抗体加入量在75~100μg范围内进行选择较为经济,磁珠A和磁珠B在这个范围的表面抗体密度为(33.05±1.11)~(44.36±1.35)μg。
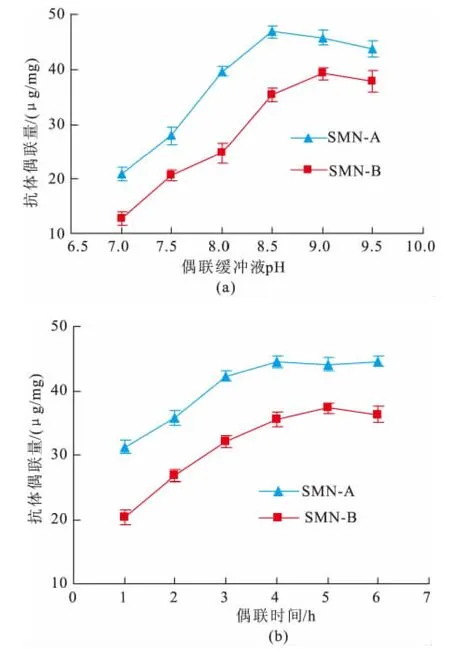
图4 偶联缓冲液p H(a),偶联时间(b)对抗体偶联量的影响Fig.4 Effect of coupling buffer pH (a),coupling time(b)on antibody coupling amount
2.4 抗体修饰磁珠的粒径分布检测
磁珠经抗体修饰后的粒径变化用纳米粒度分析仪进行检测,其结果如表1所示。由表可知,磁珠A在抗体修饰前后的平均水力学粒径分别为248.6和264.9 nm,其粒径变化率为6.55%,PDI分别为0.011和0.046,变化微小,说明磁珠的单分散性能较好;磁珠B在抗体修饰前后的平均水力学粒径分别为104.9和247.1 nm,其粒径变化率为135.55%,PDI由0.170变为0.451,说明磁珠B表面修饰抗体后,其单分散性能变差了。IgG型抗体在溶液中的最大长度为24 nm[18],封闭液中的BSA尺寸较小,为9.5 nm[19],以物理吸附方式结合在磁珠表面;因此抗体的修饰对磁珠的粒径变化会有些许作用,但是磁珠B在修饰抗体后其粒径出现了显著性增加,其原因很可能是生物分子的修饰过程使磁珠粒子间的团聚从而造成其水力学尺寸的变化,XU等[20]报道了磁珠洗涤重悬的过程可能使其粒径和多分散系数变大。
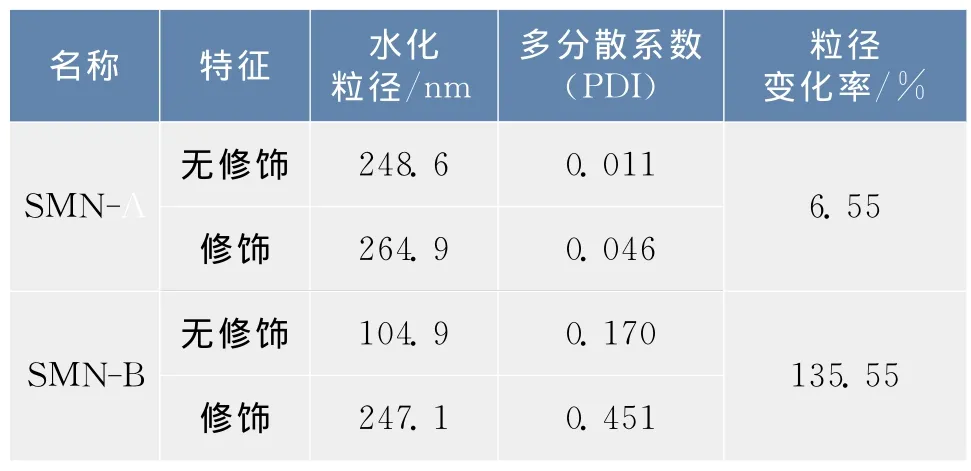
表1 修饰抗体前后磁珠的特征Tab.1 Characteristics of SMN-A and B before and after antibody modification
2.5 抗体修饰磁珠的生物学活性评价
Tm特异性单抗修饰磁珠的生物性活性评价结果见图5(定性)和表2(定量)。由图5可见,A1~A2和B1~B2试纸条在检测线(T线)处无条带,其T线的磁信号也非常弱(表2),与定性结果相一致,说明抗体修饰磁珠在T线未被捕获;A3和B3试纸条在T线处有明显的条带,而A4和B4试纸条则显示出微弱条带,由表2可知A3和B3在T线处的磁信号为3 381.2和8 039.5 MAR,A4和B4分别为217.8和431.8 MAR,定量检测结果与肉眼观察的定性结果相吻合。
作者对单抗修饰磁珠的生物学评价采用的是竞争性抗原抗体反应原理,即T线上不喷点抗原时,试纸条上的抗体修饰磁珠因为没有抗原抗体的结合反应而不能停留在T线上,若T线上喷点有抗原时,T线处就会有抗体修饰磁珠因特异性反应而被捕获从而停留在此处,此时T线就会显示出磁珠所带的颜色,停留量与颜色强弱成正比。A1和B1检测线处喷点的是PBS溶液,T线无条带而C线有条带说明试纸条体系是有效的;A2和B2检测T线处喷点有含0.05 mg/m L BSA的PBS溶液,检测后T线未出现条带说明抗体修饰磁珠A和B均无假阳性反应。A3~A4、B3~B4试纸条在T线喷点的是过敏原Tm溶液,因A3和B3样本是PBS溶液无竞争性反应,而A4和B4样本中含有过敏原Tm,有竞争性反应因而T线条带的颜色弱于A3和B3,上述样本的定量检测结果与肉眼观察结果相一致,说明优化后的修饰方法制备所得抗体修饰磁珠A和B均具有较好的抗原结合活性,可应用于后续的免疫学检测中。
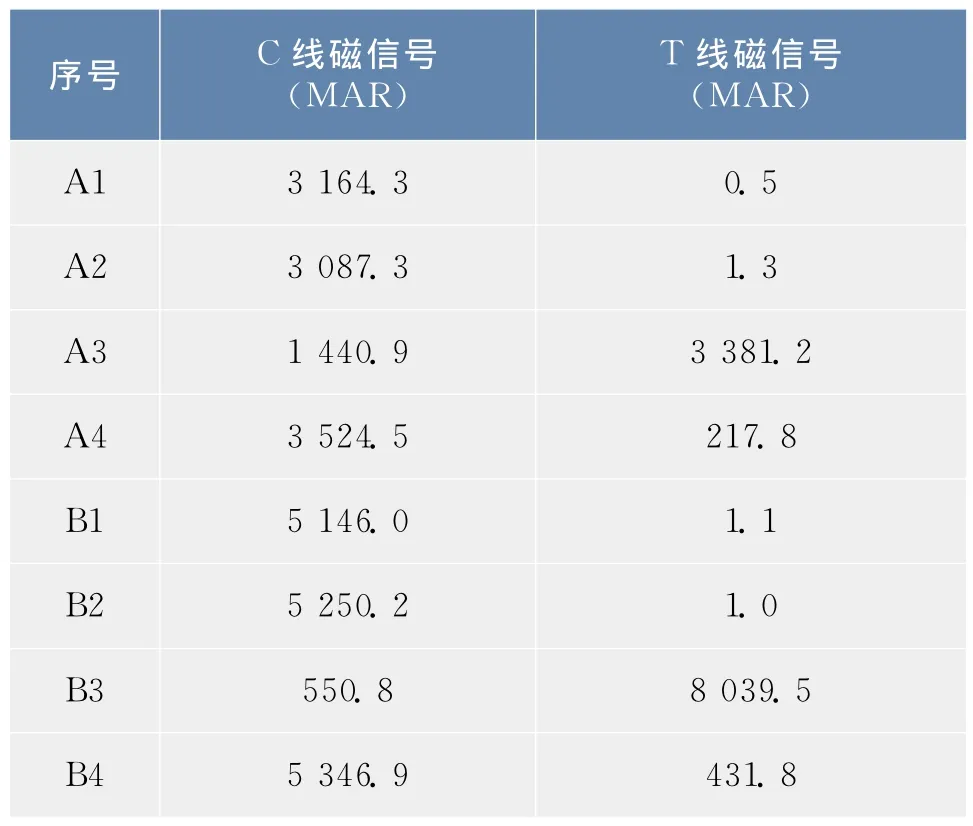
表2 抗体修饰磁珠A和B的磁信号比较Tab.2 Comparison of magnetic signal between antibody modifying SMN-A and B
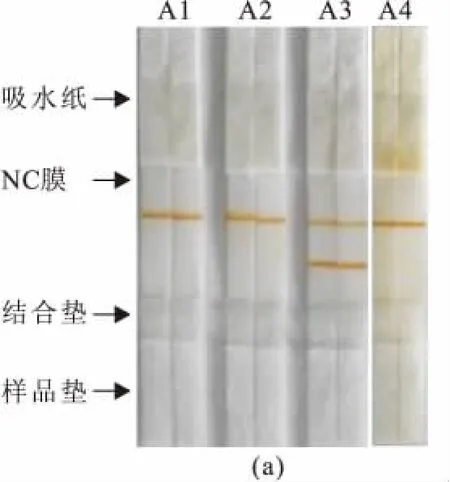

图5 抗体修饰磁珠A(a)和B(b)免疫层析效果比较Fig.5 Comparison of LFIA between antibody modifying SMN-A(a)and B(b)
3 结语
作者以GAM IgG为模式蛋白对羧基化磁珠的表面生物修饰方法进行了研究,修饰反应的优化实验结果显示不同来源的磁珠,其表面的最佳抗体偶联条件是不同的;此外,发现在相同的条件下,磁珠A表面抗体偶联量均大于B。分析其原因,除于磁珠表面的羧基含量直接相关外,还可能与磁珠的单分散性能相关,磁珠的团聚会使其表面暴露的活性集团减少从而造成生物分子偶联量的降低。免疫层析检测结果表明这两种磁珠在生物修饰后其表面的抗体均具有较好的抗原结合活性。但是B3的T线磁信号(8 039.5 MAR)大大高于 A3(3 381.2 MAR),而C线磁性号大大低于磁珠A3。其原因很可能是因为磁珠B经抗体修饰后其多分散性能下降,磁珠间发生了一定的团聚,从而对层析造成了物理屏障而使磁珠被截留引起的。虽然磁珠B的分散性较磁珠A差,但是其磁响应性强(B3和A3),这有助于提高定量检测灵敏度。但是在实际应用时往往以C线的强弱来判断试纸条的有效性,因此C线信号过弱易造成结果误判。
综上所述,对于不同厂家的同类型磁珠,即便是修饰同一生物分子,其生物分子所需的最佳修饰条件是不同的,会受到粒径、官能基团含量等因素的影响。因此在应用此类磁珠进行免疫层析检测时,尚需要考虑材料的磁性成分含量、多分散性能等因素,研究结果显示抗体修饰前后磁珠粒径和分散性能的变化、材料的磁相应性能对于检测灵敏度和层析速度具有重要意义。
(References):
[1]Jain T K,Morales M A,Sahoo S K,Leslie-Pelecky D J,Labhasetwar V.Iron oxide nanoparticles for sustained delivery of anticancer agents[J].Molecular Pharmacology,2005,2(3):194-205.
[2]王燕佳,蒋惠亮,方银军,等.新型磁性纳米颗粒固定脂肪酶的研究[J].食品与生物技术学报,2008,27(6):98-102.
WANG Yan-jia,JIANG Hui-liang,FANG Yin-jun,et al.Study on the immobilization of lipase with novel magnetic nanoparticles[J].Journal of Food Science and Biotechnology,2008,27(6):98-102.(in Chinese)
[3]Tae H K,Jai K K,Wooyoung S,et al.Tracking of transplanted mesenchymal stem cells labeled with fluorescent magnetic nanoparticle in liver cirrhosis rat model with 3-T MRI[J].Magnetic Resonance Imaging,2010,28(7):1004-1013.
[4]Saiyed Z M,Telang S D,Ramchand C N.Application of magnetic techniques in the field of drug discovery and biomedicine[J].Biomagnetic Research and Technology,2003,(1):2.
[5]Tapasree R S,Joseph I.Carboxyl-coated magnetic nanoparticles for mRNA isolation and extraction of supercoiled plasmid DNA[J].Analytical Biochemistry,2008,379(1):130-132.
[6]Deniz A U,A.Alev K,Sinan A,et al.Magnetic hydrophobic affinity nanobeads for lysozyme separation[J].Materials Science and Engineering C,2009,29(7):2165-2173.
[7]Xu Q F,Xu H,Gu H C,et al.Development of lateral flow immunoassay system based on super paramagnetic nanobeads as labels for rapid quantitative detection of cardiac troponin I[J].Materials Science and Engineering C,2009,29(3):702-707.
[8]Wang Y Y,Xu H,Wei M,et al.Study of super paramagnetic nanoparticles as labels in the quantitative lateral flow immunoassay[J].Materials Science and Engineering C,2009,29(3):714-718.
[9]Shon W,Susan K W,Chou P P,et al.Rapid detection of HIV-1 p24 antigen using magnetic immuno-chromatography(MICT)[J].Joural of Virological Methods,2009,160(1-2):14-21.
[10]王迎军,杨春蓉,汪凌云.EDC/NHS交联对胶原物理化学性能的影响[J].华南理工大学学报,2007,35(12):66-70.
WANG Ying-Jun,YANG Chun-Rong,WANG Ling-Yun.Influence of EDC/NHS crosslinking on physicochemical properties of collagen[J].Journal of South China University of Technology(Natural Science Edition),2007,35(12):66-70.(in Chinese)
[11]Stéphanie G,James A F,Andrew J V,et al.Coupling of diethylenetriamine to carboxyl terminated magnetic particles[J].Colloids surfaces A,2000,164(2-3):257-266.
[12]Yu S,Chow G M.Carboxyl group(-CO2H)functionalized ferrimagnetic iron oxide nanoparticles for potential bio-applications[J].Journal of Materials Chemistry,2004,14(18):2781-2786.
[13]Lu Y,Toshiaki O,Hideki U,Yuki H,Kazuo S.Immunological characteristics of monoclonal antibodies against shellfish major allergen tropomyosin[J].Food Chemistry,2007,100(3):1093-1099.
[14]蔡秋凤,王锡昌,刘光明,等.口虾蛄主要过敏原原肌球蛋白的免疫活性[J].水产学报,2010,34(3),415-420.
CAI Qiu-feng,WANG Xi-chang,LIU Guang-ming,et al.Studies on the immunoreactivity of themajor allergen tropomyosin in mantis shrimp(Squilla oratoria)[J].Journal of Fisheries of China,2010,34(3),415-420.(in Chinese)
[15]Bradford M M.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2),248-254.
[16]Greg T H.Bioconjugate Techniques[M].2nd ed.,London:Academic Press,2008,216-232.
[17]Nakajima N,Ikada Y.Mechanism of amid formation by carbodiimides for bioconjugation in aqueous media[J].Bioconjugate Chemistry,1995,6(1):123-130.
[18]Ingrid P,Otto K,Fred K.Changes of the conformation of rabbit IgG antibody caused by the specific binding of a hapten X-ray small-angle studies[J].Journal of Biochemistry,1974,41(1):91-96.
[19]Sun C X,Yang J H,Wu X,Huang X,Wang F,Liu S.Unfolding and Refolding of Bovine Serum Albumin Induced by Cetylpyridinium Bromide[J].Biophysical Journal,2005,88(5):3518-3524.
[20]XU Y W,XU H,GU H C.Controllable preparation of epoxy-functionalized magnetic polymer latexes with different morphologies by modified miniemulsion polymerization[J].Journal of Polymer Science:Part A:Polymer Chemistry,2010,48(11),2284-2293.
Surface Biological Modification Research on Carboxylated Magnetic Nanoparticles
SHILiang,WANGXi-chang,LIUYuan,LUYing*
(College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
Using goat anti-mouse IgG monoclonal antibody as model protein,antibody modification conditions on the surface of carboxylated superparamagnetic nanoparticles(SMN)A and B were optimized,then hydrodynamic sizes and polydispersity index(PDI)of SMN-A and B before and after antibody modification were compared.Additionally,the biological activity of modifying antibodies was assessed by a competitive format lateral flow immunoassay(LFIA).Optimization results indicated that the best modification conditions were different for SMNs of different sizes and manufactures.Before and after modification,the hydrodynamic size change rate of SMN-A was 6.55%,PDI were 0.011 and 0.046,respectively,the change was minor,while hydrodynamic size change rate of SMN-B was 135.5%,and the dispersivity became worse.Furthermore,the antibody modifying on SMN-A and B both showed good biological activities by LFIA test,and SMN-A indicated better lateral flow performance.Briefly,if antibody modifying SMNs were chosen as labels in LFIA test,size and dispersivity change before and after modification,magnetic signal intensity of the material had great mean in improving detection sensitivity and assay rate.
magnetic nanoparticles,biological modification,EDC,lateral flow immunoassay
Q 819
A
1673-1689(2012)01-071-07
2011-03-31
“十一五”国家科技支撑计划项目(2008BAD94B09);上海市教育委员会优秀青年教师基金项目(B-8101-09-0036);上海市科技兴农重点攻关项目(沪农科攻字(2009)第6-1号);上海市教育委员会重点学科建设项目(J50704)。
*
卢瑛(1971-),女,上海人,副教授,主要从事纳米生物学与食品安全风险评估研究。Email:y-lu@shou.edu.cn.

