SOCS1调控未成熟树突细胞分化诱导肝移植免疫耐受及机制研究
于晓春 罗时敏 黄昭 杨智 程园园 刘继云
SOCS1调控未成熟树突细胞分化诱导肝移植免疫耐受及机制研究
于晓春 罗时敏 黄昭 杨智 程园园 刘继云
目的 探讨细胞因子信号传导抑制因子-1(Suppressors of cytokine signaling-1,SOCS1)基因腺病毒转染未成熟的树突细胞(Dendritic cells,DC),并免疫受体小鼠,通过小鼠肝移植模型,观察免疫耐受的效果并探讨可能的机制。方法 构建SOCS1腺病毒并PCR鉴定,感染体外分离、培养的小鼠骨髓树突细胞,Westernblot法检测SOCS1表达。以未转染组及空白转染组为对照,免疫肝移植小鼠模型,检测受体小鼠脾脏淋巴细胞混合淋巴细胞反应(MLR),检测血清IL-2和IFN-γ水平及肝脏组织IL-2和IFN-γmRNA表达。结果 成功构建并鉴定转染腺病毒,感染DC后,SOCS1蛋白表达水平较未转染组及空白转染组显著增高(P<0.05)。SOCS1基因修饰的DC免疫肝移植模型小鼠后,受体小鼠脾脏淋巴细胞MLR较未转染组及空白对照免疫受体组小鼠显著下降(P<0.05);SOCS1-DC免疫受体小鼠血清IL-2和IFN-γ水平及肝脏mRNA表达水平均显著下降(P<0.05)。结论 通过腺病毒转染使SOCS1在DC中过度表达,用以体内免疫同种异体肝移植受体小鼠,能有效减轻同种移植排斥反应,并在一定程度上诱导形成免疫耐受。
细胞因子信号传导抑制因子-1;树突状细胞;肝移植;移植物排斥
器官移植术后排斥反应是影响移植物功能及收者生存质量的重要因素之一[1]。近年来,多种新型免疫抑制剂的临床应用,虽然降低了器官移植排斥反应的发生率,但过度抑制了机体免疫[2]。因此,有效的抑制同种移植排斥反应,并保持机体正常的免疫力是解决移植排斥的有效办法。近年研究发现,髓系未成熟树突状细胞亚群(immature DC subset,imDC)由于表面粘附辅助分子如B7、CD40等缺乏,则具有免疫耐受性,可以诱导T细胞失能、低反应型以及Th2细胞极化,并且诱导调节性T细胞产生,对于器官移植的免疫稳态的维持具有重要的作用[3]。细胞因子信号传导抑制因子(Suppressor of cytokine signaling-1,SOCS1)是近年来发现的一类与细胞因子JAK-STAT信号传导途径有关的负性调节蛋白,能够抑制白介素、IFN等多种因子的细胞内信号传导[4-5]。本实验采用基因转染技术上调DC内的SOCS1的表达,并免疫受体小鼠,通过小鼠肝移植模型,观察免疫耐受的效果并探讨可能的机制。
1 材料与方法
1.1 实验动物与细胞系 供体C57BL/6小鼠、受体BALB/C小鼠,6~8周,体重20~22g(上海必凯实验动物有限公司),293细胞株购(上海中科院细胞研究所)。
1.2 主要试剂 RPMJ-1640和胎牛血清(Gbico公司,美国),LPS(Sigma-Aldrich公司,美国),引物(上海生工生物技术公司);RNA逆转录试剂盒(TOYOBO公司,日本);SOCS1、β-actin蛋白印迹试剂盒(Cell Signal公司,美国),小鼠白细胞介素-10(IL-10)、白细胞介素12(IL-12)、ELISA检测试剂盒(Biotec公司,美国)。
1.3 腺病毒载体 编码SOCS1基因的复制缺欠病毒载体(Ad-SOCS1)及空白对照腺病毒Ad-GFP病毒(北京本元正阳基因技术有限公司)。
1.4 重组腺病毒的扩增、纯化和滴度测定 用已获得的重组病毒大量感染293细胞,当293细胞出现细胞病变效应开始脱落时,收获病变细胞及培养液,3000r/m、5min离心两次弃上清,并在-70℃和37℃反复冻融3次,每次30min,4℃ 3000r/m离心5min,收集上清。按试剂盒说明纯化病毒。OD260法测定病毒颗粒滴度(VP/mL),TCID50法测定病毒感染滴度(IU/mL)。
1.5 重组腺病毒感染小鼠DC 颈椎脱臼法处死C57BL/6小鼠,无菌切取胫骨、股骨,PBS冲出骨髓细胞,Tris-NH4Cl低渗裂解红细胞后,用含10% FBs的RPMI-1640培养液重悬细胞,调细胞浓度为1×106/mL,加入rmGM-CSF(10ng/mL),接种于24孔培养板,去除悬浮的粒细胞,第5d收集半贴壁细胞(DC)用复合感染指数(MOI)为1:100的重组病毒Ad-SOCS1及Ad-GFP感染DC,未经病毒转染的骨髓DC作为对照。感染后18h,吸尽含病毒的培养液,更换含rmGM-CSF的完全培养基继续培养,6h后收获细胞。以上三组细胞分别称为DC-SOCS1、DC-GFP及imDC,用于后续试验。
1.6 Western Blotting检测Ad-SOCS1对DC的转染效果 各组细胞1×107/mL,收集细胞蛋白,并测定样品蛋白含量。等量蛋白样品经10%的SDS-PAGE分离后,电转移至硝酸纤维素膜上,5%脱脂奶粉封闭4℃过夜,加一抗室温摇晃2h,加辣根过氧化物酶标记的二抗(1:5000,Sigma)室温摇晃1h,以上各步骤间用TBS (tween-tris-bufered saline solution)洗10min×3次。暗室内增强的化学发光反应显色,X线底片曝光、显影、定影,底片用凝胶图像分析仪CheniImager5500 V2.03软件扫描,用Fluor Chen2.0软件进行定量分析得到光密度值(Optical density,OD)。
1.7 小鼠分组及处理 (1)受体小鼠分成4组,每组8只。移植前7d,3组小鼠分别经静脉注入2×106个供体来源imDC、DCGFP及DC-SOCS1,等量PBS注入的受体小鼠作为空白对照。4组小鼠接受原位肝移植;(2)原位肝移植:采用双袖套法,供体异氟醚麻醉,上腹部全横切口进腹,切除胆囊,完全游离门静脉至肠系膜上静脉水平,停止异氟醚麻醉,IVC注入生理盐水,断肝动脉,取出游离肝脏,放入4℃ UW培养液中。受体手术切除肝脏采用类似方法,植入供肝,各血管袖套吻合,胆管内置供体胆管支撑管。第14d处死动物并检测免疫学指标。
1.8 血清IL-2和IFN-γ的检测 肝移植术前及术后第14d,取受体外周血,应用ELISA法检测IL-2和IFN-γ的水平。
1.9 受者脾脏细胞同种混合淋巴细胞反应(MLR)检测移植14d收获脾脏,制备淋巴细胞悬液,2.5:1、5:1、10:1、20:1的比例与γ射线面或C57BL/6脾淋巴细胞混合,培养3d。液闪计数仪检测[3H]-TdR。
1.10 移植肝脏内IL-2和IFN-γmRNA表达的测定 提取肝组织的mRNA,按试剂盒说明书进行逆转录聚合酶链反应(RT-PCR),用凝胶成像系统照相,以Bio-Image Analysis System进行半定量分析,计算目的条带吸光度(A)值与内参区带A值的比值,作为目的mRNA的相对含量。
1.11 统计学方法 所有数据采用SPSS13.0统计学软件进行处理,实验数据用均数±标准差(±s)表示。多组间比较采用χ2分析,以P<0.05为差异有统计学意义。
2 结果
2.1 重组腺病毒的滴度 病毒颗粒滴度为1.7×1011VP/mL,病毒感染滴度为1.9×109IU/mL。
2.2 SOCS1基因转染DC细胞后SOCS1蛋白的表达 Ad-SOCS1转染后的DC细胞较Ad-GFP转染组及未转染组的SOCS1蛋白表达显著增高,从而表明Ad-SOCS1转染有效,明显上调了转染树突细胞内SOCS1基因的表达,如图1。
2.3 各受者小鼠脾脏MLR采用MLR方法检测各组小鼠免疫系统的影响 imDC和DC-GFP组小鼠的脾脏淋巴细胞对供者抗原刺激反应无明显区别,与空白组比较有一定程度下降,但这种差异无统计学意义(P=0.051),而DC-SOCS1组与imDC和DCGFP组小鼠比较,脾脏淋巴细胞对供者抗原刺激反应则进一步降低(P<0.05),与空白组比较更有显著下降(P<0.01),如图2。
2.4 肝移植术前及术后血清IL-2和IFN-γ水平 肝移植术后各组血清IL-2和IFN-γ水平均无明显差异(P>0.05),而移植术后各组小鼠血清IL-2和IFN-γ水平均较术前显著增高(P<0.05);但SOCS1-DC组小鼠两种细胞因子与空白组及其他对照组比较显著下降,差异有统计学意义(P<0.05),如图3。
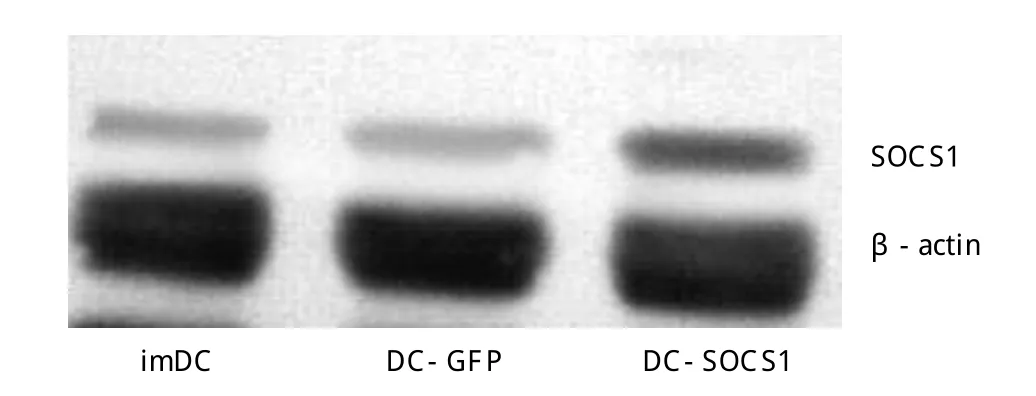
图1 各组细胞内SOCS1的表达。
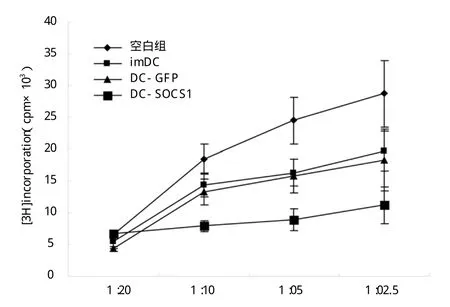
图2 各组受体小鼠脾脏淋巴细胞混合反应。
2.5 肝脏内IL-2和IFN-γmRNA表达 肝移植术后imDC和DC-GFP组受体小鼠肝脏组织IL-2和IFN-γmRNA表达水平与空白组比较,差异无统计学意义(P>0.05);而DCSOCS1组两种细胞因子的mRNA表达则显著下降(P<0.05),如图4。
3 讨论
树突状细胞(dendritic cell,DC)是惟一能够激活初始T细胞反应的抗原递呈细胞,是决定T细胞反应状态的重要因素[7]。研究表明,DC是一类异质性细胞群体,成熟DC因其表面高表达CD40、CD80等共刺激分子,因而能激活T细胞,诱导免疫应答,表现出免疫原性;而未成熟DC表面不表达或者低表达共刺激分子,提呈抗原时因缺乏共刺激信号而诱导T细胞无能或凋亡,因而倾向诱导免疫耐受,表现出耐受原性[8]。近年来,较多研究尝试多种方法抑制DC成熟,并利用这种不成熟DC回输体内诱导耐受,从而延缓或组织移植排斥反应,这也是器官抑制领域研究的热点之一[9]。SOCS1作为JAK-STAT信号途径的负性调节因子,其对DC的成熟以及功能的调控以及引起研究者的广泛注意。有研究发现,通过RNA感染技术沉默DC内的SOCS1基因,可以增强DC的抗原呈递功能,并增强肿瘤抗原特异性的抗肿瘤免疫反应[10]。本研究采用转基因技术上调DC中的SOCS1基因表达,以期能有效抑制DC的成熟而增强免疫耐受原性。
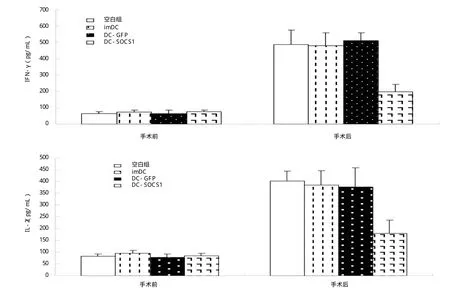
图3 各组小鼠在手术前后血清IL-2和IFN-γ水平。
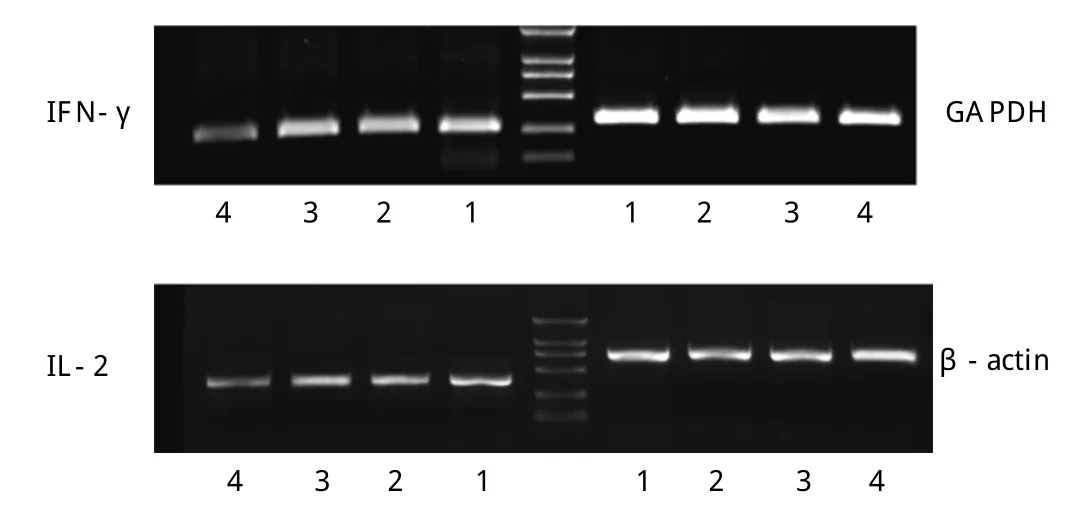
图4 各组小鼠在手术前后肝脏组织IL-2和IFN-γmRNA表达。
笔者通过骨髓细胞体外条件培养法,分离获得了较高纯度的未成熟DC,并利用SOCS1基因的腺病毒转染DC后,通过蛋白鉴定发现转染后的DC显著高表达SOCS1蛋白,因此提示通过腺病毒转染SOCS1基因在DC中高表达的方法是可行的。通过进一步将SOCS1基因高表达的DC细胞注入接受同种肝移植受体小鼠体内,并分析其免疫功能,结果发现DC-SOCS1免疫受者后,脾脏淋巴细胞对同种抗原的MLR活性显著降低,提示受者淋巴细胞对同种抗原的反应活性明显下降,从而为介导移植排斥反应的免疫耐受、延长移植物存活期提供了基础[11]。
大量实验表明,在排斥反应发生过程中常伴有Th1型细胞因子(如IFN-γ、IL-2)的表达增高和Th2型细胞因子(如IL-4、IL-10)的不表达或低表达,而在免疫耐受时,则呈相反的情况。IFN-γ不仅可以促进Th型细胞分化为Th1型,同时通过诱导促炎症因子分泌,激活炎症细胞释放各种效应因子从而促进排斥反应,而IL-2作为重要的促炎症因子,也在排斥反应中起到了重要的作用。本研究显示,同种异体肝移植术后,受体小鼠血清中IFN-γ及IL-2含量及在肝脏组织mRNA表达均较术前显著增高;而SOCS1-DC免疫的受体小鼠,较对照组及空白组血清中IFN-γ及IL-2含量及在肝脏组织mRNA表达均有显著的下降,因此提示SOCS1基因修饰的DC免疫治疗在一定程度上成功诱导了免疫耐受,从而有望进一步提高移植物存活率,这与以往体外研究中的结果也是相一致的[12]。
综上所述,笔者的研究结果表明,SOCS1基因修饰的DC,用以体内免疫同种异体肝移植受体小鼠,能有效减轻同种移植排斥反应,并在一定程度上诱导形成免疫耐受。因此,进一步基于SOCS1基因修饰的DC免疫治疗策略对于诱导抑制免疫耐受具有重要的意义,也具有潜在临床应用价值。
[1] Shen L,Evel-Kabler K,Strube R,et al.Silencing of SOCS1 enhancesantigen presentation by dendritic cells and antigen-specific anti-tumor immunity[J].Nat Biotechnol,2004,22(12):1546-1553.
[2] 陈晓波,秦杰,焦洋,等.小鼠SOCS1基因重组腺病毒载体的构建及其在树突状细胞中的表达[J].现代医学生物进展,2007,7(10):1445-1448.
[3] Aldrich M,Sanders D,Lapteva N,et al.SOCS1 downregulation in dendritic cells promotes memory T-cell responses[J].Vaccine,2008,26(8):1128-1135.
[4] Chinen T,Komai K,Muto G,et al.Prostaglandin E2 and SOCS1 have a role in intestinal immune tolerance[J].Nat Commun,2011,2(190):1-11.
[5] Hashimoto M,Ayada T,Kinjyo I,et al.Silencing of SOCS1 in macrophages suppresses tumor development by enhancing antitumor inflammation[J].Cancer Sci,2009,100(4):730-736.
[8] 许英艺,陈玉强.细胞因子信号抑制因子1在树突状细胞肿瘤疫苗中的作用[J].国际肿瘤杂志,2011,38(10):729-733.
[7] Evel-Kabler K,Song XT,Aldrich M,et al.SOCS1 restricts dendritic cells ability to break self tolerance and induce antitumor immunity by regulating IL-12 production and signaling[J].J Clin Invest,2006,116(1):90-100.
[8] 王琪,林苹,张沽,等.SOCS1对LIGHT诱导的骨髓来源DC分化成熟的影响[J].现代免疫学,2005,25(6),456-459.
[9] Hanada T,Yoshida H,Kato S,et a1.Suppressor of cytokine signaling-1 is essential for suppressing dendritic cell activation and systemic autoimmunity[J].Immunity,2003,19(3):437-450.
[10] Hashimoto M,Ayada T,Kinjyo I,et al.Silencing of SOCS1 in macrophages suppresses tumor development by enhancing antitumor inflammation[J].Cancer Sci,2009,100(4):730-736.
[11] 王琪,林苹,张洁,等.SOCSl对LIGHT诱导的骨髓来源DC分化成熟的影响[J].现代免疫学,2005,25(6):456-459.
[12] Takagi H,Sanada T,Minoda Y,et al.Regulation Of cytokineand toll-like receptor signaling by SoCS family genes[J].Nippon Rinsho,2004,162(12):12189-2196.
Objective To study the effect on immune tolerance in heterotopic liver transplantation mode mice of Cytokine Signaling-1 (SOCS1)gene modifi ed dendritic cells (DC). Methods The adenovirus vectors containing suppressors of cytokine signaling-1 (SOCS1) was constructed.BALB/c mice was immunized with imDC, DC-GFP and DC-SOCS1, the serum level and the mRNA expression in liver of IL-2 and IFN-γ was detected. And mixture lymphocyte reaction (MLR) in spleen lymphocytes was observed in BALB/c mice. Results The adenovirus vectors containing SOCS1 was successfully constructed and tranfected. BALB/c mice immunized by DC-SOCS1 exhibited low reactive in spleen lymphocyte MLR (P<0.05). Serm IL-2 and IFN-γ levels determined by ELISA in the DC-SOCS1 group increased signifi cantly after liver allograft transplantation,but was lower compared to control group and imDC,DC-GFP group (P<0.05). The semiquantitative reversed transcriptase polymerase chain reaction assay showed that expression levels of IL-2 and IFN-γ in DC-SOCS1 mice also decreased markedly compared with other groups (P<0.05). Conclusion Replication defective adenovirus vector SOCS1 can effectively transfect DC, and increase the expression of SOCS1 gene. Immunization with SOCS1 gene modifi ed immature DC in vivo can induce antigen-specifi c immune tolerance in organ transplantation.
Suppressors of cytokine signaling-1 (SOCS1); Dendritic cells; Transplantation; Graft rejection
10.3969/j.issn.1009-4393.2012.25.001
广东省科技计划基金资助项目 (2010B031600014)
510180 广州市第一人民医院危重症监护中心 (于晓春 罗时敏 黄昭 杨智 程园园 刘继云)

