针对Oct-4和Survivin基因的双靶向shRNA腺病毒载体的构建及其对肝癌细胞的抑制作用
王端明,王敬晗,李林芳,陈静波,苏长青
1 石河子大学医学院 新疆地方与民族高发病实验室,新疆 石河子 832000
2 第二军医大学东方肝胆外科医院 分子肿瘤研究室,上海 200438
3 新疆畜牧科学院,新疆 乌鲁木齐 830000
原发性肝癌是最常见的致死性恶性肿瘤,预后差,多数患者在首次手术后一年内复发或转移,一年生存率极低[1]。而我国又是乙型肝炎感染人群最多的国家,肝癌的发病率明显较其他国家偏高[2-3]。因此,深入了解肝癌发病的分子机制并积极探索新的治疗手段是提高肝癌整体治疗效果的关键。肿瘤细胞具有较强的凋亡抗性,并在一定程度上具有干细胞特性,是肿瘤复发、转移的重要原因之一。Survivin是近年来克隆出的凋亡抑制蛋白家族 (IAPs) 新成员之一,也是迄今为止发现的抑制凋亡作用最强的凋亡抑制因子[4]。正常情况下仅表达于胚胎组织,在胚胎发育和细胞分化中起着调控细胞有丝分裂、抑制细胞凋亡的重要作用[5]。目前研究发现 Survivin在绝大多数肿瘤组织中高表达,提示Survivin与肿瘤的发生发展存在极为密切的关系[6-7]。Survivin抑制肿瘤细胞凋亡的分子机制还有许多尚待解决的疑难问题[8-9]。其中,Survivin与其他调控因子的相互作用尤为值得注意。Oct-4属于POU转录因子家族,是一类DNA结合蛋白,能够激活在启动子或增强子区域内带有顺式作用元件的基因转录,对维持和调节干细胞状态起着关键作用。已有研究表明,很多类型的肿瘤细胞也有高水平的Oct-4表达,可能是参与了肿瘤细胞的自我更新[10]。鉴于此,本研究将应用分子克隆和同源重组技术构建特异性针对 Oct-4和Survivin基因的双靶向shRNA腺病毒载体,并观察其对肿瘤细胞增殖的抑制作用,通过裸鼠荷瘤实验检验其抗肿瘤能力,旨在优化肿瘤基因治疗的方法,寻求更为有效的治疗策略。
1 材料与方法
1.1 材料
1.1.1 主要试剂
胎牛血清购自PAA公司,DMEM粉剂购自Gibco公司,各种限制性内切酶均购自 NEB公司,质粒提取试剂盒、病毒基因组提取试剂盒QIAGEN DNA Blood Mini Kit购自QIAGEN公司,胶回收试剂盒购自MN公司,鼠抗人Oct-4单抗购自美国Santa Cruz公司,兔抗人Survivin多抗购自美国R&D生物公司,山羊抗鼠IgG、山羊抗兔IgG、双染SP试剂盒购自福州迈心生物技术公司,细胞裂解蛋白提取试剂盒、BCA蛋白浓度测定试剂盒购自 Pierce公司,预染蛋白 Marker购自 Fermentas公司,转染试剂LipoFectamine2000试剂盒购自Invitrogen公司,其余试剂均为国产或进口分析纯。
1.1.2 菌株、质粒和细胞株
大肠杆菌菌株 DH5α、重组腺病毒质粒pAd-EGFP、肝癌细胞系EHBH-H1由第二军医大学东方肝胆外科医院实验室保存,腺病毒包装用HEK293细胞株购自美国ATCC。
1.1.3 实验动物
清洁级BALB/c裸鼠30只,4周龄,体重16~18 g,由中国科学院上海实验动物中心提供,合格证号SCXK (沪) 2009-0003。
1.2 方法
1.2.1 细胞培养
人肝癌细胞系EHBH-H1用含10%胎牛血清、100 IU/L青霉素和100 mg/L链霉素的DMEM培养液,置于37 ℃饱和湿度及5% CO2的培养箱内培养,待生长细胞达到80%以上的汇合度时进行传代培养。
1.2.2 Oct-4和Survivin基因shRNA的设计与合成
根据 GenBank 的 Survivin 基因序列(Accession No. NM001168) 和 Oct-4基因序列(Accession No. DQ486513.1) 设计相应的shRNA。设计条件为:1) 排除含有连续4个G/C或A/T的序列;2) 排除两端存在AA的序列;3) 排除定位在碱基易突变点的序列;4) 排除其他人类基因的同源性序列。Surv-shRNA序列为 5′-gaa agt gcg ccg tgc cat c-3′,位于全长Survivin编码序列的第387~405 bp。Oct4-shRNA序列为5′-ccc tca ctt cac tgc act gta-3′,位于全长Oct-4编码序列的第 1233~1253 bp。同时设计阴性对照 (CtrlshRNA) 序列5′-gac ttc ata agg cgc atg c-3′。由武汉市晶赛生物工程技术有限公司合成,合成的编码shRNA的DNA结构为:XhoⅠ+BamHⅠ+U6+ Sense DNA+Loop (ttc aag acg) +Antisense DNA+ TTTTTT+BglⅡ,克隆入pGenesil-1.1。
1.2.3 腺病毒载体的构建与病毒包装
将上述构建的Survivin、Oct-4和阴性对照3个shRNA质粒酶切回收,目的基因片段插入到腺病毒穿梭载体pDC312的多克隆位点,经酶切鉴定正确后,分别命名为pDC312-Surv-shRNA、pDC312-Oct4-shRNA和pDC312-Ctrl-shRNA。同时将 Surv-shRNA (正向插入 SalⅠ+BglⅡ) 和 Oct4-shRNA (反向插入BamHⅠ+BglⅡ) 克隆入pDC312中,构建含双靶向 shRNA 的载体pDC312-Dual-shRNA。
用含有 10%胎牛血清的 DMEM培养HEK293细胞,对数生长期时用0.25%胰酶消化传代,转种于6孔培养板,置于37 ℃饱和湿度及5% CO2的培养箱内生长48 h,待细胞汇合度为60%时,同时转染pBHGloxdeltaE13Cre和上述含 shRNA的腺病毒穿梭载体质粒 pDC312-Dual-shRN、pDC312-Surv-shRNA、pDC312-Oct4-shRNA和 pDC312-Ctrl-shRNA,转染方法参考Invitrogen公司 LipoFectamine2000试剂盒说明书。共转染12 d后出现病毒空斑,经过空斑纯化,得到重组腺病毒,分别命名为Ad5-Dual-shRNA、Ad5-Surv-shRNA、Ad5-Oct4-shRNA和Ad5-CtrlshRNA。用病毒基因组提取试剂盒QIAGEN DNA Blood Mini Kit提取病毒基因组DNA,进行PCR鉴定。鉴定正确后,采用 HEK293细胞内扩增及常规氯化铯梯度离心纯化方法,扩增及纯化腺病毒。
1.2.4 shRNA 腺病毒载体对基因表达的沉默作用
取对数生长期的肝癌细胞系EHBH-H1铺于6孔板,24 h后按 MOI=50分别感染腺病毒Ad5-Dual-shRNA、Ad5-Surv-shRNA、Ad5-Oct4-shRNA和 Ad5-Ctrl-shRNA,并设不加病毒的对照组,在37 ℃饱和湿度及5% CO2的培养箱内培养48 h后移去培养液,PBS洗3次后,加细胞裂解蛋白提取液,室温下处理30 min,12 000 r/min离心收集上清,定量后分装于 EP管-80 ℃保存。
Western blotting操作方法检测培养细胞中Oct-4与Survivin蛋白的表达情况。将蛋白样品进行SDS-PAGE电泳,每孔上样20 μL,电泳结束后用半干转印仪将电泳产物转移到NC膜上。5%脱脂奶粉室温封闭2 h,加一抗 (1∶1 000稀释),室温孵育3~4 h或4 ℃过夜,TBST洗膜5 min,重复5次,加辣根过氧化物酶标记的二抗 (1∶10 000稀释),室温孵育1 h,TBST洗膜5 min,重复5次后进行化学发光反应,暗室曝光,胶片扫描后分析目标条带的分子量和光密度值。
1.2.5 MTT实验
收集对数生长期的EHBH-H1细胞计数,用10%胎牛血清DMEM培养液制成单细胞悬液,按1×l04个细胞/孔铺96孔板,每孔100 μL。置于37 ℃饱和湿度及5% CO2的培养箱中培养过夜。用无血清培养液稀释病毒,按MOI = 0.01、0.02、0.05、0.1、0.2、0.5、1、2、5、10、20、50加入l00 μL稀释好的病毒液分别感染腺病毒,对应于每个MOI值设置4个复孔,置于37 ℃饱和湿度及5% CO2的培养箱中,7 d后弃去培养液,加入无血清的DMEM培养液100 μL/孔和5 g/L的MTT 1 0 μL/孔,继续培养4~6 h,之后每孔加入100 μL 10% SDS培养过夜,用酶联免疫检测仪570 nm波长测定光吸收值,计算细胞存活率。
1.2.6 动物实验
取对数生长期的EHBH-H1细胞悬液,计数后按5×106个细胞/100 µL注射于裸鼠前肢右侧皮下,恒温、通风、无菌条件下饲养。注射约1周后,在接种区皮下出现米粒大小移植瘤。剔除瘤体过大和过小的裸鼠,剩余25只,随机分为5组:Ad5-Dual-shRNA、Ad5-Surv-shRNA、Ad5-Oct4-shRNA、Ad5-Ctrl-shRNA、空白对照组,每组5只。每组释以2×108PFU/100 µL的重组病毒瘤内多点注射,隔日1次,共5次;空白对照组以生理盐水替代重组病毒注射,100 µL×5次。开始治疗后,定时测量瘤体大小,以“最大径×最小径2×0.5”公式计算瘤体体积。
观察周期结束,断颈处死小鼠,取瘤体标本,以10%中性缓冲福尔马林固定,石蜡包埋切片。采用 SP双染色法免疫组化定位肿瘤组织中Survivin、Oct-4的表达。在5个高倍视野下计数每张切片中阳性细胞的比例。
1.3 统计学处理
2 结果与分析
2.1 腺病毒介导特异性shRNA对基因表达的沉默作用
EHBH-H1细胞系按MOI=50感染特异性腺病毒载体48 h后,Ad5-Dual-shRNA组Oct-4与Survivin蛋白的表达均转阴,Ad5-Surv-shRNA和Ad5-Oct4-shRNA能够各自下调相应的基因表达水平,但Ad5-Oct4-shRNA对Survivin蛋白的表达也有一定的下调作用 (图1)。结果显示双靶向载体Ad5-Dual-shRNA能够有效地沉默Oct-4与Survivin基因的表达。
2.2 双靶向shRNA腺病毒对肝癌细胞增殖的抑制作用
EHBH-H1细胞按不同的感染强度感染shRNA腺病毒,随着病毒滴度的增加,细胞的存活率都有明显的下降 (图 2)。在 MOI=0.1和 1时,Ad5-Dual-shRNA组细胞的平均存活率已下降到 43.7%和 22.4%,显著低于其他各组(P<0.01)。Ad5-Surv-shRNA 组与 Ad5-Oct4-shRNA 组的细胞存活率也低于空白对照和Ad5-Ctrl-shRNA组。结果说明特异性双靶向载体Ad5-Dual-shRNA 能够显著地抑制肝癌细胞系EHBH-H1的增殖。
2.3 双靶向shRNA腺病毒抑制肝癌裸鼠移植瘤的生长
EHBH-H1细胞裸鼠移植瘤经病毒治疗后,第10天Ad5-Dual-shRNA组瘤体体积已出现明显差异 (图 3)。至 20 d,Ad5-Dual-shRNA、Ad5-Surv-shRNA、Ad5-Oct4-shRNA、Ad5-CtrlshRNA、空白对照组肿瘤体积分别为 (250.87± 17.37)、(671.27±212.03)、(566.16±123.71)、(980.66±95.84)、(1 101.13±273.14) mm3。统计发现,Ad5-Dual-shRNA、Ad5-Surv-shRNA、Ad5-Oct4-shRNA 组与对照组相比差异显著(P<0.01),以 Ad5-Dual-shRNA组疗效最好。Ad5-Ctrl-shRNA 组与对照组相比无显著差异(P>0.05)。
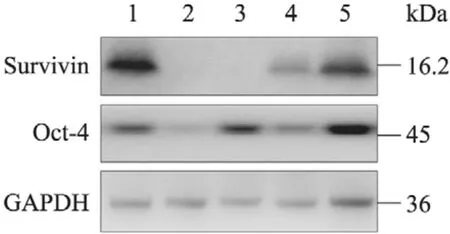
图1 Survivin和Oct-4特异性shRNA对目的基因表达的沉默作用Fig. 1 The silencing effect of specific shRNA on the expression of Survivin and Oct-4 proteins. 1: control group; 2: Ad5-Dual-shRNA group; 3: Ad5-Surv- shRNA group; 4: Ad5-Oct4-shRNA group; 5: Ad5-Ctrl-shRNA group.

图2 MTT法检测癌细胞存活率Fig. 2 Cell viability was assayed by MTT test.
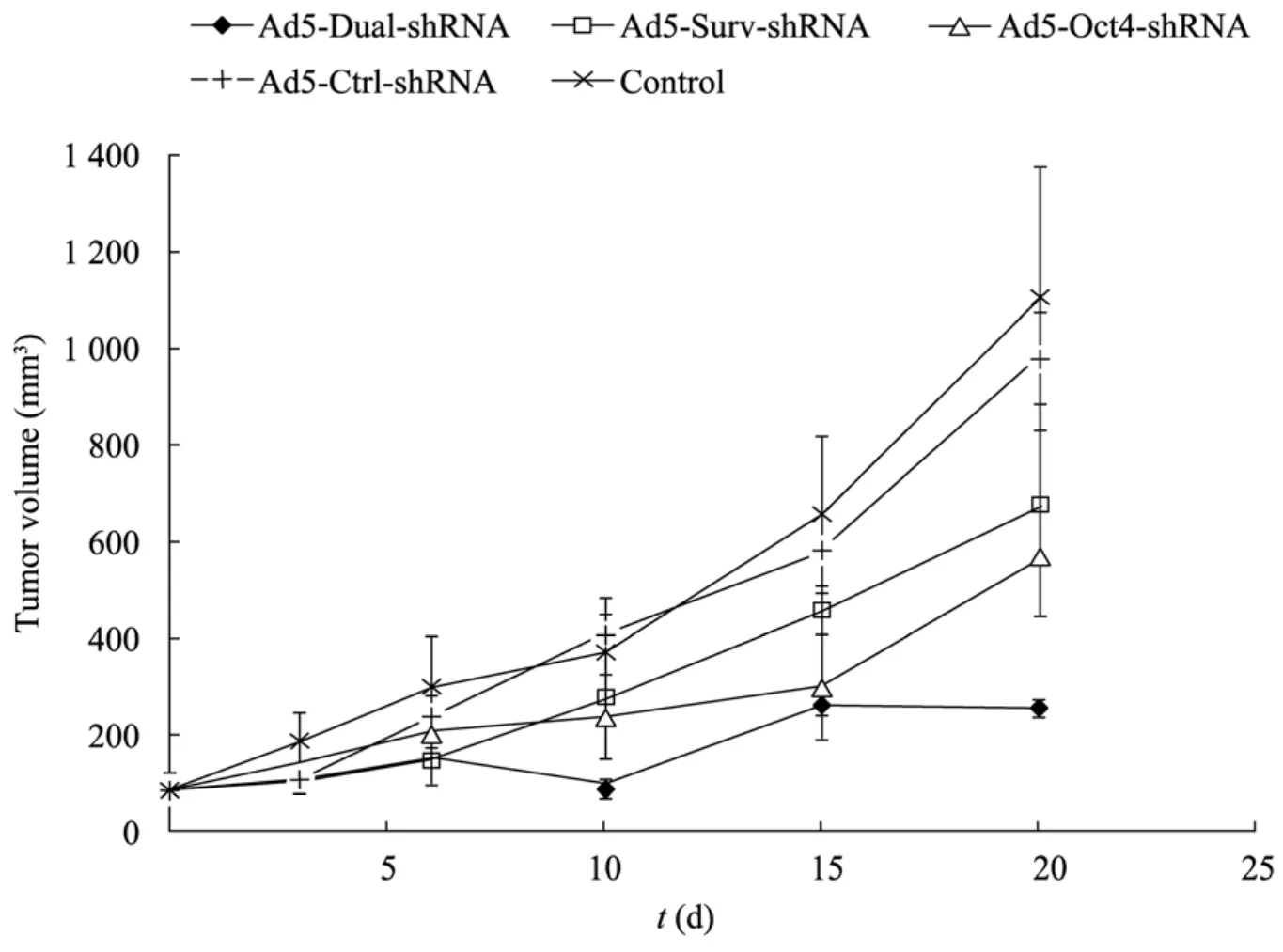
图3 肝癌裸鼠移植瘤shRNA病毒治疗的疗效对比Fig. 3 HCC xenograft models were established by subcutaneous injection of 5×106 EHBH-H1 cells per mouse in five groups of nude mice (n=5/group).
2.4 病理检查
移植瘤治疗后,取瘤体标本,石蜡包埋切片,做 Oct-4和 Survivin表达的双染免疫组化,Survivin标记为深蓝色 (NBT/BCIP显色),Oct-4标记为红色 (AEC显色)。可以看出,空白对照组 Oct-4与 Survivin的表达呈双阳性;Ad5-Surv-hRNA组Survivin阴性而Oct-4阳性,阳性反应主要集中在细胞核和细胞浆;Ad5-Oct4-shRNA组Oct-4阴性,同时 Survivin阳性表达率下降;Ad5-DualhRNA组 Oct-4和 Survivin表达均明显下降(图4)。
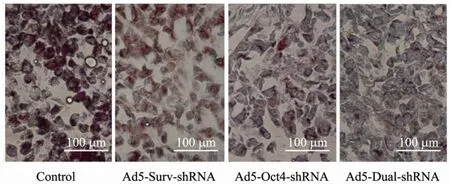
图4 肝癌裸鼠移植瘤免疫组化检测Survivin (NBT/BCIP蓝色标记) 和Oct-4 (AEC红色标记) 的表达Fig. 4 The results of immunocytochemistry for Survivin (prussian blue stained with NBT/BCIP) and Oct-4 (red stained with AEC).
3 讨论
Survivin基因已成为肿瘤药物和基因治疗的一个理想靶点,其抑制肿瘤细胞凋亡的作用已有较多文献报道,主要是通过抑制caspase级联反应下游的 caspase-3、caspase-7等发挥其抗凋亡作用[11],而其体内调节机制以及与其他关键基因之间的相互作用还存在诸多问题有待解决。有实验证实,小鼠胚胎细胞 Survivin的功能活性受Oct-4转录因子的调节,降低细胞Oct-4表达会明显抑制Survivin基因启动子的活性,从而抑制Survivin的表达[12]。近来的研究也证实,人体很多类型的肿瘤细胞都有较高水平的Oct-4表达,可能参与维持肿瘤细胞特别是肿瘤干细胞的自我更新、阻止肿瘤细胞分化等功能[13]。那么,在恶性转化的肿瘤细胞中,Survivin和Oct-4之间是否存在相互调节或影响的关系,目前国内外尚未见文献报道。我们已有的研究发现,在肝胆肿瘤中转录因子Oct-4对Survivin的表达有正向调节作用,Oct-4是Survivin表达的上游调控基因。Oct-4引起的Survivin增强表达,直接促进了肿瘤细胞周期的进展和细胞凋亡的抑制,而沉默Survivin表达则引起细胞周期阻滞,诱导细胞凋亡[14]。
RNA干扰 (RNA interference, RNAi) 是指在进化过程中高度保守的、由双链RNA诱发的、同源mRNA高效特异性降解的现象。其作用机制是双链RNA被特异的核酸酶降解,产生干扰小RNA (siRNA),这些siRNA与同源的靶RNA互补结合,特异性酶降解靶 RNA,从而抑制、下调基因表达。由于使用RNAi技术可以特异性剔除或关闭特定基因的表达,所以该技术已经发展成为基因治疗、基因结构功能研究的快速而有效的方法[15]。针对肿瘤细胞Survivin高表达而设计的siRNA在脑胶质瘤[16]、胰腺癌[17]、膀胱癌[18]的实验中,均能够显著抑制肿瘤细胞的生长,产生抗癌作用。结果显示RNAi技术用于肿瘤的基因治疗具有可靠的疗效和良好的发展前景。
根据上述Oct-4增强Survivin表达的调节机制,本项研究构建 Oct-4和 Survivin双特异性shRNA的腺病毒表达载体,研究其对肝癌细胞EHBH-H1的抑制作用。体外细胞学研究发现,双靶向 shRNA载体能够同时有效地沉默 Oct-4与 Survivin基因的表达,从而抑制肝癌细胞系EHBH-H1的增殖活性,其效果与病毒感染强度密切相关。双靶向shRNA载体对肝癌细胞生长的抑制作用,明显强于单一靶向的shRNA载体。研究中发现,Oct4-shRNA可引起Survivin表达抑制,这与我们先前的实验相一致,证实 Oct-4是Survivin的上游调控因子[14]。在EHBH-H1裸鼠移植瘤的实验中,我们进一步证实了针对Oct-4和Survivin的双特异性shRNA载体能够沉默Oct-4与Survivin的表达,明显抑制移植瘤的生长。而单一抑制Survivin的表达,对移植瘤的抑制效果和维持时间均十分有限,停止治疗后移植瘤出现恢复性生长的现象。单一抑制Oct-4的表达,疗效好于Survivin特异性shRNA载体。
综上所述,我们构建的针对Oct-4和Survivin的双靶向特异性腺病毒载体,不仅能够有效抑制目的基因的表达,而且能在体内、体外抑制肝癌细胞的增殖活性和裸鼠移植瘤的生长,发挥出良好的抗肿瘤效果。实验证明,双靶向 shRNA表达载体在肿瘤基因治疗中具有更好的优势。而且,在抑制癌细胞Survivin表达控制细胞生长的同时,敲除Oct-4的表达有可能进一步抑制具有肿瘤干细胞特性的细胞的增殖。
[1] Qin LX, Sun HC, Tang ZY. Progress in research of primary hepatic carcinoma, The Summary of Shanghai-Hong Kong International Liver Congress. Chin J Surg, 2006, 44(15): 1070−1074.钦伦秀, 孙惠川, 汤钊猷. 原发性肝癌研究进展−2006沪港国际肝病大会纪要. 中华外科杂志, 2006, 44(15): 1070−1074.
[2] Shariff MI, Cox IJ, Gomaa AI, et al. Hepatocellular carcinoma: current trends in worldwide epidemiology, risk factors, diagnosis and therapeutics. Expert Rev Gastroenterol Hepatol, 2009, 3(4): 353−367.
[3] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002. CA Cancer J Clin, 2005, 55(2): 74−108.
[4] LaCasse EC, Baird S, Korneluk RG, et al. The inhibitors of apoptosis (IAPs) and their emerging role in cancer. Oncogene, 1998, 17(25): 3247−3259.
[5] Ryan BM, O'Donovan N, Duffy MJ. Survivin: a new target for anti-cancer therapy. Cancer Treat Rev, 2009, 35(7): 553−562.
[6] Tan GC, Norlatiffah S, Sharifah NA, et al. Immunohistochemical study of p16INK4Aand survivin expressions in cervical squamous neoplasm. Indian J Pathol Microbiol, 2010, 53(1): 1−6.
[7] Zaffaroni N, Pennati M, Daidone MG. Survivin as a target for new anticancer interventions. J Cell Mol Med, 2005, 9(2): 360−372.
[8] Pennati M, Folini M, Zaffaroni N. Targeting survivin in cancer therapy: fulfilled promises and open questions. Carcinogenesis, 2007, 28(6): 1133−1139.
[9] Qiao L, Wong BCY. Targeting apoptosis as an approach for gastrointestinal cancer therapy. Drug Resist Updat, 2009, 12(3): 55−64.
[10] Hansis C, Grifo JA, Krey LC. Oct-4 expression in inner cell mass and trophectoderm of human blastocysts. Mol Hum Reprod, 2000, 6(11): 999−1004.
[11] Altieri DC. Survivin, versatile modulation of cell division and apoptosis in cancer. Oncogene, 2003, 22(53): 8581−8589.
[12] Guo Y, Mantel C, Hromas RA, et al. Oct-4 is critical for survival/antiapoptosis of murine embryonic stem cells subjected to stress: effects associated with Stat3/survivin. Stem Cells, 2008, 26(1): 30−34.
[13] Lau SK, Chang KL. OCT4: a sensitive and specific immunohistochemical marker for metastatic germ cell tumors. Adv Anat Pathol, 2006, 13(2): 76−79.
[14] Wang DM, Liu C, Jiang XQ, et al. Expression of Oct-4 transcriptional factor regulates the anti-apoptosis effect of Survivin in hepatobiliary cancer cells. Chin J Cell Biol, 2010, 32(5): 709−713.王端明, 刘辰, 姜小清, 等. 肝胆肿瘤细胞转录因子Oct-4的表达对Survivin抗凋亡作用的调控.中国细胞生物学学报, 2010, 32(5): 709−713.
[15] Rissland OS, Lai EC. RNA silencing in Monterey. Development, 2011, 138(15): 3093−3102.
[16] Hendruschk S, Wiedemuth R, Aigner A, et al. RNA interference targeting survivin exerts antitumoral effects in vitro and in established glioma xenografts in vivo. Neuro Oncol, 2011, 13(10): 1074−1089.
[17] Jiang C, Tan T, Yi XP, et al. Lentivirus-mediated shRNA targeting XIAP and survivin inhibit SW1990 pancreatic cancer cell proliferation in vitro and in vivo. Mol Med Report, 2011, 4(4): 667−674.
[18] Seth S, Matsui Y, Fosnaugh K, et al. RNAi-based therapeutics targeting survivin and PLK1 for treatment of bladder cancer. Mol Ther, 2011, 19(5): 928−935.

