结核分枝杆菌铁氧还蛋白还原酶FdrA 和FprA在CYP125A1的电子传递链中的作用分析
乔峰,张健美,白银磊,杨信怡,李聪然,李国庆,胡辛欣,游雪甫
·论著·
结核分枝杆菌铁氧还蛋白还原酶FdrA 和FprA在CYP125A1的电子传递链中的作用分析
乔峰,张健美,白银磊,杨信怡,李聪然,李国庆,胡辛欣,游雪甫
目的体外评价结核分枝杆菌(Mtb)铁氧还蛋白还原酶FdrA 和 FprA 的活性,探索它们分别与两种铁氧还蛋白的偶联作用,并分析它们在 CYP125A1 的电子传递链中的作用。
分枝杆菌,结核; 铁氧还蛋白 NAPP 还原酶; 细胞色素 P450 酶系统; 电子传递链复合蛋白质类
www.cmbp.net.cn 中国医药生物技术, 2012, 7(3):178-186
1998 年结核分枝杆菌(Mycobacterium tuberculosis,Mtb)H37Rv 基因组测序工作的完成标志着对 Mtb 的研究进入了一个崭新的时代[1]。目前发现 Mtb 有 20 种细胞色素P450 酶(以下简称 P450 酶)编码基因[1],已有研究表明这些P450 酶均具有非常重要的生理生化功能,如CYP128A1 可能与 Mtb 最适生长相关[2],CYP121A1参与一种二级代谢产物的合成[3]等。近年来研究发现 CYP125A1 编码基因所在的操纵子在感染巨噬细胞时被诱导表达且是必需的[4],并且 CYP125A1(可能还有 CYP142A1)是 Mtb 在体外利用胆固醇作为碳源正常生长的关键酶,参与 Mtb 感染宿主后的能量代谢和碳源供应,可以作为基于胆固醇降解的潜在药物作用靶点[5-8]。细菌的 P450 酶需要与一个铁氧还蛋白还原酶(ferredoxin reductase,FDR)和一个铁氧还蛋白(ferredoxin,FDX)共同组成一个催化系统才能完成催化反应,其中 FDR 和 FDX 共同组成 P450 酶的电子传递链,如恶臭假单胞菌中 P450 cam 在假单胞氧还蛋白还原酶和假单胞氧还蛋白电子传递链的作用下,催化樟脑5 位环氧化[9]。Mtb 基因组有 5 个 FDX、2 个FDR 和 2 个 FDRX(由一个 FDX 结构域和一个FDR 结构域组成的融合蛋白)编码基因[1],从而可以推测这 20 个 P450 酶的电子传递链由FDR/FDX 或者 FDRX 中的一种或数种组成。所以为了更加明确 CYP125A1 及其他 P450 酶的生理功能,对其电子传递链的研究就非常重要。
目前研究发现 FdrA(Rv0688)是 NADH 依赖的铁氧还蛋白还原酶,并且可以与 Mtb Fdx (Rv0763c,简称 Fdx)偶联,从而支持 CYP51B1的活性[10];FprA(Rv3106)是 NADPH 依赖的铁氧还蛋白还原酶,也可以与 Fdx 偶联从而支持CYP51B1 的活性[11-13]。本研究外源表达了 FdrA、FprA 和 CYP125A1;通过体外研究分析了 FdrA 和 FprA 在 CYP125A1(Rv3545c)电子传递链中的作用,推测出 FprA 为 CYP125A1 催化系统的成员,进一步明确了 CYP125A1 的生理功能,并为建立以 CYP125A1 催化系统作为药物靶点的体外药物筛选体系提供依据。
1 材料与方法
1.1 材料
1.1.1菌株与质粒 克隆菌株 E.coli DH5α,表达菌株 E.coli BL21 DE3,质粒 pET-30a(+) 均由本实验室保藏。
1.1.2工具酶、试剂盒和生化试剂 限制性内切酶 Nde I、Xho I,T-A 克隆试剂盒,DNA 连接试剂盒,蛋白质分子量标准(低)购自日本 TaKaRa 公司;Taq DNA 聚合酶购自美国 Promega 公司;BCA蛋白定量试剂盒购自上海碧云天生物技术公司;4-胆甾烯-3-酮、5-氨基酮戊酸、菠菜铁氧还蛋白(spFDX)和菠菜铁氧还蛋白还原酶(spFDR)购自美国Sigma 公司;其余试剂均购自生工生物工程(上海)有限公司;引物合成及测序工作由美国Invitrogen 公司完成;蛋白质的肽指纹图谱检测由国家生物医学分析中心完成。
1.1.3主要仪器 AKTA purifier 蛋白纯化仪购自美国通用电气公司;Enspire 2300 酶标仪购自美国Perkin Elmer 公司;Agilent 1200 高效液相色谱仪(配有 DAD 检测器)购自美国安捷伦科技公司。
1.2 方法
1.2.1FdrA、FprA 和 CYP125A1 编码基因的克隆 FdrA 上游引物:5′ CCATATGAACGCACACG TGACCAGTCGTGAA 3′,下游引物:5′ TGTCTCGA GGGCCTGAGTTTGGTCTAACACT 3′;FprA 上游引物:5′ CACATATGCGTCCCTATTACATCGCCAT CG 3′,下游引物:5′ ACTCGAG GCCGAGCCCAAT CCGCAACAG 3′;CYP125A1 上游引物:5′ GACAT ATGTCGTGGAATCACCAGTCA 3′,下游引物:5′ A ATCTCGAGGTGAGCAACCGGGCATCT 3′。上游引物分别加入 Nde I 酶切位点,用下划线表示;下游引物分别加入 Xho I 酶切位点,用下划线表示,以 Mtb H37Rv 基因组为模板扩增目的基因。这三个基因的 PCR 反应条件均为:95 ℃ 4 min;95 ℃1 min,54 ℃ 45 s,72 ℃ 90 s,循环 30 次;72 ℃10 min。将扩增产物用 Nde I、Xho I 双酶切,连接至经 Nde I、Xho I 双酶切的 pET-30a(+) 载体中,转化至 E.coli BL21 DE3 感受态细胞,并经 PCR鉴定和测序鉴定成功。其中重组质粒在 C 端含6 × His 标签,以便蛋白亲和层析。
1.2.2FdrA、FprA 和 CYP125A1 的蛋白表达、纯化及定量 FdrA 和 FprA 重组菌株接种于含50 µg/ml 卡那霉素的 LB 培养基中,37 ℃,250 r/min振荡培养至 OD600为 0.6,加入 IPTG 至终浓度0.5 mmol/L,再于 20 ℃,100 r/min 继续培养 30 h。CYP125A1 重组菌株待培养至 OD 值为 0.6 时加入 IPTG 至终浓度 1 mmol/L,5-氨基酮戊酸至终浓度为 1 mmol/L,然后于 28 ℃,150 r/min 继续培养 30 h。收集菌体,重悬于 1/10 体积的裂解缓冲液[20 mmol/L Tris-Cl,1 mmol/L 乙二胺四乙酸(EDTA),0.5 mmol/L 二硫苏糖醇(DTT),pH 8.0]中,冰上超声破碎细胞,4 ℃,16 000 × g 离心 30 min,上清用 0.22 µm 滤器过滤后于 AKTA Purifier 蛋白纯化仪中进行纯化。镍柱预先用结合缓冲液(20 mmol/L 磷酸钠,500 mmol/L NaCl,20 mmol/L 咪唑,pH 7.4)平衡,采用咪唑 20 ~500 mmol/L 线性梯度进行洗脱并收集洗脱组分。然后将含有目的蛋白的组份加入至预先用 50 mmol/L HEPES 缓冲液(10% 甘油,V∶V,pH 7.4)平衡的 PD-10 脱盐柱中,并用相同缓冲液洗脱蛋白。所有蛋白均采用 BCA 蛋白质定量试剂盒(增强型)进行定量。纯化蛋白分装保存于 –70 ℃ 冰箱,每次使用时冰上解冻即可恢复全部活性。
1.2.3采用 2,6-二氯酚靛酚为电子受体评价 FdrA 和 FprA 的活性 2,6-二氯酚靛酚(DCPIP)是一种氧化还原染料,氧化态呈蓝色,还原态无色,可以直接接受 FDR 传递的电子,从而可以用来评价FDR 对 NAD(P)H 的氧化活性。反应在 50 mmol/L磷酸钾缓冲液(pH 7.5)中进行,采用酶标仪进行监测,200 μl 反应体系中含有 200 nmol/L FDR,100 μmol/L DCPIP 和一系列浓度的 NAD(P)H,通过监测 DCPIP 在 30 ℃,600 nm 下吸光度的降低来计算反应速率,将底物浓度与反应速率用SigmaPlot 13.0 软件拟合酶动力学参数。并采用该方法考察 NAD+和 NADP+分别对 FdrA 和 FprA活性的影响。
1.2.4采用细胞色素 C 为电子受体研究 FdrA 或 FprA 分别与 Fdx 或 spFDX 的偶联情况 细胞色素 C 是一类铁血红素蛋白,生理条件下介导电子从复合体 III 转移至复合体 IV,体外条件下可以接受 FDX 传递的电子,从而可以用来评价FDR 与 FDX 的偶联作用。反应在 50 mmol/L 磷酸钾缓冲液(pH 7.5)中进行,200 μl 反应体系中含有 200 nmol/L FDR,1 μmol/L FDX,500 μmol/L细胞色素 C 和一系列浓度的 NAD(P)H,通过监测细胞色素 C 在 30 ℃,550 nm 下吸光度的升高来计算反应速率,将底物浓度与反应速率进行酶动力学参数拟合。并采用相同方法考察 NAD+和NADP+分别对 FdrA 和 FprA 活性的影响。
1.2.5HPLC 分析 FdrA 和 FprA 对 CYP125A1代谢 4-胆甾烯-3-酮活性的电子传递作用 4-胆甾烯-3-酮溶于 50 mmol/L 磷酸钾缓冲液(pH 7.5,含 10% 羟丙基-β-环糊精),配成 1 mmol/L 的储存液。CYP125A1 催化 4-胆甾烯-3-酮羟基化的反应在50 mmol/L 磷酸钾缓冲液(pH 7.5)中进行,200 μl反应体系中含有 100 nmol/L CYP125A1,1 μmol/L FDX,200 nmol/L FDR,100 μmol/L 4-胆甾烯-3-酮,通过加入 NAD(P)H 再生系统[1 mmol/L 葡萄糖-6-磷酸,1 Unit 葡萄糖-6-磷酸脱氢酶和 0.5 mmol/L NAD(P)+]启动反应。分别考察 FdrA/Fdx、FdrA/ spFDX、FprA/Fdx 和 FprA/spFDX 对 CYP125A1的电子传递作用。空白对照不加 P450 酶;阳性对照采用 spFDR/spFDX 电子传递链,经 NADPH再生系统启动反应[14]。室温反应 20 h 后,用相同体积乙腈终止反应并进行蛋白沉淀,13 000 r/min 室温离心 20 min,取 20 μl 上清进行高效液相分析。色谱条件如下:色谱柱:Eclipse XDB-C18(4.6 mm × 150 mm,5 μm);流动相:乙腈-异丙醇(85∶15,V∶V);流速:1 ml/min;检测波长:240 nm;柱温:室温。
2 结果
2.1 纯化的 FdrA、FprA 与 CYP125A1 的 SDSPAGE鉴定及肽指纹图谱鉴定
纯化的 FdrA、FprA 和 CYP125A1 的 SDSPAGE 鉴定结果分别如图 1A,1B 和 1C 所示,FdrA、FprA 与 CYP125A1 大小均与预测分子量一致,并且呈现单一条带,是较纯的蛋白。将对应条带切出并用胰蛋白酶处理,采用 MALDI-TOF-MS进行肽指纹图谱检测(图 2),肽指纹图谱结果用MASCOT 在线软件进行比对,结果发现 FdrA 得分为 127,FprA 为 185,CYP125A1 为 221(得分大于 85 分即P< 0.05,有统计学意义),因此纯化的 FdrA、FprA 和 CYP125A1 是正确的。

图1 SDS-PAGE 检测 FdrA(A),FprA(B)和 CYP125A1 (C)Figure 1 SDS-PAGE analysis of FdrA (A), FprA (B) and CYP125A1 (C)
2.2 FdrA、FprA 与 CYP125A1 的光谱学鉴定

图2 FdrA(A)、FprA(B)和 CYP125A1(C)的肽指纹图谱Figure 2 The peptide mass fingerprint of FdrA (A), FprA (B) and CYP125A1 (C)
FdrA、FprA 与 CYP125A1 均溶解在 50 mmol/L磷酸钾缓冲液(pH 7.5)中,300 ~ 700 nm 对各个蛋白进行光谱扫描,扫描结果见图 3。结果发现FdrA(图 3A)和 FprA(图 3B)均在 370 nm 和445 nm 下有特殊的吸收峰,与文献[10,13]报道一致。CYP125A1(图 3C)在 393、415 和 530 nm呈现特殊的吸收峰,与文献[8]报道一致。
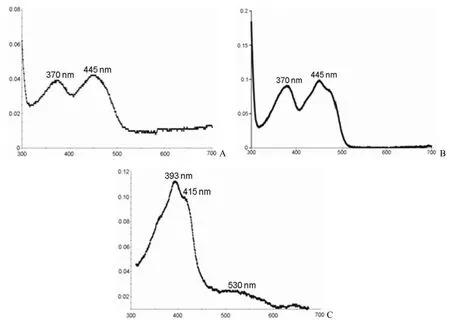
图3 FdrA(A)、FprA(B)和 CYP125A1(C)的光谱扫描图Figure 3 UV/visible spectrum of pure FdrA (A), FprA (B) and CYP125A1 (C)
2.3 采用 DCPIP 为电子受体评价 FdrA 和 FprA的活性
以 DCPIP 作为电子受体,FdrA 对 NADH 的Km 值在 22 ~ 27 μmol/L 之间,Kcat 值在 375 min-1左右;在所设定浓度范围(0 ~ 200 mmol/L)内,检测不出 FdrA 对 NDAPH 的降解作用,因此FdrA 对 NADH 的亲和力远远高于对 NADPH 的亲和力(表 1)。FprA 对 NADH 的Km 值在 55 ~72 μmol/L 之间,Kcat 值在 118 min-1左右(表 1);在 NADPH 的各个浓度下,FprA 最初可以快速降解 NADPH,但是反应速率均随着时间迅速减慢,导致反应速率无法确证,酶动力学参数无法拟合。这种现象暗示了 NADPH 的代谢物 NADP+为FprA 的潜在抑制剂,随着 NADP+的不断生成,反应抑制程度逐渐加深。因此本研究考察了以 NADH作为电子供体,不同浓度(0、10 和 100 μmol/L)的 NAD+和 NADP+分别对 FdrA 和 FprA 活性的影响。结果发现,NAD+对 FdrA 和 FprA 均无抑制作用,NADP+对 FdrA 也无抑制作用(表 1);但是 NADP+对 FprA 有明显的抑制作用,FprA对抑制剂 NADP+的 Ki =(2.42 ± 0.42)μmol/L,并且双倒数曲线交于纵轴,符合竞争性抑制剂的特征(图 4)。
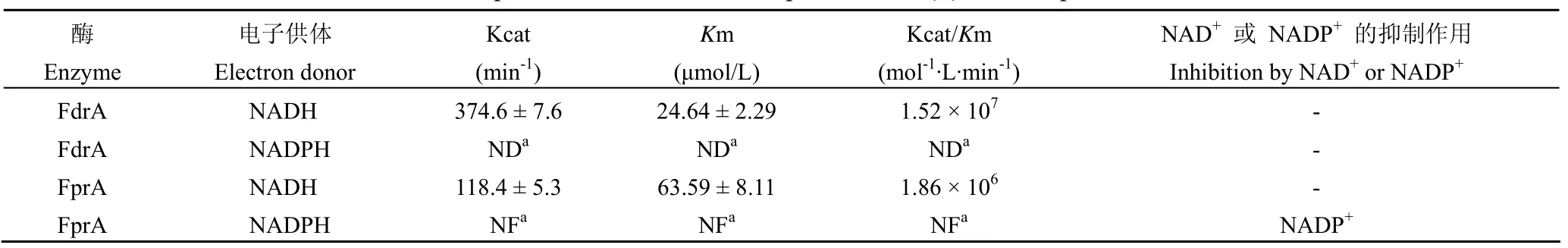
表1 以 DCPIP 作为电子受体,FdrA 和 FprA 对 NADH 或 NADPH 的酶动力学参数Table 1 Kinetic parameters of FdrA and FprA to NAD(P)H in the presence of DCPIP
2.4 以细胞色素 C 为电子受体研究 FdrA 或FprA 分别与 Fdx、spFDX 的偶联情况
Fdx 的基因克隆,蛋白外源表达纯化采用Bellamine 等[11]报道的方法。FdrA 利用 NADH 还原细胞色素 C 在无 FDX 存在时对 NADH 的Kcat 值约 2.4 min-1,Km 值约2.76 μmol/L;在5 倍浓度 Fdx 存在下,FdrA 对 NADH 的Km值基本不变,Kcat 值明显增加至 15.5 min-1;在5 倍浓度 spFDX 存在下,FdrA 对 NADH 的Kcat 值和Km 值均基本不变(表 2)。无 FDX 存在时,FprA 对 NADPH 的 Kcat 值约3.0 min-1,Km 值约 10.65 μmol/L;在 5 倍 Fdx 存在下,FprA 对 NADPH 的Km 值增加为 14.02 μmol/L,但是 Kcat 值明显增加至 26.5 min-1;在 5 倍spFDX 存在下,FprA 对 NADPH 的Km 值增加为 12.57 μmol/L,Kcat 值明显增加至 16.4 min-1(表 2)。无 FDX 存在时,FprA 对 NADH 的Km值约 60 μmol/L,Kcat 值约 1.8 min-1;在 5 倍 Fdx存在下,FprA 对 NADH 的Km 值基本不变,Kcat值增加至 2.4 min-1;在 5 倍 spFDX 存在下,FprA 对 NADH 的Km 值基本不变,Kcat 值增加至2.0 min-1(表 2)。FprA 对 NADPH 的Km 值明显小于对 NADH 的Km 值,并且 Kcat 值也明显大于对 NADH 的Kcat 值,因此 FprA 对 NADPH的亲和力明显高于 NADH(表 2)。在此条件下没有发现 NAD+和 NADP+对 FdrA 或 FprA 有任何抑制作用(表 2)。

图4 不同浓度 NADP+对 FprA 酶动力学曲线的影响(A:米氏曲线;B:Lineweaver-Burk双倒数图)Figure 4 The kinetic curves of FprA in various concentrations of NADP+(A: Michaelis-Menten curve; B: Lineweaver-Burk curve)

表2 细胞色素 C 为电子受体时,FdrA 和 FprA 对 NAD(P)H 的酶动力学参数Table 2 The kinetic parameters of FdrA and FprA to NAD(P)H in the presence of cytochrome C
2.5 HPLC 分析 FdrA 和 FprA 对 CYP125A1 代谢 4-胆甾烯-3-酮活性的电子传递作用
CYP125A1 可以在 spFDX 和 spFDR 的辅助下,利用 NADPH 催化胆固醇或 4-胆甾烯-3-酮的 C27 位羟基化[14],本研究采用此体系作为阳性对照。FdrA 实验组采用 NADH 再生系统启动反应[10],FprA 实验组采用 NADPH 再生系统[13]。实验结果发现:4-胆甾烯-3-酮在 13.15 min 左右出峰(图 5D 和 6D),阳性对照在保留时间 4.3 min左右有一新峰,即代谢物 27-羟基-4-胆甾烯-3-酮的吸收峰(图 5A和 6A)。FprA/spFDX 实验组在保留时间 4.3 min 左右也有一个峰(图 6C),峰面积与阳性对照基本一致,因此在 FprA 和 spFDX辅助下,CYP125A1 也具有对 4-胆甾烯-3-酮相同的催化作用。但是其他实验组 FdrA/Fdx(图 5B),FdrA/spFDX(图 5C)和 FprA/Fdx(图 6B)在4.3 min 均未检测出吸收峰。
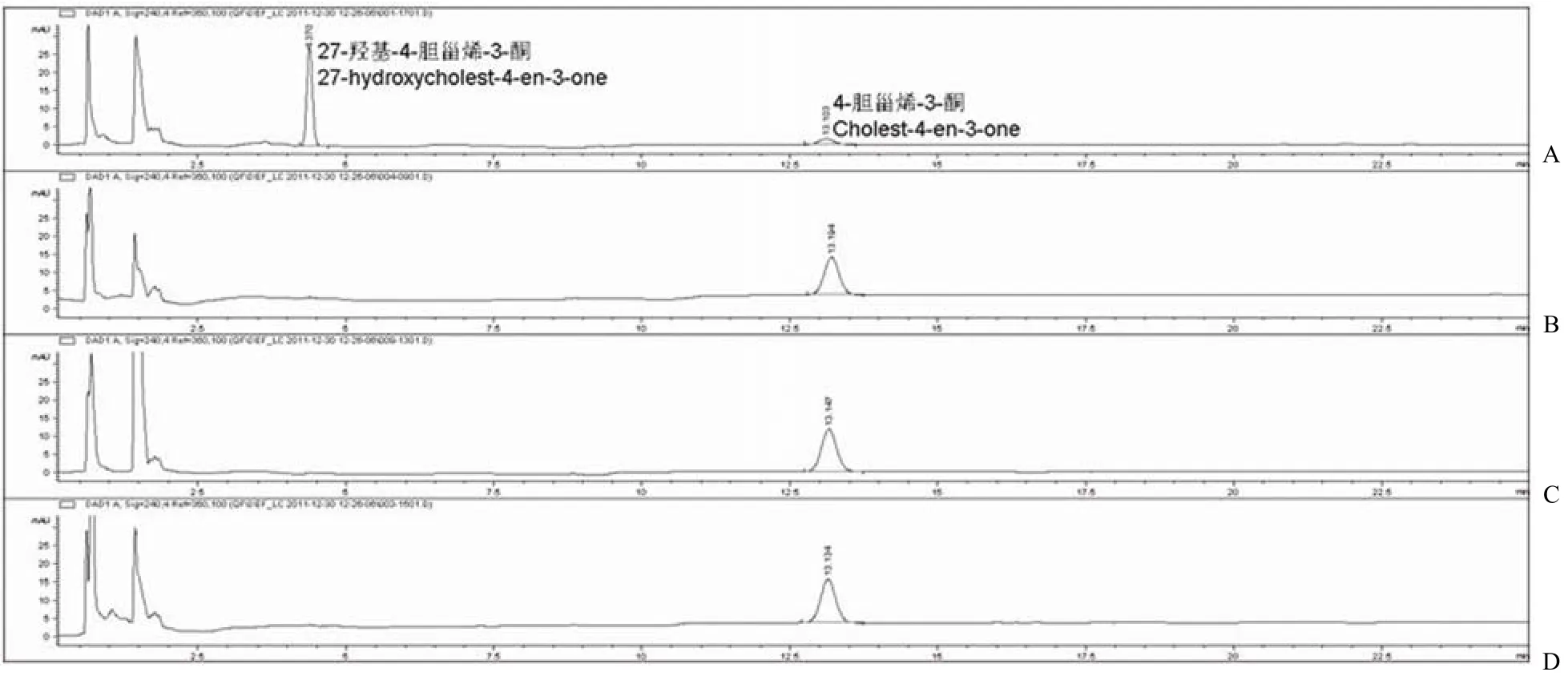
图 5 高效液相色谱法分析 FdrA 对 CYP125A1 电子传递作用(A:阳性对照 spFDR/spFDX;B:实验组 FdrA/Fdx;C:实验组 FdrA/spFDX;D:阴性对照)Figure 5 HPLC/UV analyzes the role of FdrA in CYP125A1’s electron transport chain (A: Positive control spFDR/spFDX; B: FdrA/Fdx; C: FdrA/spFDX; D: Negative control)
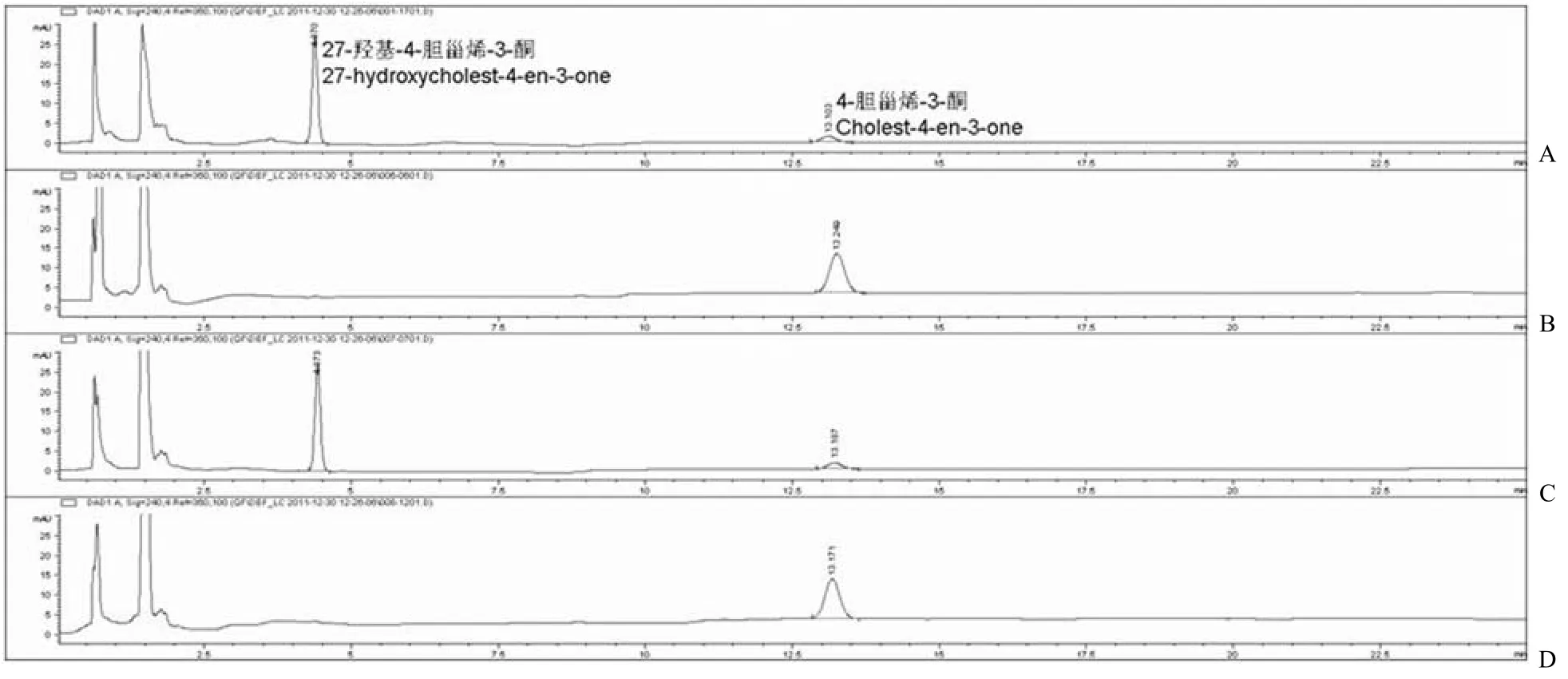
图 6 高效液相色谱法分析 FprA 对 CYP125A1 电子传递作用(A:阳性对照 spFDR/spFDX;B:实验组 FprA/Fdx;C:实验组 FprA/spFDX;D:阴性对照)Figure 6 HPLC/UV analyzes the role of FprA in CYP125A1’s electron transport chain (A: Positive control spFDR/spFDX; B: FprA/Fdx; C: FprA/spFDX; D: Negative control)
3 讨论
本研究表明,在体外环境下 FdrA 更倾向于利用 NADH,NAD+和 NADP+对其活性没有抑制作用;FprA 则倾向于利用 NADPH。采用细胞色素 C 作为电子受体时,FdrA 对 NADH 的Km值明显低于以 DCPIP 为电子受体时的Km 值,说明 FdrA 与细胞色素 C 偶联时,可以使得 FdrA 对 NADH 具有更高的亲和力。FprA 对 NADH 的Km 值与以 DCPIP 为电子受体时Km 值相当,说明 FprA 与细胞色素 C 偶联不会改变其对NADH 的亲和力;但是 FprA 降解 DCPIP 时受到NADP+的抑制,降解细胞色素 C 时却不会受到NADP+的抑制作用,因此推测与细胞色素 C 的偶联使得 FprA 对 NADP+的亲和力明显下降,从而使得反应的方向更容易朝着 NADPH 到 NADP+的方向进行。
采用细胞色素 C 作为电子受体时,FDX 的存在不会影响 FdrA 对 NADH 的 Km 值;在 Fdx介导下,FdrA 对 NADH 的Kcat 值明显大于没有FDX 时的 Kcat 值,说明 Fdx 存在时 FdrA 的催化效率明显升高,Fdx 可以与 FdrA 进行偶联;在spFDX 介导下,FdrA 对 NADH 的 Kcat 值与没有FDX 时相当,说明 FdrA 与 spFDX 不存在偶联。在 Fdx 或 spFDX 介导下,FprA 对 NAD(P)H 的Kcat 值明显大于没有 FDX 时的 Kcat 值,说明Fdx 或 spFDX 存在时 FprA 的催化效率明显升高,Fdx、spFDX 与 FprA 均可以进行偶联,但是spFDX 对 FprA 催化效率的提升没有 Fdx 明显。
FdrA 与 FprA 对 CYP125A1 的电子传递作用研究发现,仅 FprA/spFDX 可以支持 CYP125A1的活性,FdrA/Fdx、FdrA/spFDX 和 FprA/Fdx 均不能支持 CYP125A1 的活性。因此推测 FprA 可能是 CYP125A1 的电子传递链蛋白;FdrA 和 Fdx不是 CYP125A1 的电子传递链蛋白。
总之,我们系统评价了结核分枝杆菌铁氧还蛋白还原酶 FdrA 和 FprA 的活性,并首次发现FprA 可以作为 CYP125A1 的电子传递链蛋白,从而进一步明确了 CYP125A1 在体内的生理功能,并为建立以 CYP125A1 催化系统作为药物靶点的体外药物筛选体系提供依据。
[1] Cole ST, Brosch R, Parkhill J, et al. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. Nature, 1998, 393(6685):537-544.
[2] Ouellet H, Johnston JB, Ortiz de Montellano PR. The Mycobacterium tuberculosis cytochrome P450 system. Arch Biochem Biophys, 2010, 493(1):82-95.
[3] Belin P, Le Du MH, Fielding A, et al. Identification and structural basis of the reaction catalyzed by CYP121, an essential cytochrome P450 in Mycobacterium tuberculosis. Proc Natl Acad Sci U S A, 2009, 106(18):7426-7431.
[4] Sassetti CM, Rubin EJ. Genetic requirements for mycobacterial survival during infection. Proc Natl Acad Sci U S A, 2003, 100(22): 12989-12994.
[5] Capyk JK, Kalscheuer R, Stewart GR, et al. Mycobacterial cytochrome p450 125 (cyp125) catalyzes the terminal hydroxylation of c27 steroids. J Biol Chem, 2009, 284(51):35534-35542.
[6] McLean KJ, Lafite P, Levy C, et al. The Structure of Mycobacterium tuberculosis CYP125: molecular basis for cholesterol binding in a P450 needed for host infection. J Biol Chem, 2009, 284(51):35524-35533.
[7] Driscoll MD, McLean KJ, Levy C, et al. Structural and biochemical characterization of Mycobacterium tuberculosis CYP142: evidence for multiple cholesterol 27-hydroxylase activities in a human pathogen. J Biol Chem, 2010, 285(49):38270-38282.
[8] Johnston JB, Ouellet H, Ortiz de Montellano PR. Functional redundancy of steroid C26-monooxygenase activity in Mycobacterium tuberculosis revealed by biochemical and genetic analyses. J Biol Chem, 2010, 285(47):36352-36360.
[9] Sevrioukova IF, Poulos TL. Structural biology of redox partner interactions in P450cam monooxygenase: a fresh look at an old system. Arch Biochem Biophys, 2011, 507(1):66-74.
[10] Zanno A, Kwiatkowski N, Vaz AD, et al. MT FdR: a ferredoxin reductase from M. tuberculosis that couples to MT CYP51. Biochim Biophys Acta, 2005, 1707(2-3):157-169.
[11] Bellamine A, Mangla AT, Nes WD, et al. Characterization and catalytic properties of the sterol 14alpha-demethylase from Mycobacterium tuberculosis. Proc Natl Acad Sci U S A, 1999, 96(16): 8937-8942.
[12] McLean KJ, Scrutton NS, Munro AW. Kinetic, spectroscopic and thermodynamic characterization of the Mycobacterium tuberculosis adrenodoxin reductase homologue FprA. Biochem J, 2003, 372(Pt 2): 317-327.
[13] Fischer F, Raimondi D, Aliverti A, et al. Mycobacterium tuberculosis FprA, a novel bacterial NADPH-ferredoxin reductase. Eur J Biochem, 2002, 269(12):3005-3013.
[14] Ouellet H, Guan S, Johnston JB, et al. Mycobacterium tuberculosis CYP125A1, a steroid C27 monooxygenase that detoxifies intracellularly generated cholest-4-en-3-one. Mol Microbiol, 2010, 77(3):730-742.
Analysis of the role of FdrA and FprA in CYP125A1’s electron transfer chain, two ferredoxin reductases in mycobacterium tuberculosis
QIAO Feng, ZHANG Jian-mei, BAI Yin-lei, YANG Xin-yi, LI Cong-ran, LI Guo-qing, HU Xin-xin , YOU Xue-fu
ObjectiveTo systematically evaluate the activities of two FDRs (FdrA and FprA), study the interactions between these two FDRs and two ferredoxins, respectively, and analyze the endogenous redox partners of CYP125A1 in vitro.MethodsThe cloned genes were ligated to pET-30a(+) vector and transformed into E.coli BL21 DE3 cells separately. Recombinant proteins were generated by IPTG inducing, followed by affinity purification in Ni column. The activities of FdrA and FprA were evaluated in multilabel reader in the presence of NAD(P)H as the electron donor and DCPIP as the acceptor; the coupling activitiesof FDR and FDX were analyzed in the presence of cytochrome C as the electron acceptor; the activity of CYP125A1 which was supported by FdrA or FprA was evaluated by HPLC.ResultsFdrA preferentially binded NADH and Fdx could increase its activity significantly while spinach ferredoxin (spFDX) didn’t change its activity. The activity of CYP125A1 couldn’t be supported by FdrA/Fdx or FdrA/spFDX. FprA preferentially binded NADPH and Fdx or spFDX increased its activity significantly, besides, Fdx had more potent effect. However, only FprA/spFDX could support the activity of CYP125A1.ConclusionFprA is one of electron transport chain complex proteins of CYP125A1 and FdrA may not be the redox partner of CYP125A1.
Mycobacterium tuberculosis; Ferredoxin reductase; Cytochrome P-450 enzyme system; Electron transport chain complex proteins
YOU Xue-fu, Email: xuefuyou@hotmail.com
10.3969/cmba.j.issn.1673-713X.2012.03.004
“十二五”国家科技重大专项(2012ZX09301002-005、2012ZX09301002-001)
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所药理室
游雪甫,Email:xuefuyou@hotmail.com
2012-02-28
方法采用大肠杆菌作为宿主克隆结核分枝杆菌 FdrA、FprA 和 CYP125A1 编码基因并进行蛋白外源表达;以NADH 或 NADPH 为电子供体,2,6-二氯酚靛酚(DCPIP)为电子受体评价 FdrA 及 FprA 的活性;应用细胞色素C 为电子受体研究 FdrA 或 FprA 与不同铁氧还蛋白的偶联作用;分析 CYP125A1 对 4-胆甾烯-3-酮的代谢作用进而研究 FdrA 和 FprA 在 CYP125A1 的电子传递链中的作用。
结果FdrA 对 NADH 亲和力较高,Fdx 对 FdrA 活性有明显提升作用,菠菜铁氧还蛋白(spFDX)对其活性没有提升作用,FdrA/Fdx 和 FdrA/spFDX 均不能支持 CYP125A1的活性。FprA 对 NAPDH 亲和力较高,Fdx 和 spFDX 均对 FprA 活性有明显提升作用,Fdx 尤甚,FprA/spFDX 可以支持 CYP125A1 的活性,FprA/Fdx 不能支持 CYP125A1的活性。
结论FprA 是结核分枝杆菌 CYP125A1 的电子传递链蛋白,FdrA 可能不是 CYP125A1 的电子传递链蛋白。
Author Affiliation:Department of Pharmacology, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
www.cmbp.net.cn Chin Med Biotechnol, 2012, 7(3):178-186

