明串珠菌的基因研究进展
成文玉,金红星*
(河北工业大学 化工学院,天津 300130)
明串珠菌(Leuconostoc)是异型乳酸发酵的革兰氏阳性细菌[1],产生乳酸、乙酸、乙醇、CO2以及双乙酰、乙偶姻和C4化合物等芳香化合物[2]。明串珠菌也是韩国泡菜(kimchi,即朝鲜民族的传统食品)、德国泡菜和腌菜等发酵蔬菜中的优势细菌,保持这些产品的质量中起着重要作用[3-6]。在风味酸奶、发酵奶油、干酪、Kefir乳(牛奶乳)的生产中均要利用明串珠菌,因此近年来在内地对其的研究开始活跃[7]。
在国外明串珠菌的研究热点主要在于葡聚糖,进入21世纪以来关于明串珠菌基因的研究主要集中在韩国[8-16]。
明串珠菌在食品和医药工业中具有如下应用:形成干酪孔眼(提高产品质量)、生成风味物质(比如双乙酰)、益生菌、生成葡聚糖(制造凝胶过滤产品,可以作为血液舒展剂、增稠剂和稳定剂)、生成甘露醇(低热量的甜味剂、理想的赋形剂等食品、医药、轻工和化工上的广泛应用)、水解α-半乳糖苷(拓宽高营养食品的选择范围)、代谢产生细菌素(生物防腐剂)、生成低聚糖(促进肠胃中的益生菌增殖、抑制肠道中的病原菌生长繁殖、促进肠胃蠕动和改善加工食品的特性)等[7]。
在基因工程中明串珠菌可以应用于3个方面:(1)明串珠菌的有用蛋白质基因在大肠杆菌或酵母中进行表达,(2)将明串珠菌作为受体菌,其他生物的蛋白质基因在明串珠菌中进行异源表达,(3)为了获得高产菌株,对明串珠菌的染色体进行改造。
1 明串珠菌基因的克隆与表达
在国外对明串珠菌基因的克隆与应用较多,涉及到多种基因,大部分以E.coli作为受体菌。HEE KYONG KANG等[17]在毕赤酵母中重组表达了肠膜明串珠菌的果聚糖蔗糖酶基因,而在E.coli中重组表达了肠膜明串珠菌的蔗糖磷酸化酶基因[18]。CÔTÉ GL等[19-20]克隆了明串珠菌的葡聚糖蔗糖酶基因,并在E.coli中进行了表达。LEE JM等[21-22]克隆了肠膜明串珠菌的乙醇/乙醛脱氢酶和磷酸酮醇酶基因,并在E.coli中进行了表达。HAHN G等[23]克隆了甘露醇脱氢酶基因。NIKEL PI等[24]将肠膜明串珠菌的乙醇/乙醛脱氢酶基因导入到E.coli中,并通过E.coli的发酵把甘油转化为乙醇了。HEUSER F等[25]在E.coli(同时重组表达甘露醇脱氢酶和甲酸脱氢酶)中表达假肠膜明串珠菌的果糖透性酶基因而提高了甘露醇的产率20%。
在内地对明串珠菌基因的研究大部分集中在葡聚糖蔗糖酶基因的应用上。发酵生产葡聚糖时,菌体与产物分离困难、产物分子大小难以控制、杂质比较多,而固定化酶法生产葡聚糖可以克服这些不足。用肠膜明串珠菌发酵生产葡聚糖蔗糖酶时,酶的活性较低,使酶的分离纯化带来困难。因此,农万廷等[26-28]克隆了肠膜明串珠菌葡聚糖蔗糖酶基因,并在E.coli中进行了表达;邵彦春等[29]在毕赤酵母中表达了葡聚糖蔗糖酶。隋姗姗等[30]从酶活力高的肠膜明串珠菌中克隆了蔗糖磷酸化酶基因,并在E.coli中构建了原核表达系统,从而获得了稳定好的工程菌株。
一般以总DNA为模板进行PCR扩增而克隆目的基因,因此需要提取明串珠菌的总DNA。提取总DNA的方法是由乳杆菌的方法改进而来的,肽聚糖细胞壁较厚从而破细胞困难,因此溶菌酶与SDS联合使用,有时培养菌体的培养基中加入细胞壁弱化剂甘氨酸[31],还有蛋白难以去除,故使用蛋白酶K。
2 明串珠菌作为受体菌
在食品生物技术中明串珠菌是表达不同蛋白的很好的候选菌,因为其具有下列4个特性[32]:(1)是美国FDA认可的GRAS(generally recognized as safe,一般认为安全);(2)不产生内毒素;(3)在好氧还是厌氧条件下都生长很好;(4)能分泌特异性胞外蛋白(如葡聚糖蔗糖酶)且没有降解蛋白活性。明串珠菌具有很好的分泌功能,是因为在基因组中存在信号肽(signal peptide)基因序列。
载体和转化方法是明串珠菌的基因工程研究中非常关键的2个因子。
2.1 载体
载体为外源基因提供复制能力或整合能力。明串珠菌的基因研究中使用的载体有穿梭载体和转座子2种。
(1)穿梭载体:明串珠菌的转基因研究中,一般以质粒为基础构建明串珠菌和E.coli之间穿梭的载体,属于复制型载体。为了构建适用于明串珠菌遗传转化的食品级载体,JI YOON CHANG等[33-34]对明串珠菌的隐蔽质粒进行了特性研究。质粒的复制类型(复制起点,ori)主要有RCR(滚环复制)型和θ型,质粒pCC3[33]、pFMBL1[34]和pTXL1[35]属于θ型,质粒pCB18[36]、pIH01[37]、pFR18[38]和pCI411[39]属于RCR型。摄取过多的D-乳酸对人体健康有不利的影响,为了降低韩国泡菜中的D-乳酸含量,QIN JIN等[40]以穿梭载体pLeuCM为基础构建成重组质粒,将L-乳酸脱氢酶基因导入到明串珠菌中使之产生L-乳酸,结果表明产生了大量的L-乳酸,但乳酸的总量没有发生变化。
(2)转座子:HYUN-JU EOM等[41]利用病毒的转座子(属于整合型载体)和转座酶,将氯霉素抗性基因(cat,氯霉素乙酰转移酶)随机地整合插入到L.mesenteroidesDRC染色体DNA上,避开了重组质粒的分离不稳定性,从而建立了遗传上稳定的肠膜明串珠菌。
2.2 转化方法
将外源DNA导入到完整明串珠菌受体细胞的方法是基于物理学和生物学原理建立起来的,是细菌接合转移和电击转化。
(1)细菌接合转移:接合(Conjugation)是指通过细菌细胞之间的直接接触导致DNA从一个细胞转移至另一个细胞的过程。这个过程是由接合型质粒完成的,其通常具有促进供体细胞与受体细胞有效接触的接合功能以及诱导DNA分子传递的转移功能,两者均由接合型质粒上的有关基因编码。在DNA重组中常用的绝大多数载体质粒缺少接合功能区,因此不能直接通过细胞接合方法转化受体细胞,然而如果在同一个细胞中存在着一个含有接合功能区域的辅助质粒,则有些克隆载体质粒便能有效地接合转化受体细胞。因此,首先将具有接合功能的辅助质粒转移至含有重组质粒的细胞中,然后将这种供体细胞与难以用上述转化方法转化的受体细胞进行混合,促使两者发生接合作用,最终导致重组质粒进入受体细胞。
明串珠菌的转基因研究早期利用接合质粒[42-45]进行的。TASI HJ等[44-45]利用接合质粒把产nisin和发酵乳糖的基因分别从乳酸链球菌转移到明串珠菌中,并进行了成功表达。
(2)电击转化:绝大多数乳酸细菌的原生质体难以再生,因此外源DNA的转化大都采用电击法。把DNA引入细菌的电击技术[46]的发展极大地便利了重组DNA分子的转化,尤其是在乳酸细菌中如此。电击转化法(Electroporation)有称电穿孔法,细胞膜的基本成分是磷脂双分子层,高压放电产生的脉冲使细胞膜产生可逆的“微孔”,外源DNA大分子通过这个瞬间的“通道”进入细胞。移去外加电压后,膜孔在一定时间内可以自动修复,这为外源基因的导入创造了条件。利用这一原理,将细菌细胞与外源基因组合置于电击转化仪的样品小室中,然后在一定的电压条件下进行短时间(数μs)直流电脉冲,电击后的细胞被转至培养基中培养,筛选并诱导细胞的分化。目前使用的电击仪器种类虽然较多,但按输出电脉冲的方式大致可分为2类:一类以指数波形式输出,一类以方波形式输出。
明串珠菌的电击转化一般都是基于乳杆菌和乳球菌的电转化方法而改良的。JB LUCHANSK等[47]最早以电击法转化了明串珠菌。荷兰乳品研究所的SILKE DAVID等[48]利用电击转化法将乳酸乳球菌的磷酸-β-半乳糖苷酶基因导入明串珠菌中,首次获得了成功表达。电转化的流程:过夜培养(稳定生长前期)→转接后培养3h~4h(对数生长前期)→洗涤细胞→用电转缓冲液悬浮菌体→电击转化→加入培养基后于30℃孵育→涂布在平板上培养而筛选重组子。电击转化所用的溶液、离心机转子、离心管和电击杯都要预冷,在所有的步骤中细胞都维持冷藏温度。电击转化的影响因子见表1,从表1可知,电击缓冲液中都含有渗透稳定剂—蔗糖,而且还含有除去细胞壁外多聚糖的MgCl2(除了金正焕和Jensen外),一般在对数生长前期收集菌体并进行浓缩。
2.3 筛选标记
无论何种类型的载体都必须带有一个有效的筛选标记确保转化子的检出。明串珠菌的基因工程中已经使用过的筛选标记有氯霉素[40-41,53,55]、红霉素[51,53,56]和四环素[53]等抗生素抗性。如果将抗生素抗性基因投放到环境中或人和动物体内,由于抗性因子的转移,将带来生物安全性的严重后果。为了防止使用抗生素抗性标记所引起的危害,最有效的办法是用安全的食品级标记替代抗生素抗性标记以建立食品级选择性标记的载体。
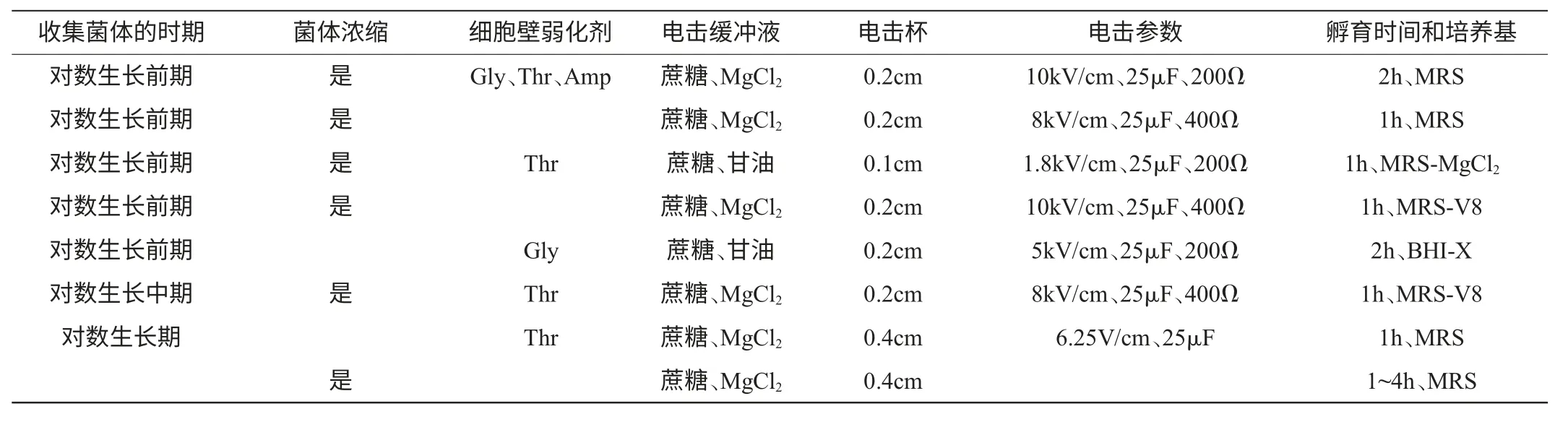
表1 明串珠菌电击转化的影响因素[47-54]Table 1.Factors affecting the electroporation of Leuconostoc species
SEON-JU JEONG等[51,55]将α-淀粉酶基因导入到柠檬明串珠菌中,重组质粒以附加体的形式存在于胞质中,并获得了成功表达。因此,可以将α-淀粉酶基因的表达盒连接到相关的质粒上,构建出携带糖类利用标记的表达载体,从而开发出载体、受体及诱导物均为食品级的表达系统,食品级的明串珠菌工程菌可直接应用于食品工业和医药保健等领域,有着巨大的应用前景和潜在的商业价值。
另外、绿色荧光蛋白也可以作为筛选标记。KWANHOONLEE等[57]由p32强启动子、假植物乳杆菌质粒pC7复制子和绿色荧光蛋白(GFP)构建了pCW5载体,并转化明串珠菌,成功表达了绿色荧光蛋白,且由Western杂交和共聚焦显微镜检查而得到证实。
3 明串珠菌染色体的改造
培养基含有蔗糖时明串珠菌发酵产生葡聚糖,从而降低韩国泡菜的品质。为了改善韩国泡菜的风味,HYUN-JU EOM等[58]构建了有效的基因敲除系统,并获得了钝化葡聚糖蔗糖酶(蔗糖-6-葡糖基转移酶)活性的菌株。
4 基因组研究
明串珠菌属中已经完成全基因组测序的有9个物种、L.kimchii的2个菌株、肠膜明串珠菌的2个亚种,见表2。从表2可以看出,基因组大小大部分为2Mb左右,蛋白质基因的数量为大约2000个,具有1个或几个rRNA操纵子。测序工作大部分由韩国人完成的,因为明串珠菌是韩国泡菜的发酵中起重要作用的乳酸细菌,所以国家非常重视。
5 展望
(1)如今很多基因的功能注释是通过生物信息学软件的比对结果而产生的。明串珠菌属的每个物种中还有不少基因的功能未知,有待于由实验手段来完成,比如采用基因敲除方法、细菌双杂交系统。通过基因敲除使某基因失活而产生突变菌株,并与野生菌株的性状相比较,从而揭示基因的作用。但经内源性同源重组而产生基因敲除的几率偏低,因此工作量很大。由于外源性同源重组而基因被敲除的概率较高,有利于研究进程的加速,但必须构建相关的系统才能进行基因操作。

表2 明串珠菌属中已完成全基因组测序的物种[8-16,59]Table 2.Completed genomes of Leuconostoc species
(2)将明串珠菌作为受体菌进行了一些转基因方面的探索,但不像E.coli、乳杆菌和乳球菌等细菌那样,受体-载体系统还很不完善,还处于研究的起步阶段,有待于深入研究。构建以非抗生素抗性为标记和选择压力的“可食性”明串珠菌表达系统就显得十分必要。
[1]Hong-Ui Han.Kimchi,伟大的遗产(韩文)[M].韩国首尔:hanul publishing company,2006:1.
[2]COGAN TM,JORDAN KN.Metabolism ofLeuconostocbacteria[J].J Dairy Sci,1994,77(9):2704-2717.
[3]EOM HJ,SEO DM,HAN NS.Selection of psychrotrophicLeuconostocspp.producing highly active dextransucrase from lactate fermented vegetables[J].Int J Food Microbiol,2007,117(1):61-67.
[4]HAN NS,JUNG YS,EOM HJ,et al.Simultaneous biocatalytic synthesis of panose during lactate fermentation in kimchi[J].J Microbiol Biot,2002,12(1):46-52.
[5]JOHANNINGSMEIER SD,FLEMING HP,BREIDT F JR.Malolactic activity of lactic acid bacteria during sauerkraut fermentation[J].J Food Sci,2004,69(8):222-227.
[6]TAMMINEN M,JOUTSJOKI T,SJÖBLOM M,et al.Screening of lactic acid bacteria from fermented vegetables by carbohydrate prowling and PCR-ELISA[J].Lett Appl Microbiol,2004,39(5):439-444.
[7]成文玉,金红星,胡炎华,等.明串珠菌筛选与分类的研究进展[J].中国酿造,2010(3):7-9.
[8]HYUN-MYUNG OH,YONG-JOON CHO,BYUNG KWON KIM,et al.Complete genome sequence analysis ofLeuconostoc kimchiiIMSNU 11154[J].J Bacteriol,2010,192(14):3844-3845.
[9]JIHYUN F.KIM,HAEYOUNG JEONG,JUNG-SOOK LEE,et al.Complete genome sequence ofLeuconostoc citreumKM20 [J].J Bacteriol,2008,190(8):3093-3094.
[10]SEONG-HYEUK NAM,SANG-HAENG CHOI,HONG-SEOG PARK,et al.Genome Sequence ofLeuconostoc argentinumKCTC 3773[J].J Bacteriol,2010,192(24):6490-6491.
[11]SEONG-HYEUK NAM,SANG-HAENG CHOI,HONG-SEOG PARK,et al.Genome sequence ofLeuconostoc fallaxKCTC 3537[J].J Bacteriol,2011,193(2):588-589.
[12]DAE-SOO KIM,SANG-HAENG CHOI,HONG-SEOG PARK,et al.Genome sequence ofLeuconostoc gelidumKCTC 3527 isolated from kimchi[J].J Bacteriol,2011,193(3):799-800.
[13]DAE-SOO KIM,SANG-HAENG CHOI,HONG-SEOG PARK,et al.Genome sequence ofLeuconostoc inhaeKCTC 3774,isolated from kimchi[J].J Bacteriol,2011,193(5):1278-1279.
[14]DONG-WOOK KIM,SANG-HAENG CHOI,HONG-SEOG PARK,et al.Genome sequence ofLeuconostoc pseudomesenteroidesKCTC 3652[J].J Bacteriol,2011,193(16):4299.
[15]SEUNG HYEON LEE,JI YOUNG JUNG,CHE OK JEON,et al.Complete genome sequence ofLeuconostoc kimchiistrain C2,isolated from kimchi[J].J Bacteriol,2011,193(19):5548.
[16]SEONG-HYEUK NAM,AERI KIM,HONG-SEOG PARK,et al.Genome sequence ofLeuconostoc carnosumKCTC 3525[J].J Bacteriol,2011,193(21):6100-6101.
[17]HEE KYOUNG KANG,SANG IL YUN,DOMAN KIM,et al.Cloning of levansucrase fromLeuconostoc mesenteroidesand its expression inPichia pastoris[J].Food Sci Biot,2011,20(1):277-281.
[18]JIN-HA LEE,YOUNG-HWAN MOON,DOMAN KIM,et al.Cloning and expression of the sucrose phosphorylase gene fromLeuconostoc mesenteroidesinEscherichia coli[J].Biotechnol Lett,2008,30:749-754.
[19]CÔTÉ G L,SKORY C D.Cloning,expression,and characterization of an insoluble glucan-producing glucansucrase fromLeuconostoc mesenteroidesNRRL B-1118[J].Appl Microbiol Biot.
[20]R FRAGA VIDAL,MOULIS C,MONSAN P,et al.Isolation of a gene fromLeuconostoc citreumB/110-1-2 encoding a novel dextransucrase enzyme[J].Curr Microbiol,2011,62Ł1260-1266.
[21]JUNG MIN LEE,DO-WON JEONG,HYONG JOO LEE,et al.Cloning and characterization of the gene encoding phosphoketolase inLeuconostoc mesenteroidesisolated from kimchi[J].Biotechnol Lett,2005,27:853-858.
[22]OK KYUNG KOO,DO-WON JEONG,HYONG JOO LEE,et al.Cloning and characterization of the bifunctional alcohol/acetaldehyde dehydrogenase gene(adhE)inLeuconostoc mesenteroidesisolated from kimchi[J].Biotechnol Lett,2005,27:505-510.
[23]HAHN G,KAUP B,BRINGER-MEYER S,et al.A zinc-containing mannitol-2-dehydrogenase from Leuconostoc pseudomesenteroides ATCC 12291:purification of the enzyme and cloning of the gene[J].Arch Microbiol,2003,179:101-107.
[24]NIKEL P I,RAMIREZ M C,PETTINARI M J,et al.Ethanol synthesis from glycerol byEscherichia coliredox mutants expressingadhEfromLeuconostoc mesenteroides[J].J Appl Microb,2010,109(2):492-504.
[25]HEUSER F,MARIN K,BRINGER S,et al.Improving D-mannitol productivity ofEscherichia coli:Impact of NAD,CO2and expression of a putative sugar permease fromLeuconostoc pseudomesenteroides[J].Metab Eng,2009,11:178-183.
[26]农万廷,韦宇拓,黄日波.肠膜明串珠菌葡聚糖蔗糖酶基因的克隆与表达[J].工业微生物,2007,37(3):29-32.
[27]王雅洁.重组大肠杆菌右旋糖酐蔗糖酶表达条件优化及其催化合成右旋糖酐的研究[D].合肥:合肥工业大学,2009.
[28]罗 靳.细菌右旋糖苷蔗糖酶基因的克隆与表达[D].北京:中国农科院,2007.
[29]邵彦春,王建华,滕 达,等.右旋糖苷蔗糖酶基因的克隆及其序列分析[J].微生物学通报,2005,32(3):20-23.
[30]隋姗姗,马江锋,姜 岷,等.肠膜明串珠菌蔗糖磷酸化酶基因在大肠杆菌中的[J].生物技术通报,2011(5):157-161.
[31]JEONGHO KIM,JONGSIK CHUN,HONG-UI HAN.Leuconostoc kimchiisp.nov.,a new species from kimchi[J].Int J Syst Evol Micr,2000,50(5):1915-1919.
[32]HEMME D,FOUCAUD-SCHEUNMANN C.Leuconostoc,characteristics,use in dairy technology and prospects in functional foods[J].Int Dairy J,2004,14(6):467-494.
[33]JI YOON CHANG,HAE CHOON CHANG.Identification of a replicon from pCC3,a cryptic plasmid fromLeuconostoc citreumC4 derived from kimchi,and development of a new host-vector system [J].Biotechnol Lett,2009,31:685-696.
[34]SEON-JU JEONG,JAE-YONG PARK,JEONG HWAN KIM,et al.Characterization of pFMBL1,a small cryptic plasmid isolated fromLeuconostoc mesenteroidesSY2[J].Plasmid,2007,57:314-323.
[35]FRANCK BIET,YVES CENATIEMPO,CHRISTOPHE FREMAUX.Identification of a replicon from pTXL1,a small cryptic plasmid fromLeuconostoc mesenteroidessubsp.mesenteroidesY110,and development of a food-grade vector[J].Appl Environ Microb,2002,68(12):6451-6456.
[36]HYUN-JU EOM,SEUNG KEE CHO,NAM SOO HAN,et al.Characterization ofLeuconostoc citreumplasmid pCB18 and development of broad host range shuttle vector for lactic acid bacteria[J].Biotech Biopr Eng,2010,15:946-952.
[37]JUNGHYUN PARK,MIHYE LEE,JEONGHO KIM,et al.pIH01,a small cryptic plasmid fromLeuconostoc citreumIH3[J].Plasmid,2005,54:184-189.
[38]FRANCK BIET A,YVES CENATIEMPO,CHRISTOPHE FREMAUX.Characterization of pFR18,a small cryptic plasmid fromLeuconostoc mesenteroidesssp.mesenteroidesFR52,and its use as a food grade vector[J].FEMS Microbiol Lett,1999,179:375-383.
[39]AIDAN COFFEY,AIDAN HARRINGTON,GERALD FITZGERALD,et al.Nucleotide sequence and structural organization of the small,broad-host-range plasmid pCI411 fromLeuconostoc lactis533[J].Microbiology,1994,140:2263-2269.
[40]QING JIN,JEE YUN JUNG,NAM SOO HAN,et al.Production of l-lactate inLeuconostoc citreumvia heterologous expression of l-lactate dehydrogenase gene[J].J Biotechnol,2009,144(2):160-164.
[41]HYUN-JU EOM,JOONG MIN PARK,NAM SOO HAN,et al.Monitoring ofLeuconostoc mesenteroidesDRC starter in fermented vegetable by random integration of chloramphenicol acetyltransferase gene[J].J Ind Microbiol Biot,2008,35(9):953-959.
[42]Pucci M J,M E Mouteschio,and C L Kemker.Intergeneric and intrageneric conjugal transfer of plasmid-encoded antibiotic resistance determinance inLeuconostoc[J].Appl Environ Microb,1988,54(2):281-287.
[43]DESSART S A,STEENSON I R.High frequency intergeneric and lntrageneric conjugal transfer of drug resistance plasmids inLeuconostoc mesenteroidesssp.cremoris[J].J Dairy Sci,1991,74(9):2912-2919.
[44]TSAI H J,SANDINE W E..Conjugal transfer of nisin plasmid genes fromStreptococcus lactistoLeuconostoc dextranicus181[J].Appl Environ Microb,1987,53(2):352-357.
[45]TSAI H J,SANDINE W E.Conjugal transfer of lactose-fermenting ability fromS.lactisC2 toLeuconostoc cremorisCAF7 yieldsLeuconostocthat ferment lactose and produce diacetyl [J].J Ind Microbiol,1987,2(1):25-33.
[46]FIEDLER.S,WIRTH R.Transformation of bacteria with plasmid DNA by electroporation[J].Anal Biochem,1988,170(1):33-44.
[47]JB LUCHANSKY,P M MURIANA,T R KLAENHAMMER.Application of electroporation for transfer of plasmid DNA toLactobacillus,Lactococcus,Leuconostoc,Listeria,Pediococcus,Bacillus,Staphylo-coccus,EnterococcusandPropionibacterium[J].Mol Microb,1988,2(5):637-646
[48]SILKE DAVID,GUUS SIMONS,WILLEM M DE VOS.Plasmid transformation by electroporation ofLeuconostoc paramesenteroidesand its use in molecular cloning[J].Appl Environ Microb,1989,55(6):1483-1489.
[49]曹晓梅,张虎成,陈 薇,等.乳杆菌电转化的研究进展[J].军事医学科学院院刊,2008,32(6):590-593.
[50]HYUN-JU EOM,JOONG MIN PARK,NAM SOO HAN,et al.Monitoring ofLeuconostoc mesenteroidesDRC starter in fermented vegetable by random integration of chloramphenicol acetyltransferase gene[J].J Ind Microb Biot,2008,35(9):953-959.
[51]SEON-JU JEONG,JAE-YONG PARK,JEONG HWAN KIM,et al.Transformation ofLeuconostoc mesenteroidesSY1,a strain isolated from Kimchi[J].J Microbiol Biot,2006,16(1):149-152.
[52]TIMOTHY D LEATHERS,JAMES D JONES,HERB A WYCKOFF.Transformation of alternan-producing strains ofLeuconostocby electroporation[J].Biotechnol Lett,2004,26(14):1119-1124.
[53]SØREN HELMARK,METTE E HANSEN,PETER R JENSEN,et al.Transformation ofLeuconostoc carnosum4010 and evidence for natural competence of the organism[J].Appl Environ Microb,2004,70(6):3695-3699.
[54]HERB A WYCKOFF.W E SANDINE.Transformation of DairyLeuconostocusing plasmid vectors fromBacillis,Escherichia,andLactococcus hosts[J].J Dairy Sci,1991,74(5):1454-1460.
[55]HYUN-JU EOM,JIN-SEOK MOON,NAM SOO HAN,et al.Heterologous expression and secretion ofLactobacillus amylovorusα-amylase inLeuconostoc citreum[J].Biotechnol Lett,2009,31(11):1783-1788.
[56]PARK JAE-YONG,SEON-JU JEONG,JEONG HWAN KIM,et al.Expression of α-galactosidase gene fromLeuconostoc mesenteroidesSY1 inLeuconostoc citreum[J].J Microbiol Biot,2007,17(12):2081-2084.
[57]KWAN-HOON LEE,WOO-JUNG PARK,DAE-KYUN CHUNG,et al.Development of a monitoring vector forLeuconostoc mesenteroidesusing the green fluorescent protein gene[J].J Microbiol Biot,2007,17(7):1213-1216
[58]HYUN-JU EOM,QING JIN,NAM SOO HAN,et al.Development of gene expression/knock-out system for genetic engineering ofLeuconostoc Citreum[J].J Biotechnol,2008,136S:S345-S355
[59]PER JOHANSSON,LARS PAULIN,K JOHANNA BJ?RKROTH,et al.Genome sequence of a food spoilage lactic acid bacterium,Leuconostoc gasicomitatumLMG 18811T,in association with specific spoilage reactions[J].Appl Environ Microb,2011,77(13):4344-4351.
