海洋来源真菌Hypocrea virens菌丝体的化学成分研究
刘 涛,李占林,王 宇,田 黎,裴月湖,华会明
(1.中国医科大学药学院,辽宁 沈阳 110001;2.沈阳药科大学 创新药物研究与设计教育部重点实验室,辽宁 沈阳 110016;3.国家海洋局第一海洋研究所,山东 青岛 266061;4.青岛科技大学,山东 青岛 266042)
自20世纪70年代以来,海洋微生物作为一种新药筛选资源,因其代谢产物结构独特、活性显著、易于工业化操作等优势而倍受关注[1],尤其是在抗肿瘤药物领域有着巨大潜力[2]。
为了寻找新的抗肿瘤活性成分,作者对海洋来源真菌Hypocreavirens的菌丝体进行了化学成分研究,共分离得到8个化合物,并对其结构进行了鉴定。
1 实验
1.1 菌株
实验菌株于2007年12月采自广西沙田潮间带正红树(Rhizophoraapiculata)。由国家海洋局第一海洋研究所、青岛科技大学田黎教授鉴定为真菌Hypocreavirens。菌株保存编号:HTTA-Z07723,存放于科技部资助的国家海洋局第一海洋研究所药用海洋微生物菌种资源库。
1.2 试剂与仪器
实验所用试剂为分析纯或色谱纯。
开放ODS柱色谱填料(100 μm),日本YMC公司;Sephadex LH-20,GE healthcare;柱色谱硅胶(200~300目)及薄层色谱硅胶,青岛海洋化工厂;Bruker ARX-300型和AV-600型核磁共振仪;L2130型HPLC(检测器为L2400型),日本HITACHI公司;YMC-Pack ODS-AM:10 mm×250 mm。
1.3 培养基
发酵培养基:燕麦浸汁200 mL,蛋白胨3 g,酵母粉2 g,葡萄糖12 g,NaCl 15 g,MgCl2· 6H2O 1.0 g,KCl 0.1 g,FePO40.01 g,水1000 mL。
1.4 提取分离
取菌株接种于发酵培养基,于25℃、15 r·min-1振荡培养16 d,发酵量60 L。
发酵液经过滤得菌丝体243 g(干重)。菌丝体经反复“冷冻-融化”处理后,用4 BV丙酮提取3次,每次1 h,合并提取液,减压回收溶剂得浸膏97 g。
菌丝体丙酮提取物经硅胶柱色谱,用氯仿-甲醇(100∶0~0∶100)进行梯度洗脱,得到219个流分(每流分800 mL)。
第5流分经重结晶得到化合物Ⅲ(5 mg);第4~11流分合并,经硅胶柱色谱,用石油醚-丙酮(40∶1~0∶100)进行梯度洗脱。第12亚流分经重结晶得到化合物Ⅱ(2 mg)。第58~59亚流分合并,经重结晶得到化合物Ⅵ(5 mg)。第67~72亚流分合并,经开放ODS柱色谱及HPLC进一步处理得到化合物Ⅰ(2 mg)。第84~87亚流分合并,经Sephadex LH-20柱色谱,用氯仿-甲醇(1∶1)进行洗脱,得到化合物Ⅴ(3 mg)。第27~31流分合并,经Sephadex LH-20柱色谱及开放ODS柱色谱得到化合物Ⅳ(6 mg)。第39~43流分合并,经Sephadex LH-20柱色谱,用氯仿-甲醇(1∶1)进行洗脱,得到第14~16亚流分,经开放ODS、Sephadex LH-20及硅胶柱色谱得到化合物Ⅷ(3 mg)。第51~60流分合并,经Sephadex LH-20柱色谱,用氯仿-甲醇(1∶1)进行洗脱,得到第22~28亚流分,经开放ODS及硅胶柱色谱得到化合物Ⅶ(4 mg)。
2 结果与讨论
化合物Ⅰ的NMR数据见表1、化合物Ⅲ~Ⅷ的13CNMR数据见表2。
化合物Ⅰ:白色无定形粉末。1HNMR(300 MHz,CDCl3),δ,ppm:2.31(3H,s),1.08(3H,d,J=6.6 Hz),0.93(3H,d,J=6.8 Hz),0.86(3H,d,J=7.0 Hz),0.82(3H,d,J=7.0 Hz),0.48(3H,s),共6个甲基,提示该化合物可能为麦角甾类。其中2.31(3H,s)不同于一般麦角甾的角甲基,处于较低场,推测为连接在芳环或羰基上的甲基。5.20(1H,m)、5.24(1H,m)应为侧链22、23位双键上的质子信号。6.65(1H,s)推测为芳氢信号。13CNMR(150 MHz,CDCl3),δ,ppm:138.4,136.2,135.5,135.2,133.9,132.4,131.2,124.0,共8个sp2杂化碳信号,其中135.5、132.4为侧链22、23位双键上特征的碳信号。剩余6个碳信号中有5个季碳,推测为芳环的结构,在普通麦角甾骨架中无法得到满足,因此推测该化合物可能为变形的麦角甾类化合物。根据H-12(δH1.71,m和δH2.72,dd,J=8.2 Hz,13.2 Hz)与C-11(δ67.6)、C-9(δ133.9)、C-13(δ45.2)之间的HMBC相关确定了OH-11的取代位置。根据H-1(δH2.82,m;2.90,m)和H-2(δH1.77,m;2.01,m)之间的1H-1H COSY相关,H-3(δH4.21,m)和H-2(δH1.77,m)、H-4(δH3.03,dd)之间的1H-1H COSY相关,以及NOESY谱中H-4(δH3.03,dd)与CH3-19(δH2.31,s)之间存在的相关,确定OH-3的取代位置,见图1。
根据H-4的偶合常数(J=16.8 Hz,8.1 Hz,J=16.8 Hz,5.0 Hz),推测H-3处于直立键(通过搭建分子模型判断并结合生物合成来源),因此OH-3为α构型。H-11(δH5.15,m)与CH3-18(δH0.48,s)的NOESY相关,表明H-11为β取向,则OH-11为α构型。结合以上信息并参照文献[3],鉴定化合物Ⅰ为1(10→6)Abeo-(22E,24R)-ergosta-5,7,9,22-tetraene-3α,11α-diol,其结构式见图2。

表1 化合物Ⅰ的NMR数据

图1 化合物Ⅰ的重要1H-1H COSY和HMBC相关(a)、NOESY(b)相关
化合物Ⅱ:无色针状结晶(氯仿-甲醇),UV 365 nm下有微弱淡蓝色荧光,10% 硫酸乙醇显紫红色(显色后UV 365 nm下呈粉红色荧光)。1HNMR(300 MHz,CDCl3),δ,ppm:4.73(1H,br s,H-28a),4.67(1H,d,J=1.2 Hz,H-28b),3.24(1H,dd,J=4.8 Hz,11.4 Hz,H-3),1.04(3H,d,J=6.9 Hz,H-26 or H-27),1.03(3H,d,J=6.9 Hz,H-27 or H-26),1.01(3H,s,H-29),0.99(3H,s,H-19),0.93(3H,d,J=6.3 Hz,H-21),0.89(3H,s,H-31),0.82(3H,s,H-30),0.70(3H,s,H-18)。13CNMR(150 MHz,CDCl3),δ,ppm:156.9(C-24),134.4(C-8 and C-9),105.9(C-28),79.0(C-3),50.4(C-17 and C-5),49.8(C-14),44.5(C-13),38.9(C-4),37.0(C-10),36.5(C-20),35.6(C-1), 35.0(C-22), 33.8(C-25),31.3(C-23),31.0(C-12),30.8(C-15),28.2(C-16),27.9(C-29),27.8(C-2),26.5(C-7),24.3(C-31),22.0(C-26),21.9(C-27),21.0(C-11),19.1(C-19),18.7(C-21),18.2(C-6),15.7(C-18),15.4(C-30)。结合以上信息并参照文献[4],鉴定化合物Ⅱ为24-甲烯基羊毛脂烷-8-烯-3β-醇(24-Methylenelanostane-8-ene-3β-ol),其结构式见图2。

图2 化合物Ⅰ~Ⅷ的结构式
化合物Ⅲ:无色针状结晶(乙酸乙酯),UV 254 nm呈明显暗斑,10% 硫酸乙醇显紫黑色。1HNMR(300 MHz,CDCl3),δ,ppm:5.59(1H,dd,J=5.7 Hz,2.6 Hz,H-6),5.41(1H,m,H-7),5.24(1H,dd,J=15.7 Hz,6.9 Hz,H-23),5.16(1H,dd,J=15.7 Hz,6.9 Hz,H-22),3.65(1H,m,H-3),2.47(1H,ddd,J=11.7 Hz,4.5 Hz,2.2 Hz,H-4b),2.29(1H,t,J=11.7 Hz,H-4a),1.06(3H,d,J=6.6 Hz,H-21),0.96(3H,s,H-19),0.93(3H,d,J=6.6 Hz,H-28),0.84(3H,d,J=6.6 Hz,H-27),0.82(3H,d,J=6.6 Hz,H-26),0.62(3H,s,H-18)。13CNMR 数据见表2。与对照品共薄层,并与文献[5]中数据对照基本一致,鉴定化合物Ⅲ为(22E,24R)-麦角甾-5,7,22-三烯-3β-醇[(22E,24R)-Ergosta-5,7,22-triene-3β-ol],其结构式见图2。
化合物Ⅳ:无色针状结晶(甲醇),10% 硫酸乙醇显墨绿色。1HNMR(300 MHz,CDCl3),δ,ppm:5.20(2H,m,H-22,23),4.23(1H,br s,H-6),3.94(1H,m,H-3),3.31(1H,m,H-7),1.14(3H,s,H-19),1.02(3H,d,J=6.6 Hz,H-21),0.91(3H,d,J=6.6 Hz,H-28),0.85(3H,d,J=6.3 Hz,H-27),0.82(3H,d,J=6.3 Hz,H-26),0.59(3H,s,H-18)。13CNMR 数据见表2。与文献[6]中数据对照基本一致,鉴定化合物Ⅳ为(22E,24R)-麦角甾-8,22-二烯-3β,5α,6β,7α-四醇[(22E,24R)-Ergosta-8,22-diene-3β,5α,6β,7α-tetraol],其结构式见图2。
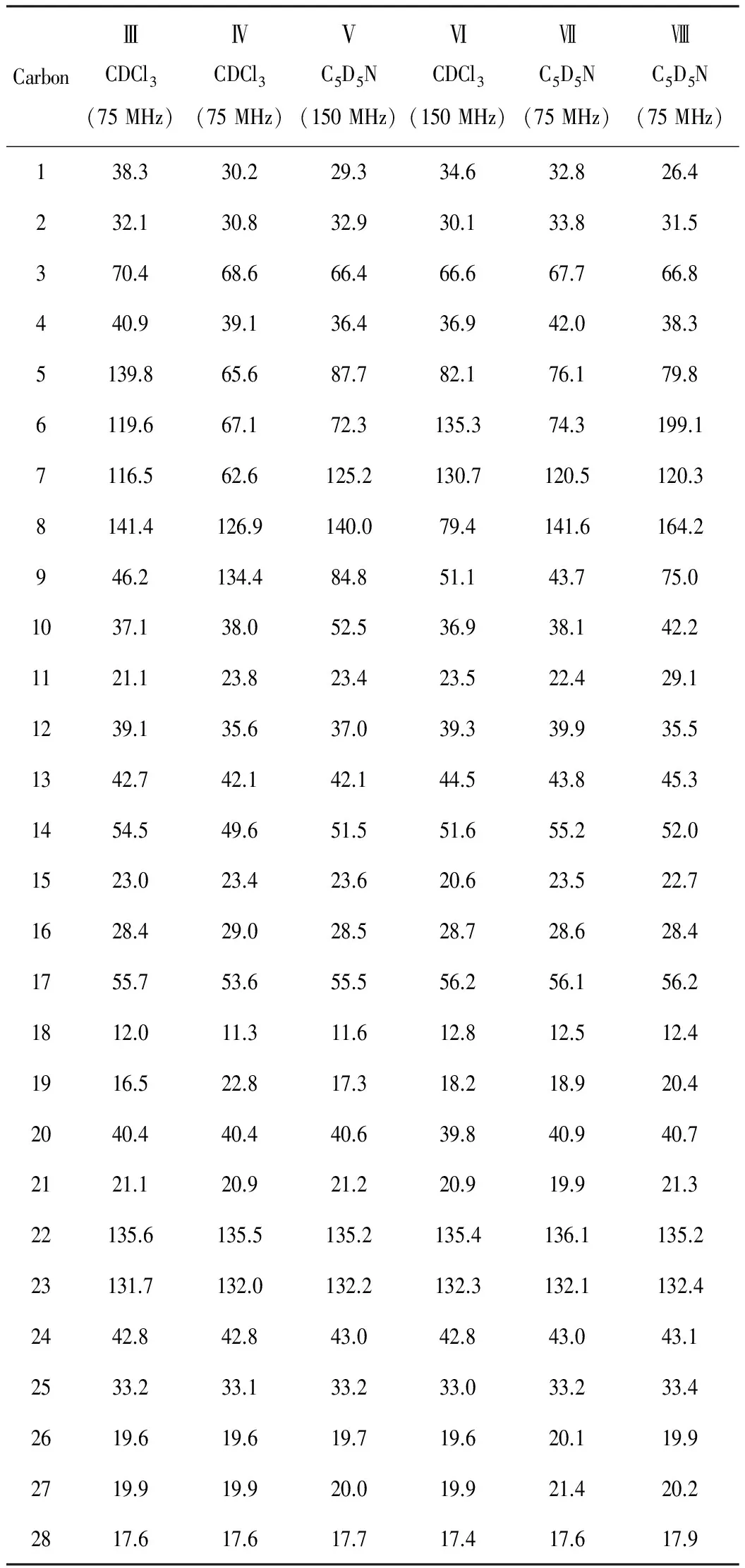
表2 化合物Ⅲ~Ⅷ的13CNMR数据
化合物Ⅴ:无色粒状结晶(氯仿-甲醇),10% 硫酸乙醇显褐色(显色后UV 365 nm下呈黄褐色荧光)。1HNMR(300 MHz,C5D5N),δ,ppm:5.82(1H,m,H-7),5.25(1H,dd,J=15.5 Hz,6.9 Hz,H-23),5.16(1H,dd,J=15.5 Hz,6.9 Hz,H-22),4.49(1H,m,H-6),4.25(1H,br s,H-3),1.58(3H,s,H-19),1.03(3H,d,J=6.3 Hz,H-21),0.95(3H,d,J=6.6 Hz,H-28),0.86(3H,d,J=6.9 Hz,H-27),0.85(3H,d,J=6.9 Hz,H-26),0.68(3H,s,H-18)。13CNMR 数据见表2。结合以上信息并参照文献[7],鉴定化合物Ⅴ为5α,9α-过氧-(22E,24R)-麦角甾-7,22-二烯-3β,6β-二醇[5α,9α-Epidioxy-(22E,24R)-ergosta-7,22-diene-3β,6β-diol],其结构式见图2。
化合物Ⅵ:无色针晶(乙酸乙酯),10% 硫酸乙醇显墨绿色。1HNMR(300 MHz,CDCl3),δ,ppm:6.51(1H,d,J=8.6 Hz,H-7),6.23(1H,d,J=8.6 Hz,H-6),5.21(1H,dd,J=15.5 Hz,7.8 Hz,H-22),5.16(1H,dd,J=15.5 Hz,7.8 Hz,H-23),3.98(1H,m,H-3),1.00(3H,d,J=6.5 Hz,H-21),0.92(3H,d,J=6.5 Hz,H-28),0.87(3H,s,H-19),0.83(3H,d,J=6.5 Hz,H-27),0.82(3H,s,H-18),0.81(3H,d,J=6.5 Hz,H-26)。13CNMR数据见表2。与对照品共薄层,并与文献[8]中数据对照基本一致,鉴定化合物Ⅵ为5α,8α-过氧-(22E,24R)-麦角甾-6,22-二烯-3β-醇[5α,8α-Epidioxy-(22E,24R)-ergosta-6,22-diene-3β-ol],其结构式见图2。
化合物Ⅶ:无色针状结晶(氯仿-甲醇),10% 硫酸乙醇显墨绿色(未加热),加热后显紫红色。1HNMR(300 MHz,C5D5N),δ,ppm:5.74(1H,m,H-7),5.26(1H,dd,J=15.5 Hz,6.9 Hz,H-22),5.18(1H,dd,J=15.5 Hz,6.9 Hz,H-23),4.83(1H,m,H-6),4.32(1H,m,H-3),1.54(3H,s,H-19),1.05(3H,d,J=6.6 Hz,H-21),0.96(3H,d,J=6.9 Hz,H-28),0.85(3H,d,J=6.4 Hz,H-27),0.84(3H,d,J=6.4 Hz,H-26),0.66(3H,s,H-18)。13CNMR 数据见表2。经与对照品共薄层,并参照文献[9],鉴定化合物Ⅶ为(22E,24R)-麦角甾-7,22-二烯-3β,5α,6β-三醇[(22E,24R)-Ergosta-7,22-diene-3β,5α,6β-triol],其结构式见图2。
化合物Ⅷ:白色无定形粉末,10% 硫酸乙醇显黄褐色。1HNMR(300 MHz,C5D5N),δ,ppm:8.62(1H,s,5-OH),6.27(2H,br s,3,9-OH),5.93(1H,d,J=2.1 Hz,H-7),5.27(1H,dd,J=15.2 Hz,7.3 Hz,H-23),5.18(1H,dd,J=15.2 Hz,7.3 Hz,H-22),4.63(1H,m,H-3),1.15(3H,s,H-19),1.04(3H,d,J=6.6 Hz,H-21),0.96(3H,d,J=6.8 Hz,H-28),0.86(3H,d,J=6.6 Hz,H-27),0.85(3H,d,J=6.8 Hz,H-26),0.64(3H,s,H-18)。13CNMR 数据见表2。经与对照品共薄层,并参照文献[10],鉴定化合物Ⅷ为3β,5α,9α-三羟基-(22E,24R)-麦角甾-7,22-二烯-6-酮[3β,5α,9α-Trihydroxy-(22E,24R)-ergosta-7,22-diene-6-one],其结构式见图2。
3 结论
从海洋来源真菌Hypocreavirens的菌丝体中共分离得到8个化合物,分别为1(10→6)Abeo-(22E,24R)-ergosta-5,7,9,22-tetraene-3α,11α-diol(Ⅰ)、24-甲烯基羊毛脂烷-8-烯-3β-醇(Ⅱ)、(22E,24R)-麦角甾-5,7,22-三烯-3β-醇(Ⅲ)、(22E,24R)-麦角甾-8,22-二烯-3β,5α,6β,7α-四醇(Ⅳ)、5α,9α-过氧-(22E,24R)-麦角甾-7,22-二烯-3β,6β-二醇(Ⅴ)、5α,8α-过氧-(22E,24R)-麦角甾-6,22-二烯-3β-醇(Ⅵ)、(22E,24R)-麦角甾-7,22-二烯-3β,5α,6β-三醇(Ⅶ)、3β,5α,9α-三羟基-(22E,24R)-麦角甾-7,22-二烯-6-酮(Ⅷ)。其中化合物Ⅰ、Ⅱ、Ⅳ、Ⅴ、Ⅷ均为首次从该属真菌中分离得到,化合物Ⅲ、Ⅵ、Ⅶ为首次从该种真菌中分离得到。
参考文献:
[1] 阎莉萍,洪葵.海洋微生物合成的抗肿瘤活性物质[J].国外医药(抗生素分册),2003,24(5):213-217.
[2] Flam F.Chemical prospectors scour the seas for promising drugs[J].Science,1994,266(5189):1324-1325.
[3] Luo X,Li F,Shinde P B,et al.26,27-Cyclosterols and other polyoxygenated sterols from a marine spongeTopsentiasp.[J].Journal of Natural Products,2006,69(12):1760-1768.
[4] Shirane N,Murabayashi A,Masuko M,et al.Effect on ergosterol biosynthesis of a fungicide,SSF-109,inBotrytiscinerea[J].Phytochemistry,1990,29(8):2513-2520.
[5] Shirane N,Takenaka H,Ueda K,et al.Sterol analysis of DMI-resistant and sensitive strains ofVenturiainaequalis[J].Phytochemistry,1996,41(5):1301-1308.
[6] Li H J,Lin Y C,Vrijmoed L L P,et al.A new cytotoxic sterol produced by an endophytic fungus fromCastaniopsisfissaat the south China sea coast[J].Chinese Chemical Letters,2004,15(4):419-422.
[7] Yaoita Y,Matsuki K,Iijima T,et al.New sterols and triterpenoids from four edible mushrooms[J].Chem Pharm Bull,2001,49(5):589-594.
[8] 汤海峰,易杨华,姚新生,等.褐藻铁钉菜中的甾醇成分[J].中国海洋药物,2002,21(1):1-4.
[9] 李国友,李伯刚,刘光晔,等.赭曲霉43的甾醇成分研究[J].应用与环境生物学报,2005,11(1):67-70.
[10] Yaoita Y,Amemiya K,Ohnuma H,et al.Sterol constituents from five edible mushrooms[J].Chemical & Pharmaceutical Bulletin,1998,46(6):944-950.

