基于响应面法优化HY15发酵生产β-环糊精葡萄糖基转移酶的发酵条件1)
曹冬梅 胡耀辉
(吉林农业大学,长春,130118)
环糊精葡萄糖基转移酶(简称为CGTase,E.C.2.4.1.19)是一种具有几种催化功能的多糖类合成酶[1],能作用于淀粉和其它 α-1,4-葡聚糖合成非还原性的麦芽低聚糖即环糊精(CD),因连接葡萄糖基数(分别为6、7、8 个)不同而分别称为 α-、β-和 γ-CD[2]。环糊精具有内疏水外亲水的筒型结构,因此,它们能与许多疏水化合物或功能基团形成包合物[3],从而改变这些被包结物质的溶解度、挥发性及化学反应性能等理化性质,因而在食品、化妆品、医药卫生、农业、轻工、化工、石油、冶金、环保以及分析化验等诸多领域有着广泛的应用[4-5]。这使得CGTase的生产研究具有重大意义。目前,国内外对CGTase和CD的需求量逐年增加,但是因为菌种产酶量不高,生产成本过高,限制了它们的扩大生产和应用[6-7]。本研究从长白山温泉泥土中分离筛选到1株以产β-CD为主的高温菌株HY15。通过Plackett-Burman 和响应面设计方法[8-9],对产 β-CGTase的高温菌株HY15培养基成分进行优化,研究其发酵产酶的最佳工艺条件,为发酵大规模生产β-环糊精葡萄糖基转移酶提供理论依据。
1 材料与方法
1.1 材料与试剂
发酵菌株:高温菌株HY15,由吉林农业大学食品科学与工程学院实验室在长白山温泉泥土中筛选保存。
种子培养基:蛋白胨10 g/L,酵母粉5 g/L,盐溶液10 g/L,pH 值7.0。
基础培养基:糊精 10.0 g/L,糖蜜 10.0 g/L,玉米浆 20.0 g/L,酵母浸出粉 10.0 g/L,K2HPO41.0 g/L,MgSO40.2 g/L,Na2CO30.2 g/L,微量元素 0.5 g/L,NaCl 5 g/L,pH 值 7.0。
化学试剂均采用国产分析纯。
1.2 仪器与设备
DELTA 320型pH计,梅特勒—托利多有限公司;TGL-16G台式离心机,上海菲恰尔分析仪器有限公司;DL-CJ-IND超净工作台,北京市东联哈尔仪器制造有限公司;数显恒温水浴锅,北京意成东方科技有限公司;UV-1700 PharmaSpec型紫外可见分光光度计,日本岛津;DSH2-300恒温培养振荡箱,江苏太仓市实验设备厂。
1.3 研究方法
1.3.1 培养方法
摇瓶发酵:在250 mL锥形瓶中加入液体培养基50 mL,将预先培养的种子培养液按3%加入该培养基中,60℃、以200 r/min摇瓶培养48 h。发酵完毕,10 000 r/min离心3 min,上清液即为酶液。
1.3.2 酶活力的测定
取酶液10 μL用蒸馏水90 μL将之稀释10倍,取稀释液10 μL(对照不加样品)加入0.2 mol/L甘氨酸-NaOH-NaCl缓冲液(pH 值 8.55)0.2 mL,放入40℃水浴中加入0.2%马铃薯淀粉溶液(空白不加马铃薯淀粉溶液)0.2 mL后准确计时,反应10 min后放于冰水浴中,加入0.5 mol/L醋酸0.5 mL终止反应,然后加入0.005%碘液3 mL显色,同时以蒸馏水为空白,不加酶液为对照,在700 nm波长下测定吸光度(OD),以光密度下降10%的酶量定为1个单位[10]。按以下公式计算:

式中:a为对照组的吸光度;b为样品的吸光度。
1.3.3 试验设计
Plackett-Burman试验设计:选用N=12的 PB设计表,对影响高温菌株HY15发酵生产β-CGTase的10个因素进行考察,其中低水平“-1”值采用培养基成分的原始浓度,高水平“+1”值采用低水平的倍数[11],Plackett-Burman 试验因素水平及编码见表1。

表1 Plackett-Burman试验因素水平及编码
Box-Behnken和响应面分析试验设计:根据PB试验确定的因素和最陡爬坡试验得到的中心点,按照Box-Behnke设计原理[12]安排响应面分析试验获得重要因素的最佳配方水平。根据中心组合设计结果,来拟合数据,得到描述响应值和自变量之间关系的二阶模型,即:

式中:Y为响应值;b为回归系数;x为自变量值。
2 结果与分析
2.1 Plackett-Burman 试验结果
以β-CGTase活性为考察指标,15次试验的结果依次为:1 086.76、1 077.63、1 066.21、1 127.85、1 132.42、1121.00、1125.57、1118.95、1114.16、1 111.87、1073.06、1086.76、1125.57、1120.46、1 118.72 U·mL-1。由表 2 可见,玉米浆、K2HPO4对 β-CGTase产率的影响极显著(P<0.01),玉米淀粉、糖蜜、pH、MgSO4、酵母浸粉对 β-CGTase 产率影响显著(P<0.05),其他因素 NaCl、微量元素、Na2CO3对β-CGTase产率影响不显著,建立的一阶模型为:
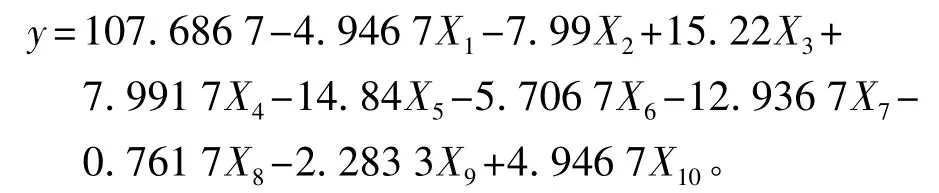
式中:X1~X10分别为糊精、糖蜜、玉米浆、酵母浸粉、K2HPO4、MgSO4、Na2CO3、金属溶液、NaCl、pH。P=0.013 8<0.05,说明此模型显著,其中 98.36%的数据可以用此模型解释(R2=0.983 6)。
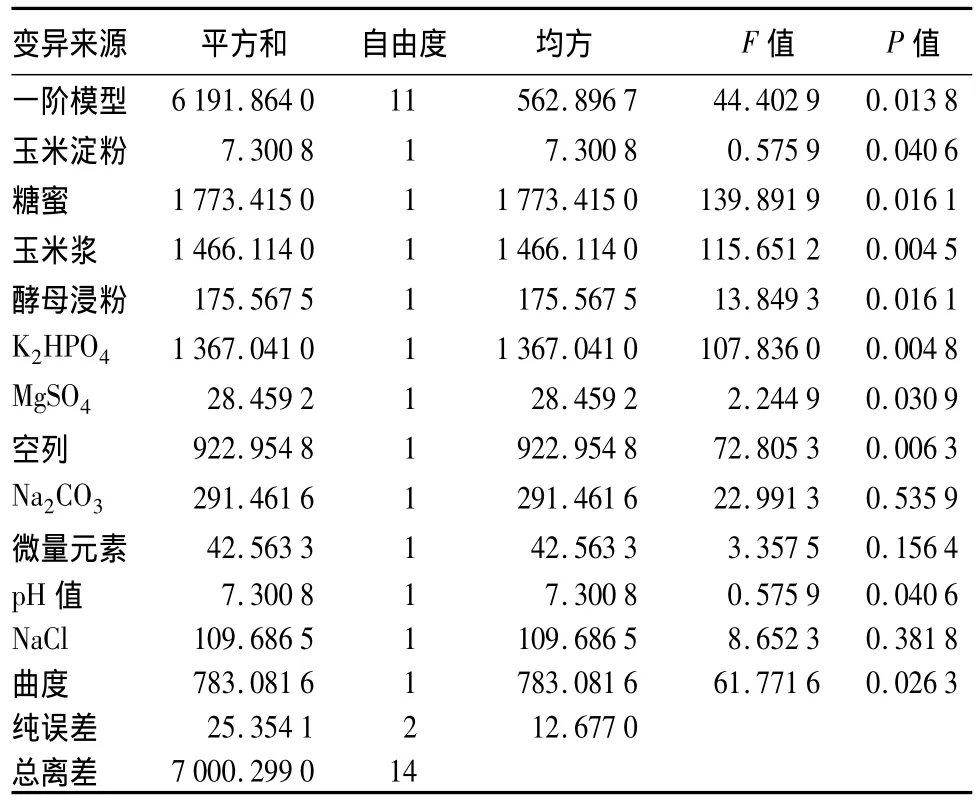
表2 Plackett-Burman试验方差分析结果
2.2 Box-Behnken试验及响应面分析结果
以Plackett-Burman试验结果得出的关键因素:糖蜜+玉米淀粉(x1),K2HPO4(x2),MgSO4(x3),玉米浆+酵母(x4),pH值(x5)5个因素作为中心组合试验因素,结合单因素试验结果,进一步进行5因素5水平的响应面分析试验。中心组合试验因素水平编码见表3,以β-CGTase活性为考察指标,32次中心组合试验的结果依次为:1 239.33、1 190.00、1 220.67、1177.00、1343.33、1288.33、1320.67、1 298.00、1 267.00、1 171.67、1 259.00、1 191.33、1 240.33、1 210.67、1 238.33、1 178.33、1 349.00、1 287.33、1238.67、1342.00、1219.67、1203.00、1 306.33、1 194.33、1 266.67、1 304.67、1 402.67、1 390.33、1 403.33、1 399.67、1 395.33、1 396.33 U/mL。通过32组试验,寻找出5因素的最优发酵工艺参数,经过SAS 8.2软件对试验数据进行处理,得到二次响应面回归方程为:
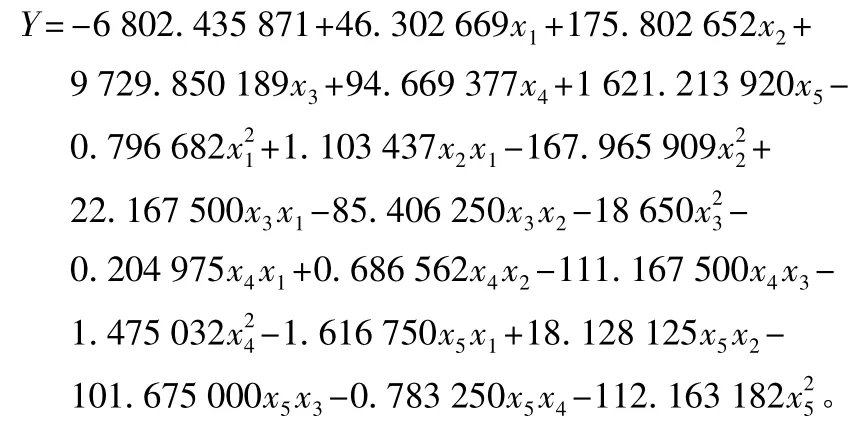
式中:Y为 β-CGTase 产率;x1、x2、x3、x4、x5分别为糖蜜+玉米淀粉、K2HPO4、MgSO4、玉米浆+酵母、pH 的编码值。回归方程中各变量对响应值影响的显著性由F检验判定,P值越小,则相应变量的显著程度越高,对回归方程进行方差分析结果见表4~表6。
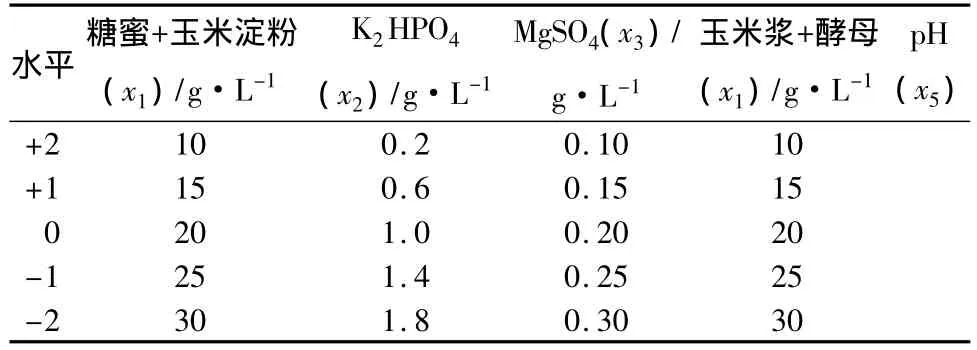
表3 中心组合试验因素水平编码
由表4可知,建立的回归模型P<0.01,表明回归模型极显著。模型可信度分析表明,回归方程的复相关系数R2=0.945 5,变异系数2.545 8%,说明拟合程度良好,试验误差小。因此,可以用此回归方程模拟高温菌株HY15发酵培养基的最优组成。
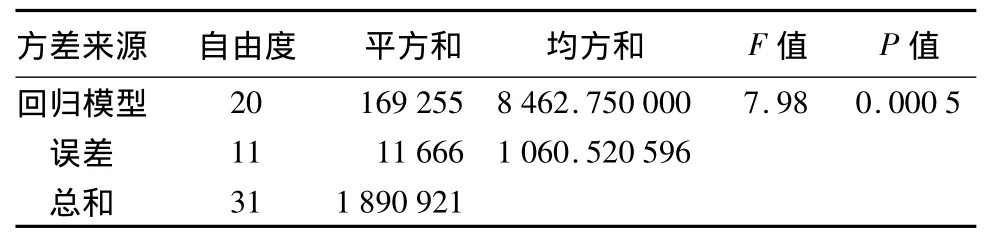
表4 回归方程的方差分析结果
由表5可知,二次回归模型的一次项x3、x4、x5以及二次项和交互项x3x4对响应值的影响极显著(P<0.01)。x1x3对响应值的影响显著(P<0.05),x1、x2、x2x1、x5x4、x4x1、x4x2、x5x1、x5x2、x5x3、x3x2对响应值的影响不显著(P>0.05)。各试验因素对高温菌株HY15产β-CGTase的影响由大到小依次为:pH、MgSO4、玉米浆+酵母、K2HPO4、糖蜜+玉米淀粉。
方程局部最优点即是最佳的试验水平,利用求极值的方法求解最优水平。对回归方程求一阶偏导数,并当到达局部最优点时,导数为零。求得:糖蜜+玉米淀粉 22.45 g/L,K2HPO40.97 g/L,MgSO40.18 g/L,玉米浆+酵母21.82 g/L,pH 值 6.98,在此条件下酶活的预测值为1 409.70 U/mL。
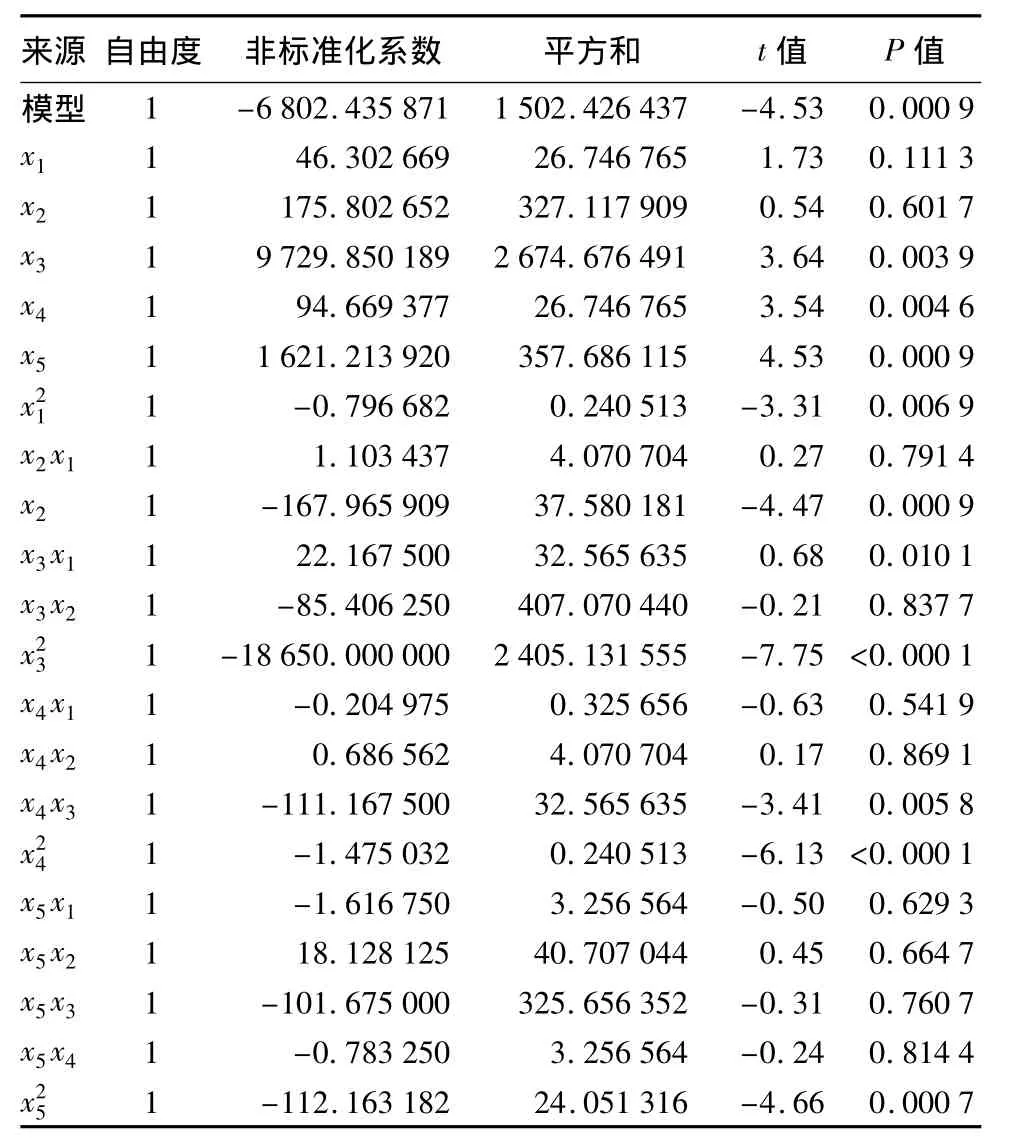
表5 中心组合试验方差分析结果
Y=f(X3,X4)的响应面及等高线如图1所示。由图1A-图1B可见,其他变量取零水平,该变量对指标的影响情况,可以看出在所选的因素水平范围内存在极值。
2.3 验证试验
为了验证模型的有效性,在响应面分析得到的菌种发酵产酶的最佳工艺参数条件下进行菌株HY15产β-CGTase试验,经过3次平行试验,测得菌株发酵产β-CGTase实际酶活力的平均值为1 401.81 U/mL。与理论预测值 1 409.70 U/mL 接近,相对误差为0.56%,说明该回归模型预测准确性比较高。
3 结束语
利用Plackett-Burman试验设计,考察影响高温菌株HY15发酵生产β-CGTase的10个相关因素,从中筛选出糖蜜+玉米淀粉、K2HPO4、MgSO4、玉米浆+酵母、pH值5个对菌种发酵产酶具有显著影响的因素(P<0.05)。然后通过 Box-Behnken设计法得到回归方程,通过求函数最大值确定这5种成分的最佳水平混合为:糖蜜+玉米淀粉22.45 g/L、K2HPO40.97 g/L、MgSO40.18 g/L、玉米浆+酵母21.82 g/L、pH值6.98。在优化后的培养基条件下,β-环糊精葡萄糖基转移酶酶活力达到1 409.70 U/mL。验证值1 401.81 U/mL,二者吻合较好。
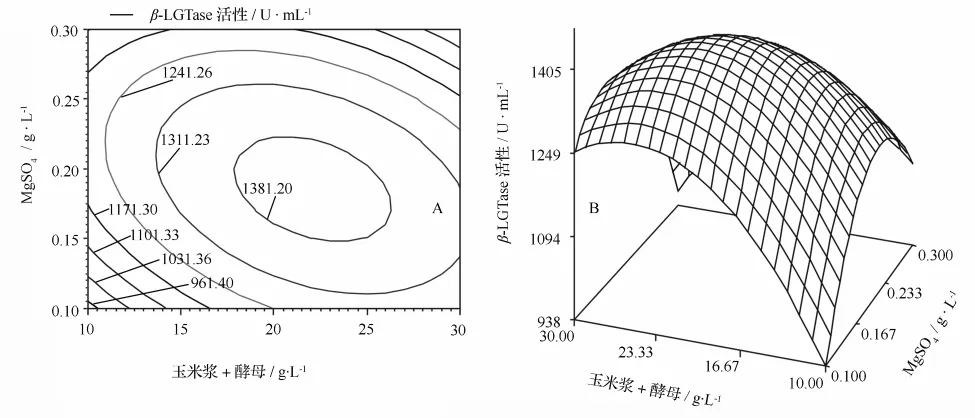
图1 MgSO4和玉米浆+酵母对酶活的响应面图(A)和等值线图(B)
[1]Tachibana Y,Kuramura A,Shirasaka N,et al.Purification and characterization of an extremely thermostable cyclomaltodextrin glucanotransferase from a newly isolated hyperthermophilic archaeon,aThermococcussp.[J].Applied and Environmental Microbiology,1999,65(5):1991-1997.
[2]Abelyan V A,Balayan A M,Manukean L S,et al.Characteristics of cyclodextrin production using cyclodextrin glucanotransferases from various groups of microorganisms[J].Applied Biochemistry and Microbiology,2002,38(6):527-535.
[3]Bender H.Production characterization and application of cyclodextrin[J].Adv Biotechnol Processes,1986,6:31-37.
[4]田辉,杨国武,徐颐玲,等.环状糊精与环状糊精葡萄糖基转移酶[J].工业微生物,1995,25(2):33-38.
[5]Rao P,Suresh C,Narasimha Rao D,et al.Digestion of residual βcyclodextrin in treated egg using glucoamylase from a mutant strain ofAspergillus niger[J].Food Chemistry,1999,65(8):297-301.
[6]唐上华,冯吉吉,黄蕊新,等.嗜碱性芽孢杆菌N-227β-环状糊精葡基转移酶基因的克隆及其在大肠杆菌中的表达[J].工业微生物,1990,20(1):1-5.
[7]唐上华,王磊,周新宇,等.嗜碱性芽孢杆菌N-227环状糊精葡基转移酶基因在枯草杆菌中的整合表达[J].工业微生物,1995,25(1):1-4.
[8]Ramkrishna S,Swaminathan T.Response surface modeling and optimization to elucidate and analyze the effects of inoculum age and size on surfactin production[J].Biochemical Engineering Journal,2004,21(2):141-148.
[9]Stowe R A,Mayer R P.Efficient screening of process variables[J].Industrial and Engineering Chemistry,1966,58(2):36-40.
[10]张心平,张善镐.环状糊精葡萄糖基转移酶产生菌的初步鉴定及其产酶条件[J].南开大学学报:自然科学版,1993,28(2):63-68.
[11]李春英,李晓娟,杨磊,等.响应面分析法优化甘草酸和甘草黄酮联合提取工艺[J].黑龙江大学自然科学学报,2009,26(3):390-395.
[12]Pan C M,Fan Y T,Xing Y,et al.Statistical optimization of process parameters on biohydrogen production from glucose byClostridiumsp.Fanp2[J].Bioresource Technology,2008,99(8):3146-3154.

