多重连接探针扩增技术检测胎儿非整倍体异常*
王凤羽,马林先,李聪敏,张 华,丰慧根
1)河南省人口和计划生育科学技术研究院;河南省人口缺陷干预技术研究重点实验室郑州450002 2)新乡医学院生命科学技术系新乡453000
染色体非整倍体即染色体数目异常,发生于生殖细胞则可能导致不育不孕、自发流产和先天出生缺陷,其中21、18、13、X和Y等染色体非整倍体最为常见,在早期自然流产中,非整倍体率高达50%,存活新生儿发生该病的几率为1/150~1/120,约占新生儿染色体异常的95%。目前,染色体异常治疗困难,疗效不满意,因此,快速准确地对染色体非整倍体异常做出产前诊断,对降低出生缺陷率,提高人口质量意义重大。多重连接探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)是2002年由荷兰的Schouten等[1]设计发明,仅需50~200 ng DNA,便能通过分子杂交、连接和PCR技术对40多个不同的待测核酸靶序列进行定性和半定量分析。根据其快速、特异、灵敏及高效的特点,近几年已开始应用于染色体畸变诊断。该研究运用MLPA技术对200例羊水进行检测,通过与传统核型分析得出的结果进行对比,探讨其在非整倍体异常及产前诊断中的应用价值。
1 对象与方法
1.1 研究对象 标本来自2010年10月至2011年8月河南省人口和计划生育科学技术研究院产前诊断就诊的孕妇,孕妇怀孕18~22周时,在临床医师告知下,选择羊水穿刺诊断200例。羊水标本2 mL用于MLPA检测,3~5 mL用于染色体培养。
1.2MLPA 方法
1.2.1 基因组DNA提取 取羊水2 mL,13 000 r/min离心5 min,尽量移走上清液,加入10~15 g/L蛋白酶K,55℃消化30 min,取此细胞裂解液0.5 mL进行DNA提取,并进行质量和浓度检测。
1.2.2 MLPA检测 采用MLPA非整倍体检测试剂盒(SALSA MLPA P095,荷兰MRC公司),该试剂盒包括36条探针,其中13、18、21和X染色体上分别有8条,另4条位于Y染色体,可检测这5种染色体拷贝数的变化。①DNA变性多重探针杂交:取待测DNA 100 ng置于PCR管中,加TE缓冲液至5 μL,于PCR仪上98℃变性5 min,快速降温,25℃维持。取出PCR管,加入多重探针及MLPA缓冲液各1.5 μL,充分混匀后,95 ℃变性 1 min,60 ℃杂交16 h,54℃维持。②多重探针连接:在上述PCR管内加入连接酶1 μL及连接酶缓冲液A、B各3 μL,再加入纯水配成40 μL反应体系后,54℃反应15 min,随后98℃ 5 min灭活连接酶。③多重PCR反应:取上述连接产物 10 μL,分别加入 4 μL SALSA PCR 缓冲液、26 μL纯水,配成40 μL 反应体系进行PCR扩增。扩增条件为:95℃ 30 s,60℃ 30 s,72℃ 60 s,35个循环。72℃延伸20 min,15℃维持。
1.2.3 毛细管电泳检测 取2 μL PCR产物,分别加入32 μL 上样缓冲液、0.3 μL DNA 标记物混匀,采用遗传分析仪(BECKMAN CEQ 8800)对扩增产物进行毛细管电泳并采集数据。
1.2.4 MLPA产物分析及结果判定 将CEQ系统分析后的数据转换为Excel格式,所得数据通过Coffalyser v9.4软件(Holland-MRC公司)进行分析,得出基因相对拷贝数比值。比值为~0.3,表示该探针检测的片段纯合子缺失;比值为~0.7,表示该探针所检测基因片段存在杂合缺失;比值为~1.3,表示该基因片段无缺失;比值>1.3表示该检测区域存在重复片段。
1.3 羊水染色体模型分析 按常规步骤进行[2]。
2 结果
2.1 MLPA检测结果与染色体核型分析结果比较
见表1。200例羊水标本MLPA均成功检测,检出率为100%。2个工作日完成检测的有190例,占95%;需重复检测的有10例,占5%。其中,1例因羊水污染,细胞培养失败,无法应用传统染色体核型分析,经MLPA检测结果显示正常;其余199例样本与传统染色体核型分析方法得出结论一致。
2.2 毛细管电泳异常图谱 见图1。女性MLPA电泳图谱峰型共8组,每组有4个峰,依次来自21、18、13和X染色体。男性MLPA电泳图谱峰型共8组,前4组每组有5个峰,依次来自21、18、13、X和Y染色体,后4组每组有4个峰,依次来自21、18、13和X染色体。
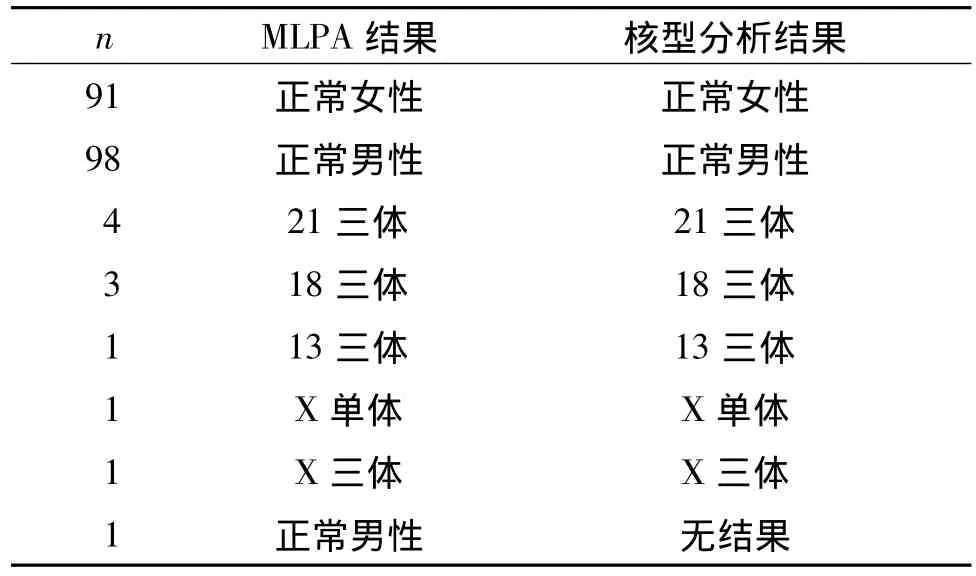
表1 200例羊水MLPA和染色体培养核型分析结果

图1 MLPA电泳图谱
3 讨论
染色体异常是引起人类出生缺陷的主要原因,我国每年有相当数量的21三体和其他染色体异常患儿出生,给家庭和社会造成很大经济负担。目前,在临床中应用的筛查21三体征的方法是酶联免疫法。该方法通过检测孕妇外周血中妊娠相关血浆蛋白、甲胎蛋白、人绒毛膜促性腺激素浓度值,再结合孕龄和孕周计算其危险系数。因为测定值特异性不高,对于高危孕妇仍需要其他方法确诊[2]。细胞分裂中期G显带或高分辨染色体核型分析结果可靠,一直是染色体异常诊断的金标准,但羊水染色体核型分析需体外培养,耗时长,对人员技术要求高,一旦培养失败或可供分析的分裂相少时,都无法进行分析。间期荧光原位杂交(FISH)不需培养细胞,但要找到特异性强的探针方可获得高效杂交,且每个样本需计数分析数十个细胞核,无法高通量检测,成本较高,不适于在临床普及[3]。荧光定量PCR(FQPCR)耗时短(24~48 h),但必须设计多对引物进行多位点扩增才能避免假阴性的结论,目前为止尚无这样高杂合度的商品化试剂盒出现。
近年来,MLPA技术备受关注,已开始应用于染色体畸变诊断。Slater等[4]2003年用MLPA进行了13、18、21、X和Y的非整倍性诊断。此后,国外学者[5-8]进一步对染色体核型分析与MLPA技术做了比较,确定了MLPA可以作为独立快速诊断染色体非整倍体的方法。国内学者[9-11]同样做了相关研究,认为MLPA技术可应用于常见染色体非整倍体畸变的快速检测。作者用该技术对200例羊水样本进行检测,检测成功率为100%,2个工作日完成的占95%,需重复检测的占5%,与上述有关报道一致。除1例因羊水污染,细胞培养失败,无法应用传统染色体核型分析外,其余199例样本与传统染色体核型分析方法得出结论一致。传统染色体核型分析失败的1例经MLPA检测结果显示正常,证实MLPA技术在羊水染色体非整倍体异常诊断及产前诊断中具有重要的应用价值。
唐少华等[10]的研究结果表明,MLPA技术不能发现染色体结构异常。罗世强等[11]研究结果显示,MLPA技术对21三体嵌合体未能做出明确判断。对于非整倍体镶嵌体的诊断,各位学者[4-13]观点不同:有的认为MLPA、FISH和FQ-PCR技术一样检测的是非培养细胞,因此不能用于镶嵌体检测;也有人认为建立探针比值合适区间就可以辨别镶嵌体,然后进一步确诊。
该研究中需重复实验的10例,可能是由于DNA不足、变性不完全或盐离子浓度过高造成。用新鲜羊水标本提高DNA质量,延长变性时间使变性更充分,用去离子水洗脱DNA降低离子浓度,对实验仪器和耗材严格消毒等手段可以增加实验的稳定性和成功率。另外,作者发现分析数据中存在个别染色体比值范围多低于设定范围,可能是受实验室条件影响,有待于进一步分析。
当今社会,由于孕妇年龄普遍较高造成高危孕妇相对增多,为减少其等待的焦虑,迫切需要一种快速、简便、可靠的方法及时对其做出诊断。MLPA是基于基因水平的诊断新技术,具有很好的特异性和使用价值,该技术有望应用于染色体非整倍体检测。
[1]Schouten JP,McElgunn CJ,Waaijer R,et al.Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification[J].Nucleic Acids Res,2002,30(12):e57
[2]姚宏,徐聚春,胡华,等.产前诊断染色体异常与妊娠结局的临床分析[J].第三军医大学学报,2012,34(2):106
[3]吴玥丽,赵晖,贾莉婷,等.孕妇产前羊水细胞染色体非整倍体异常的荧光原位杂交诊断[J].郑州大学学报:医学版,2011,46(2):272
[4]Slater HR,Bruno DL,Ren H,et al.Rapid,hight throughput prenatal detection of aneuploidy using a novel quantitative method(MLPA)[J].J Med Genet,2003,40(12):907
[5]Kooper JA,Faas BH,Kater-Baats E,et al.Multiplex ligation-dependent probe amplification(MLPA)as a standalone test for rapid aneuploidy detection in amniotic fluid cells[J].Prenat Diagn,2008,28(11):1004
[6]Hochstenbach R,Meijer J,van de Brug J,et al.Rapid detection of chromosomal aneuploidies in uncultured amniocytes by multiplex ligation-dependent probe amplification(MLPA)[J].Prenat Diagn,2005,25(11):1032
[7]Gerdes T,Kirchhoff M,Lind AM,et al.Computer-assisted prenatal aneuploidy screening for chromosome 13,18,21,X and Y base on multiplex ligation-dependent probe amplification(MLPA)[J].Eur J Hum Genet,2005,13(2):171
[8]Boormans EM,Birnie E,Wildschut HI,et al.Multiplex ligation-dependent probe amplification versus karyotyping in prenatal diagnosis:the M.A.K.E.study[J].BMC Pregnancy Childbirth,2008,8:18
[9]范新萍,王立荣,肖白,等.多重探针连接依赖式扩增快速检测染色体非整倍体异常[J].中华检验医学杂志,2008,31(1):77
[10]唐少华,毛义建,陈向南,等.应用多重连接依赖式探针扩增技术快速高通量诊断胎儿染色体非整倍体异常[J].中华医学遗传学杂志,2011,28(2):199
[11]罗世强,范新萍,蔡稔,等.多重链接探针扩增技术在染色体非整倍体畸变诊断中的应用[J].中华医学遗传学杂志,2011,28(2):212
[12]Van Opstal D,Boter M,de Jong D,et al.Rapid aneuploidy detection with multiplex ligation-dependent probe amplification:a prospective study of 4 000 amniotic fluid samples[J].Eur J Hum Genet,2009,17(1):112
[13]Gerdes T,Kirchhoff M,Lind AM,et al.Multiplex ligation-dependent probe amplification(MLPA)in prenatal diagnosis:experience of a large series of rapid testing for aneuploidy of chromosomes 13,18,21,X and Y[J].Prenat Diagn,2008,28(12):1119

