萝卜EST-SSR标记PCR反应体系的建立与优化
付卫民 ,王淑芬 ,王秀峰 ,何启伟 ,刘贤娴 ,韩晓雨
(1.山东农业大学园艺科学与工程学院,泰安,271018;2.山东省农业科学院蔬菜研究所/山东省设施蔬菜生物学重点实验室/国家蔬菜改良中心山东分中心)
萝卜 (Raphanus sativusL.var.longgpinnatus Bailey)为十字花科萝卜属一、二年生草本植物,起源于我国,目前在世界各地广泛栽培,是主要的蔬菜作物之一。近年来,随着萝卜育种工作的不断进步和萝卜种质资源深入挖掘利用,使得萝卜种质资源日益丰富,但同时也对萝卜的遗传多样性鉴定、新品种测试与保护工作提出了新的挑战。
基于DNA多态性分析的分子标记技术已经成为遗传多样性鉴定与评价的通用方法。随机序列扩增多态性 (RAPD)、限制性片段扩增多态性(AFLP)、微卫星标记(SSR)等是植物遗传多样性研究中运用最多的几种方法[1]。而近几年新兴的ESTSSR标记技术除具有SSR标记多态性高、重复性好等优点外,还很好地弥补了其缺点,例如操作简单,引物获取比较容易,可以直接根据公共数据库中的EST序列筛选SSR,设计引物等。EST-SSR标记能更准确地反映出不同基因型之间的遗传差异和亲缘关系[2],且引物的通用性更好[3],另外,由于EST序列直接位于基因的编码区,因此更容易筛选到与功能基因紧密连锁的标记。目前该方法已广泛应用于小麦、大豆、黄瓜、辣椒、油菜、番茄等作物的分子标记研究[4~9]。但鉴于该方法基于PCR技术,反应条件易受多种因素影响,因此,有必要对实际研究中相应的反应体系进行优化,以提高研究效率和获得更为准确的研究结果。
本研究对较为常用的20 μL PCR技术体系,利用 L16(45)正交试验设计,从模板 DNA、Mg2+、dNTP、引物、Taq酶等5个因素4种水平对萝卜EST-SSR反应体系进行优化分析,以期建立一套适合萝卜的EST-SSR反应体系。
1 材料与方法
1.1 试验材料
试验所用萝卜品种为紫玉。快捷型植物基因组DNA提取试剂盒购自北京天根公司;Mg2+、dNTPs、TaqDNA聚合酶均购自宝生物工程 (大连)有限公司;引物合成于北京六合华大基因科技股份有限公司,其他常规试剂均购自上海生工生物工程技术有限公司;50 bp maker购自Fermentas公司。
1.2 试验方法
①DNA的提取 在萝卜苗期,取上数第3~4片叶100 mg,洗净,加入适量液氮充分研磨,采用快捷型植物基因组DNA提取试剂盒进行。
②PCR扩增 PCR扩增在ABI2720PCR仪上进行。反应体系为20 μL。反应条件为94℃预变性2 min,94℃变性 30 s,54℃退火 30 s,72℃延伸 1 min,共40个循环,72℃延伸7 min,4℃保存。FWM11为优化引物,其他10对为验证引物(表1)。
③正交试验设计 本研究设计为DNA模板浓度、Mg2+、dNTPs、引物浓度和TaqDNA聚合酶浓度5个因素 4 个水平的 L16(45)正交试验(表 2),另外每管加 2 μL 不含 Mg2+的 10×PCR Buffer。 扩增产物在8%聚丙烯酰胺凝胶上检测,银染显色,照相保存。
2 结果与分析
2.1 基因组DNA浓度和纯度检测
供试材料的基因组DNA,紫外分光光度检测A260/A280值均在1.8~2.0;0.8%的琼脂糖凝胶电泳检测(图1)显示,条带清晰,无降解,纯度高,达到EST-SSR分析的要求。
2.2 正交优化结果分析
PCR反应体系扩增结果表明(图2),3、11和14扩增条带清晰,14号反应体系条带最浓,试剂使用最经济,因此确定最佳体系为DNA模板65 ng/20 μL,Mg2+0.8 mmol/L,dNTPs 0.25 mmol/L,Taq DNA 酶0.4 U/20 μL,每个引物 0.8 μmol/L。
2.3 优化体系的验证
本试验采用紫玉萝卜F2代绿叶植株构建的基因池和11对引物对14号反应体系进行验证,F2基因组DNA为对照。结果表明(图3),10对引物扩增条带符合预期片段大小,条带清晰,均为有效扩增。
3 小结与讨论
由上述扩增结果表明,DNA模板在4个水平范围都有效扩增,对反应体系影响最小;引物、TaqDNA酶和dNTPs在3个水平内有效扩增,对反应体系影响也不大;Mg2+浓度为0.8 mmol/L时,扩增条带特异性好,条带清晰,均为预扩增条带,且Mg2+对扩增效率也有影响,浓度过高或过低均使非特异性扩增产物减少或导致扩增反应失败,故Mg2+对该反应体系影响最大。本研究结果与王娟等[10]优化苹果ESTSSR标记PCR反应最佳体系、韩明利等[9]优化番茄EST-SSR标记PCR反应体系、李红双等[11]优化萝卜SRAP-PCR反应体系中的关键Mg2+因素相一致。而与佟海申等[12]研究大白菜EST-SSR标记PCR反应体系4因素(不包括Mg2+)的最佳反应浓度和关键影响因素有差异,原因可能是没有单独对Mg2+因素考虑和试验材料不同所致。
本研究利用正交试验优化萝卜EST-SSR标记的PCR反应体系,具有扩增条带清晰、重复性好、多态性丰富等特点,为萝卜种质资源的鉴定与评价、EST-SSR分子标记辅助选择育种等奠定了十分重要的基础,具有很好的应用价值。

表1 PCR反应体系引物
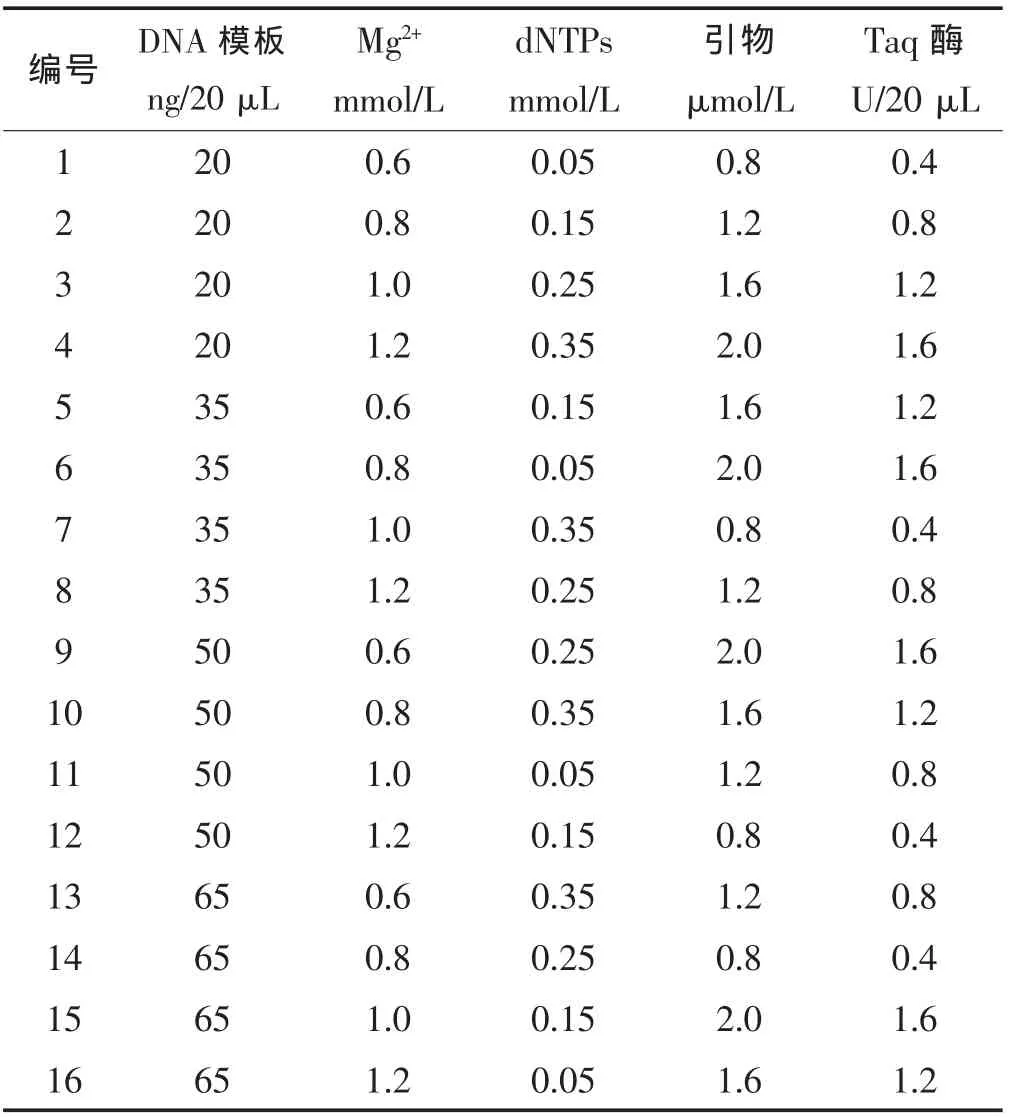
表2 正交试验设计L16(45)

图1 基因组DNA电泳结果

图2 正交设计EST-SSR反应体系扩增结果

图3 14号反应体系在F2中的验证
[1]Powell W,Morgante M,Andre C,et al.The comparison of RFLP,RAPD,AFLP and SSR (microsatellite)markers for germplasm analysis[J].Mol Breed,1996,2:225-238.
[2]李建明,李洪杰,柴守诚,等.普通小麦 Genomic-SSR和EST-SSR分子标记遗传差异[J].安徽农业科学,2007,35(26):8 173-8 175,8 183.
[3]宿俊吉,柴守诚,刘伟华,等.普通小麦SSR和EST-SSR引物对冰草通用性的比较分析 [J].西北植物学报,2007,27(7):1 311-1 316.
[4]Li W,Dong P,Wei Y M,et al.Genetic variation in Triticum turgidumL.ssp.turgidumLandraces from China assessed by EST-SSR markers[J].Agricultural Sciences in China,2008,7(9):1 029-1 036.
[5]蔺宇,徐静静,王晓鸣,等.适用于大豆疫霉菌遗传分析的新 EST-SSR 标记[J].中国农业科学,2008,41(8):2 294-2 301.
[6]胡建斌,李建吾.黄瓜基因组EST-SSRs的分布规律及EST-SSR 标 记 开 发 [J].西 北 植 物 学 报 ,2008,28(12):2 429-2 435.
[7]李晶晶,王述彬,刘金兵,等.辣椒EST-SSR标记的开发[J].分子植物育种,2008,6(6):1 219-1 222.
[8]李小白,张明龙,崔海瑞.油菜EST-SSR标记的建立[J].分子细胞生物学报,2007,40(2):137-144.
[9]韩明利,侯丽霞,崔娜,等.番茄EST-SSR标记PCR反应体系的优化[J].西北园艺,2011(16):142-144.
[10]王娟.苹果EST-SSR引物的开发及部分品种亲缘关系分析[D].郑州:河南农业大学,2009:30-32.
[11]李红双,邱杨,李锡香.萝卜SRAP-PCR反应体系的建立与优化[J].华北农学报,2009,24(增刊):91-95.
[12]佟海申,宋琳,张志刚,等.大白菜EST-SSR反应体系优化及引物筛选[J].科技导报,2010,28(3):76-81.

