离子色谱法分析土壤中的矮壮素和缩节胺*
张强 张锦梅,王敬花,王珊珊,田海峰
(青岛市计量测试所,山东青岛 266101) (青岛盛瀚色谱技术有限公司,山东青岛 266101)
矮壮素 (chlorocholine chloride,CQ,2-氯乙基三甲铵氯化物)和缩节胺(mepiquat chloride,MQ,1,1-二甲基哌啶氯化物)是我国广泛使用的两种植物生长调节剂,它们可经由叶片、幼枝、芽、根系吸收进入植株体内,抑制赤霉素的合成,从而有效地控制植物徒长,提高农产品的产量和品质。矮壮素和缩节胺是高效、低毒、无药害内吸性药剂,广泛地用于土壤、水稻、棉花、烟草、玉米及各种块根作物上[1]。这两种植物生长调节剂虽然低毒,但仍然会给人体带来危害。研究表明,即使在低于日允许摄人量(ADI)浓度水平下,矮壮素对动物的繁殖能力仍有不良影响[2]。美国国家职业安全和健康研究所(NIOSH)发布的化学物质毒性数据库(RTECS)已将矮壮素列为疑似内分泌干扰物质。矮壮素和缩节胺均为季铵盐类化合物,极性和水溶性强,在土壤中具有吸附性,容易污染地下水,会给环境造成一定的污染。2006年M. Srensen等[3]研究了缩节胺在哺乳类动物体内的残留量,但没对缩节胺对人体是否安全做出结论。
目前我国检测矮壮素残留的化工标准有化学法(水剂HG2-818-75)、电位滴定法(CIPAC手册,1988,D,39)。化学法 (水剂 HG2-818-75)采用化学滴定进行定量分析,通过硝酸银滴定测定游离氯和总氯,由此计算矮壮素的含量,但该方法灵敏度不高,误差较大,不适合矮壮素的痕量分析。电位滴定法其实质仍为化学滴定法,但以电位滴定来确定滴定终点,灵敏度较化学法有所提高,但同样存在样品消耗量大的问题[4]。封顺等[5]对矮壮素和缩节胺的分析方法进展也做了论述。早期分析矮壮素和缩节胺的方法还包括 TLC[6]、离子色谱法[7]、气相色谱法[8-9]和 HPLC 法[10]。气相色谱法的测定需要对样品进行衍生,但衍生化过程会造成回收率低、干扰物质增加、检测结果易产生假阳性等问题[9]。矮壮素和缩节胺的弱挥发性和强极性决定了其适合采用液相色谱法进行检测,但因其分子结构简单,不含有发色基团,也需要衍生化后才能进行紫外检测[11]。采用质谱检测则可以解决这一问题,因此目前常采用液相色谱-质谱联用法进行分析[12],但质谱仪高昂的成本提高了矮壮素和缩节胺常规检测的成本。傅里叶变换拉曼光谱法[13]虽然相对降低了检测成本,但由于仪器不够普及,不适合常规检测。采用离子色谱法测定矮壮素和缩节胺,虽然灵敏度没有气相色谱-质谱或液相色谱-质谱高,但该方法具有操作简单、快速、实用等特点,能满足矮壮素和缩节胺的常规检测,且离子色谱仪及其操作的成本较质谱低,实际推广性更强。
已有文献报道采用流动相离子色谱测定矮壮素和缩节胺[14]。矮壮素和缩节胺是季铵盐类化合物,在离子交换树脂上保留较强,Peeters[15]等用阳离子交换抑制电导检测法测定梨中的矮壮素,其在色谱分离过程中用很高浓度的硫酸作为淋洗液时,仍存在峰形较宽等问题。随着离子色谱柱合成工艺的改进,可直接用离子色谱法同时测定矮壮素和缩节胺。目前国外对蔬菜[16]、水果[17]和谷物[18]中矮壮素的残留检测多采用液相色谱-质谱联用法。液-质联用虽然具有高灵敏度和高选择性的优势,增加了定性、定量的可靠性,但是液-质联用成本相对较高。郭幸丽[19]曾采用高效液相色谱-电喷雾质谱法测定土壤中的矮壮素残留,矮壮素检出限较高。笔者采用离子交换电导法同时检测土壤中的矮壮素和缩节胺,可以满足一般常规要求。
1 实验部分
1.1 主要仪器和试剂
离子色谱仪:CIC-300型,配有恒温电导检测池、色谱柱恒温、光学检测器、SH-A自动进样器,青岛盛瀚色谱技术有限公司;
色谱工作站:HW-2000型,上海千谱公司;
过滤膜:0.22 μm,天津Automatic Science公司;
超纯水系统:UPT-Ⅱ-20L型,成都超纯科技有限公司;
超声波:HS-102600型,天津恒奥科技有限公司;
离心机:Anke TDL80-2B型,上海安亭科学仪器厂;
甲烷磺酸:分析纯,国药集团化学试剂有限公司;
乙腈:HPLC,美国Tedia公司;
缩节胺、矮壮素标准品:纯度大于99%,德国Dr. Ehrenstorfer公司;
缩节胺和矮壮素标准储备溶液:准确称取适量的缩节胺和矮壮素标准品,用超纯水配制成浓度均为1000 mg/kg的标准储备溶液,在-4℃冰箱中保存;
缩节胺和矮壮素混合标准液:分别准确吸取2.0 mL缩节胺和矮壮素标准品于100 mL容量瓶中,用超纯水定容,得到浓度均为20.0 mg/kg的缩节胺和矮壮素混合标准溶液;
实验用水为超纯水(电阻率为18.2 MΩ·cm)。
1.2 色谱条件
色谱柱:SH-CC-3阳离子交换柱(150 mm×4.6 mm,5 μm),填料表面为羧酸基的聚丙烯酸树脂;检测器:电导检测器;淋洗液用3 mmol/L甲烷磺酸等度淋洗,流速1.0 mL/min;检测温度:40℃;进样量:100 μL;定量方法为外标法,以保留时间定性,峰面积定量。
1.3 样品处理
在农田中采用对角线布点法或者梅花形布点法,随机采用深度0~10 cm的土壤样品1 kg,将其样品摊平,挑出其中的石块、草根及其它植物残体等杂物,自然阴干,人工碾碎,过840 μm(20目)尼龙筛。用四分法保留100 g土样,用研钵磨细,全部过150 μm(100目)尼龙筛备用。
称取10.0 g(准确至0.01 g)土壤样本于250 mL具塞三角瓶中,加入50 mL淋洗液,浸泡12 h。振荡超声提取20 min,转移至100 mL离心管,在4000 r/min下离心5 min。取10 mL上清液过0.22 μm滤膜过滤,然后用离子色谱分析。
2 结果与讨论
2.1 色谱柱和淋洗液的选择
土壤中钠、钾、镁、钙常见阳离子含量较高且电导响应较灵敏,缩节胺和矮壮素的强极性决定了其在色谱柱中保留性较强,要选用容量高的色谱柱来分离,梯度洗脱成本较高,考虑等度洗脱。SH-CC-1型色谱柱是羧酸型阳离子交换柱,常规的3.0 mmol/L甲烷磺酸可以将钠、钾、镁、钙洗脱出来,但是缩节胺和矮壮素在该条件下30 min洗脱不出来,流动相浓度加倍后,调整有机溶剂乙腈的配比,乙腈体积分数分别选用10%,8%,6%时可以洗脱出来,但是由于有机溶剂的加入,导致响应变低,而且峰形严重拖尾,达不到实际需要的检出限;SH-CC-2型色谱柱常用的流动相是10 mmol/L甲烷磺酸,钠、钾、镁、钙出峰在15 min 左右,缩节胺、矮壮素在40 min之内淋洗不出来,加入体积比为10%的乙腈,20 min左右出峰,由于用的是直接电导检测,导致电导响应值低,使目标离子检出限较低(大约1 mg/kg),难以满足待测离子实际样品的检出限;SH-CC-3型色谱柱是羧酸型阳离子交换柱,是一款快速分离柱,适合于强保留离子分离,用3 mmol/L甲烷磺酸就可以直接将钠、钾、镁、钙洗脱出来,矮壮素、缩节胺在10 min之内就可以出峰。SH-CC-3型色谱柱不需要添加有机溶剂,节约实验成本,对分析人员的健康危害小,而且检出限可以达到要求,因此实验选用3 mmol/L甲烷磺酸等度淋洗,SH-CC-3阳离子色谱柱作为分离柱。
2.2 色谱柱分离温度的选择
固定淋洗液浓度,改变柱温和检测温度,进样测定混合标准溶液中各物质的保留时间,以3.0 mmol/L甲烷磺酸为淋洗液,流速为1.0 mL/min,考察温度对SH-CC-3柱的分离中各离子的影响,其中温度对钾离子的保留时间变化较大,温度从25℃至40℃,随温度的升高,保留时间逐渐变短,其它离子保留时间变化不大,在40℃时,钾离子出峰在镁、钙之前,不会干扰到其它阳离子以及缩节胺和矮壮素的检测,因此试验温度选用40℃。
2.3 色谱图
在确定的最佳实验条件下,5种阳离子标准溶液的色谱图见图1。除去钠、铵离子,各组分基本达到基线分离,此条件下,钾离子、镁离子、钙离子对矮壮素、缩节胺离子的测定没有干扰,钠离子和铵离子分离度不能达到基线分离,但是在本实验中,并不对钠离子、铵离子、镁离子、钙离子定性。而且在标准品中加大钙离子至30 mg/kg,也不会干扰缩节胺和矮壮素的测定。

2.4 方法的定量分析参数
在1.2色谱条件下,对缩节胺和矮壮素的系列标准溶液进行测定,以峰面积(y)对离子的质量浓度(x,mg/kg)行线性回归,得到线性方程。以3倍的信噪比(S/N=3)计算检出限。保留时间的相对标准偏差(RSDt)和峰面积的相对标准偏差(RSDs)由连续5次重复测试的缩节胺和矮壮素混合标准溶液得到,结果见表1。
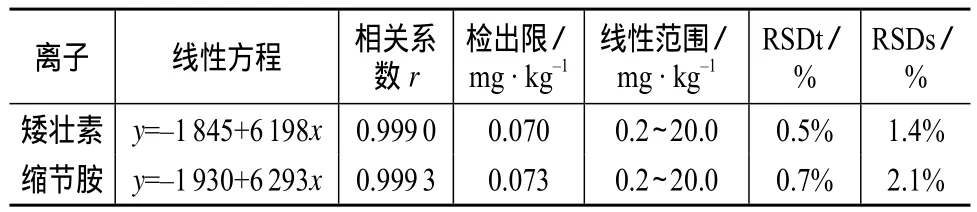
表1 线性回归方程、检出限以及保留时间和峰面积的相对标准偏差
2.5 加标回收试验与精密度试验
对空白土壤样品进行矮壮素和缩节胺加标回收试验,试验结果见表2。

表2 回收试验和精密度试验结果(n=5)
由表2可知,测定结果的相对标准偏差为1.76%~4.1%,回收率为84.9%~93.8%,说明方法的准确度和精密度较高,能满足土壤中矮壮素和缩节胺的定量分析要求。
3 结语
建立了离子色谱直接电导法检测土壤中的矮壮素和缩节胺的方法。该法前处理方法简单,与气相衍生化方法相比,成本较低,减少了实验过程一些试剂对环境的污染和对实验室人员的危害。离子色谱电导法为土壤中检测矮壮素和缩节胺的检测提供了一种有效的手段,该方法也可以用来检测不同土壤剖面的农药情况,对合理使用农药、控制农药残留、保护环境具有深远的意义。
[1]Tom Lin C. The pesticide manual,british crop protection council[M]. Cambridge: Farmer and The Royal society of Chemistry,1997: 220-221.
[2]Tomer H,Blottner S,Kuhla S,et a1. Influence of chlorocholinechloride-treated wheat on selected in vitro fertility parameters in male mice[J]. Reprot Toxicol,1999,13(5): 399-404.
[3]Srerm M T,Danielsen V. Effects of the plant growth regulator,chlormequat,on mammalian fertility[J]. International Journal of Andrology,2006,29: 129-133.
[4]张曦,金芬,钱永忠,等.食品中矮壮素和缩节胺分析方法的研究进展[J].食品与发酵工业,2008,34(10): 127-131.
[5]封顺,张旭龙,王吉德.矮壮素和缩节胺分析方法进展[J].新疆农业科学,2010,47(10): 2091-2096.
[6]Dekhuijzen H M,Vonk C R. The distribution of chlormequat in wheat[J]. Pestic Biochem Phys,1974,4: 346-355.
[7]Ferget A,Schepers,B Schwarz. Determination of mepiquatchloride in animal and plant matrices by ion chromatography with conductivity detection[J]. Fresenius J Anal Chem,1991,399:441-443.
[8]A llender W J. Determination of chlormequat residues in colon seed by gas chromatography[J]. Pestic Sci,1992,35: 265-269.
[9]Tafuri F,Businelli M. Gas-chromatographic determination of chlorcholine chloride residues in natural tomato juice [J]. Analyst,1970,95: 675-679.
[10]Evans C S,Startin J R,Goodall D M,et al. Determination of chlormequat infruit samples by liquid chromatographyelectrospray-mass spectrometry/mass spectrometry [J]. Journal of AOAC International,2001,84: 1903-1907.
[11]Karasali H,Loannou S. HPLC determination of mepiquat chloride in commercial pesticide formulations[J]. Bulltin Environmental Contamination Toicology,2009,83: 636-639.
[12]王金花,卢晓宇,黄梅,等.超高效液相色谱-质谱法快速分析番茄及其制品中矮壮素和缩节胺残留[J].分析化学,2007,35(10): l 509-1512.
[13]Quintas G,Garrigues S,Pastor A,et al. FT-Raman determination of mepiquat chloride in agrochemical products[J]. Vibrational Spectroscopy, 2004,36: 41-45.
[14]周旭,许锦刚,陈智栋,等.流动相离子色谱法同时测定植物中残留的矮壮素和缩节胺[J].色谱,2011,29(3): 244-248.
[15]Peeters M C,Defloor I, Coosemans J,et a1. Simple ion chromatographic method for the determination of chlormequat residues in pears [J]. J Chromato A,2001,920: 255-259.
[16]Carerim,Elvirl,Mang I A,et al. Rapid method for determination of chlormequat residues in tomato products byIon-exchange liquid chromatography electrospray tandem mass spectrometry[J].Rapid Commun in Mass Spectrom,2002,16 (19): 1821-1826.
[17]Castro R,Mo Yano E,Galceran M T. Determination of chlormequat in fruit samples by liquid chromatographyelectrospray-mass spectrometry/mass spectrometry [J]. J AOAC Int,2001,8 (6): 1903-1908.
[18]Vahl M,Grav EN A,Juhler R K. Analysis of chlormequat residues in grain using liquid chromatography-mass spectrometry (LC-MS/MS )[J]. Fresenius J Anal Chem,1998,361(8): 817-820.
[19]郭幸丽,秦冬梅,徐彦军,等.高效液相色谱-电喷雾质谱法测定土壤中的矮壮素残留[J].农药学学报,2009,11(3): 346-352.

