模拟鸭肠液中消化酶的批次来源与活性贡献对饲料原料消化能力的影响
严 峰 赵 峰 米宝民 张 莉 齐智利 张宏福
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.华中农业大学动物科技学院,武汉 4 30070)
在家禽体外模拟消化方法的研究中,模拟小肠液的制备一直是该领域的核心技术之一[1]。如何在定量确保模拟小肠液消化能力的前提下,兼顾消化酶的来源与被模拟动物体内的消化酶具有种属的同源性,是进一步提高模拟小肠液仿真程度的关键。长期以来,人们在禽用模拟小肠液的制备上,多以一定浓度的猪源性胰液素或试剂级胰蛋白酶、糜蛋白酶、淀粉酶等来制备模拟小肠液[2-5],这种制备方法从消化酶的活性水平与同源性上都与动物体内肠液相差甚远。近年来,谢木林等[6]研究发现,鸭空肠液中淀粉酶、胰蛋白酶、糜蛋白酶和脂肪酶这4种主要酶的消化能力占肠液所有酶消化总能力的86.39%以上,对收集的鸭空肠液初提纯成粉剂后,通过试剂酶调节这4种主要消化酶的活性,制备的模拟鸭肠液的消化能力为体内肠液消化能力的100.1%~103.5%。由此表明,以鸭肠液酶粉剂为基础,加入部分试剂酶调节4种主要消化酶的活性后,可以获得满意的模拟鸭肠液制备效果,并在消化酶来源的同源性上有较大改善。然而,不同批次的鸭肠液酶粉剂与试剂酶组合后制备的模拟鸭肠液的消化能力是否有差异?鸭肠液酶粉剂与试剂酶对主要消化酶活性的贡献在什么范围内不会影响模拟鸭肠液的消化能力?这2个问题的探讨对模拟鸭肠液消化能力的稳定性至关重要。为此,本研究以3个批次的鸭肠液酶粉剂为基础,通过比较每批次酶粉剂内,酶粉剂提供的主要消化酶活性与试剂酶提供的主要消化酶(淀粉酶、胰蛋白酶、糜蛋白酶,以胰蛋白酶为参照计算比例)活性不同配比时,制备的模拟鸭肠液对玉米、豆粕、小麦麸的干物质消化率与酶水解物能值的影响,探讨模拟鸭肠液的制备中鸭肠液酶粉剂与试剂酶的适宜配比。
1 材料与方法
1.1 试验动物及饲料原料
选用健康、体重[(3.25±0.50)kg]基本一致的18周龄成年北京公鸭60只,随机分成3组,每组20只。根据本实验室禽用T型套管安装方法,在鸭空肠中部安装套管并进行相应的术后护理[7],试验期间试验鸭均饲喂基础饲粮。为了考察模拟鸭肠液消化能力的差异,选择3种常用饲料原料即玉米、豆粕和小麦麸。采用四分法取样后用万能粉碎机粉碎并过60目筛,充分混合均匀,贮存于样品瓶中-20℃保存备用。饲料原料和基础饲粮组成及营养水平见表1。
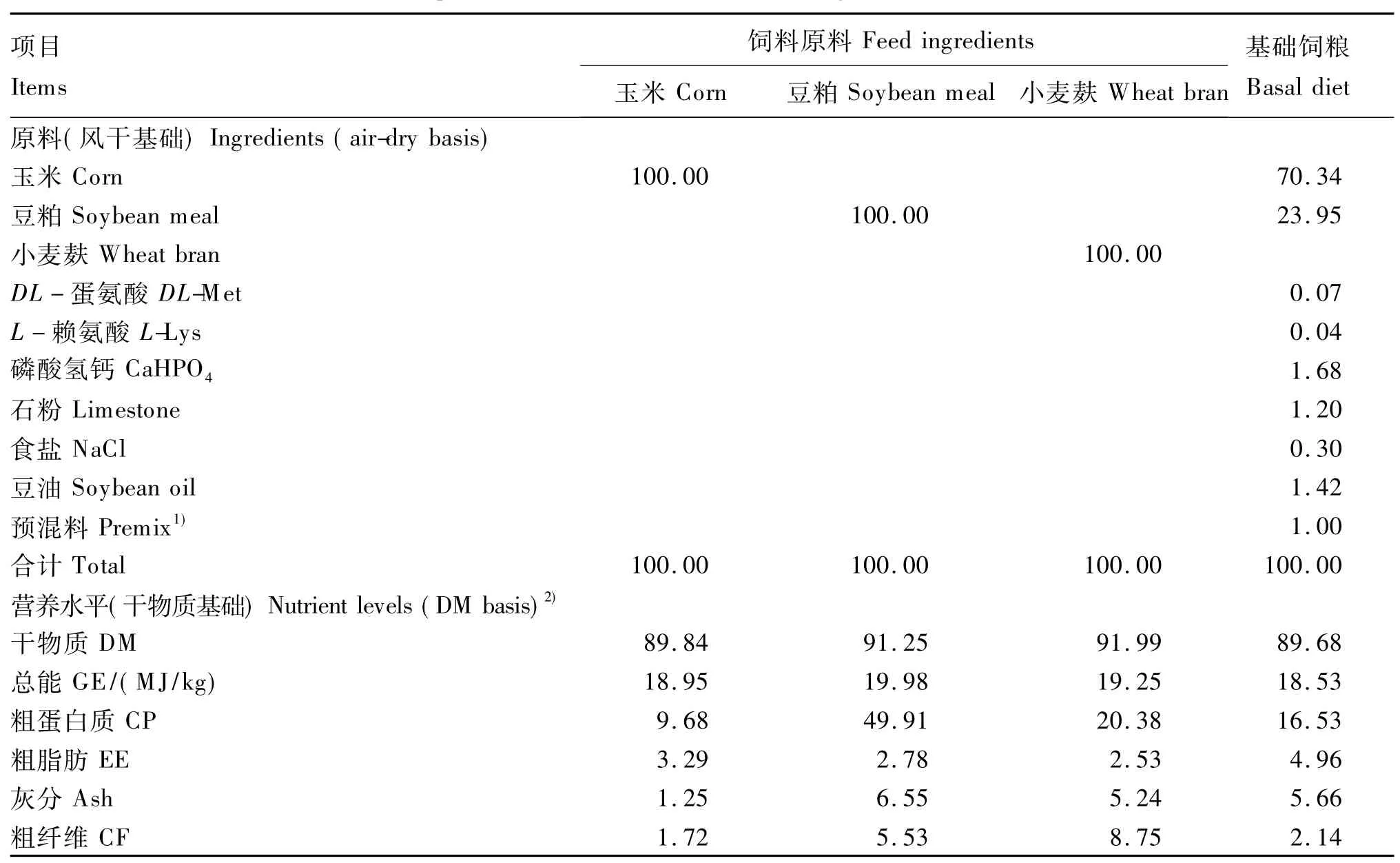
表1 饲料原料和基础饲粮组成及营养水平Table 1 Composition and nutrient levels of feed ingredients and the basal diet %
1)预混料为每千克饲粮提供The premix provided the following per kg of diet:VA 2 500 IU,VD 400 IU,VE 10 IU,VK30.5 mg,VB11.8 mg,VB24.0 mg,VB63.0 mg,VB120.007 mg,泛酸 pantothenic acid 11.0 mg,烟酸 nicotinic acid 55.0 mg,叶酸 folic acid 0.5 mg,生物素 biotin 0.12 mg,氯化胆碱 choline chloride 750 mg,Cu(as copper sulfate)8.0 mg,Fe(as ferrous sulfate)80.0 mg,Zn(as zinc sulfate)40.0 mg,Mn(as manganese sulfate)60.0 mg,Se(as sodium selenite)0.15 mg,I(as potassium iodide)0.35 mg。
2)营养水平为实测值。Nutrient levels were measured values.
1.2 鸭肠液酶粉剂的制备
试验鸭在安装套管术后恢复30 d后,采用隔日重复采样的方法于 09:30—10:30、13:30—14:30、17:30—18:30通过收集瓶在低温条件下(0~4℃)收集鸭空肠食糜,摇匀后全部转移至250 mL离心瓶中,于4℃、3 000 r/min条件下离心10 min,取上清液装于1 000 mL样品瓶中,-20℃保存备用。待3个试验组分别收集到3 000 mL肠液后,4℃下解冻,过200目尼龙滤布,然后经全自动蛋白质透析纯化系统(型号PFS-1,自主研制)透析3 h去杂质后,再通过冷冻干燥机(LG J-4,北京亚泰科隆仪器技术有限公司)及乙醇脱脂冻干后得到鸭肠液酶粉剂。鸭肠液酶粉剂中主要消化酶及试剂酶的活性见表2。

表2 鸭肠液酶粉剂中主要消化酶及试剂酶的活性Table 2 Activities of main digestive enzymes in intestinal fluid dry powder of ducks and enzyme reagents U/g
1.3 试验设计
采用嵌套设计,其中独立变量为鸭肠液酶粉剂的批次来源,设3个处理水平,分别为鸭肠液酶粉剂批次1、2、3;嵌套变量为模拟鸭肠液中鸭肠液酶粉剂提供的消化酶活性比例(以胰蛋白酶为基础),设 4个处理水平,即 0(共用)、25%、50%、75%(表3)。为了保证所有模拟鸭肠液中淀粉酶、胰蛋白酶、糜蛋白酶的活性水平与鸭体内肠液相应消化酶的活性水平一致[4],各处理中,通过加入相应数量的试剂级消化酶以调节模拟鸭肠液中主要消化酶的活性。利用单胃动物仿生消化系统(SDS-2),采用胃-小肠2阶段消化,每种饲料原料设5个重复,每个重复1根消化管。考察10个模拟鸭肠液制备处理对玉米、豆粕、小麦麸干物质消化率与酶水解物能值的影响。
1.4 测定方法
干物质、总能的测定分别参照GB/T 6435—2006、ISO 9831—1998的方法进行测定。仿生消化方法参照《单胃动物仿生消化系统操作手册》[8]。
1.5 数据计算与统计分析
干物质表观消化率(ADMD,%)=
[(M1-M2)/M1]×100;
酶水解物表观能值(AEHGE,MJ/kg)=[(E1- E2)/M1]/1 000;干物质真消化率(TDMD,%)=[(M1-
M2+M0)/M1]×100;
酶水解物真能值(TEHGE,MJ/kg)=
[(E1- E2+E0)/M1]/1 000。
式中:M1为饲料原料样品干物质重量(g);M2为残渣干物质重量(g);M0为消化酶干物质残留量(g);E1为饲料原料样品总燃烧热值(J);E2为残渣总燃烧热值(J);E0为消化酶干物质残留量总能值(J)。
根据嵌套设计,采用SAS 9.0统计软件中的MEANS模块对 ADMD、AEHGE、TDMD、TEHGE的基本统计量进行计算,GLM模块对数据进行方差分析,以Duncan氏法对独立变量内嵌套变量间模拟鸭肠液对饲料原料的干物质消化率和酶水解物能值进行多重比较,结果以平均值±标准差表示。
2 结果
2.1 模拟鸭肠液中鸭肠液酶粉剂的批次来源及活性贡献对饲料原料干物质消化率的影响
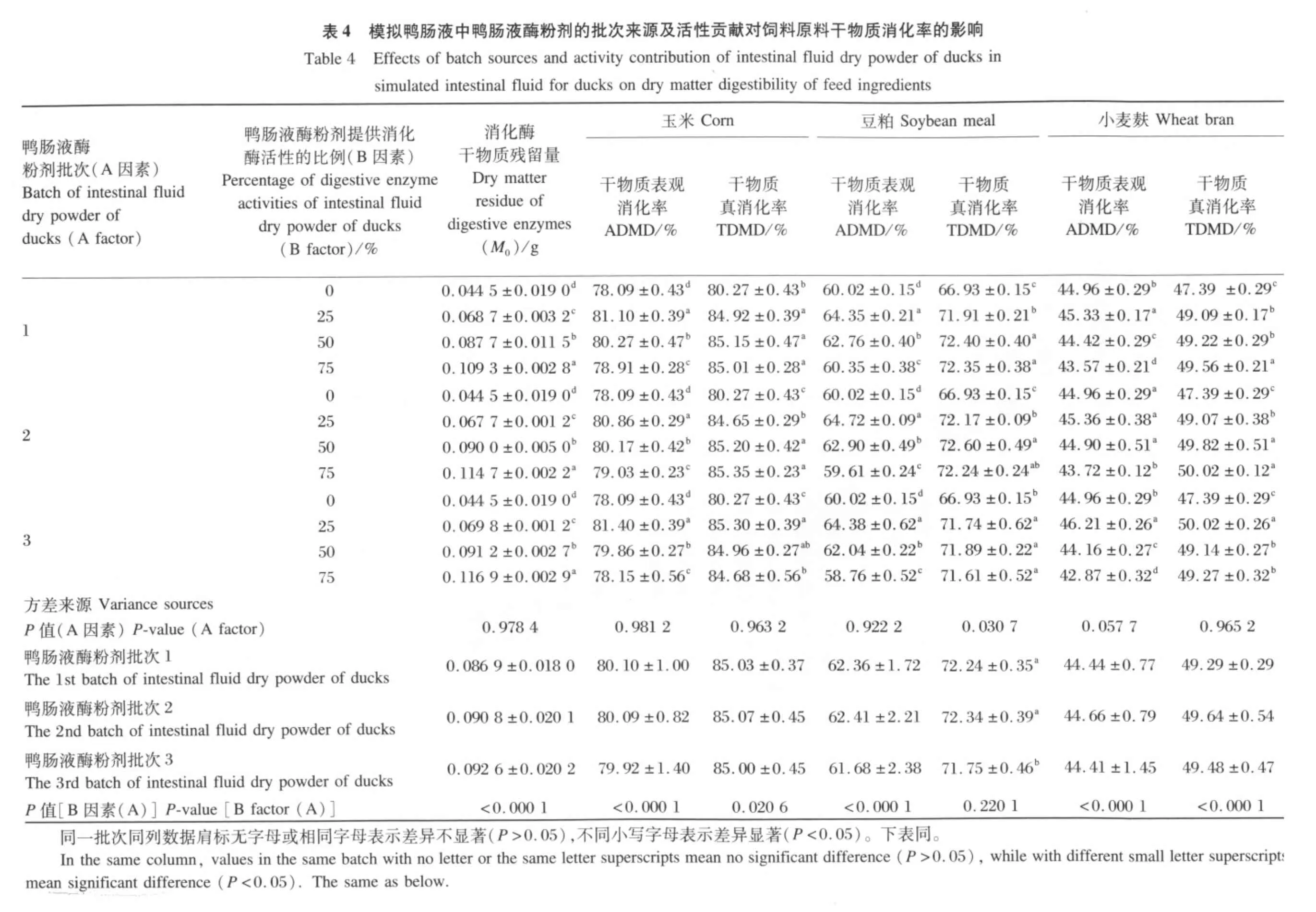
由表4可知,在模拟鸭肠液的消化酶来源对仿生消化中消化酶干物质残留量的影响上,3个批次的鸭肠液酶粉剂的平均酶残留量为0.086 9~0.092 6 g/样,批次间无显著性差异(P>0.05)。在模拟鸭肠液中,同一鸭肠液酶粉剂批次内均呈现出随着鸭肠液酶粉剂提供的消化酶活性的比例从25%增加到75%时,仿生消化中消化酶干物质残留量依次显著递增,从0.067 7 g/样增加到0.116 9 g/样(P<0.05),且都显著高于试剂酶制备的模拟鸭肠液的消化酶干物质残留量(P<0.05)。这与本试验中纯化的鸭肠液酶粉剂中有活性的消化酶含量不高,杂质含量较高的材料状况相对应(表2)。
在模拟鸭肠液的消化酶来源对饲料原料干物质消化率的影响上,3个批次的鸭肠液酶粉剂制备的模拟鸭肠液对玉米的干物质表观消化率(79.92%~80.10%)与真消化率(85.00% ~85.07%)均无显著影响(P>0.05);对豆粕的干物质表观消化率(61.68% ~62.41%)无显著影响(P>0.05),但对其真消化率(71.75% ~72.24%)有显著影响(P<0.05);对小麦麸的干物质表观消化率(44.41% ~44.66%)和真消化率(49.29% ~49.64%)均无显著影响(P>0.05)。由于本试验3个批次的鸭肠液酶粉剂制备的模拟鸭肠液对玉米、豆粕、小麦麸的干物质表观消化率与真消化率的最大相对差值都在0.75%以内,处于SDS-2的测试精度范围内[12],因此,认为3个批次鸭肠液酶粉剂制备的模拟鸭肠液在消化能力上是接近的。
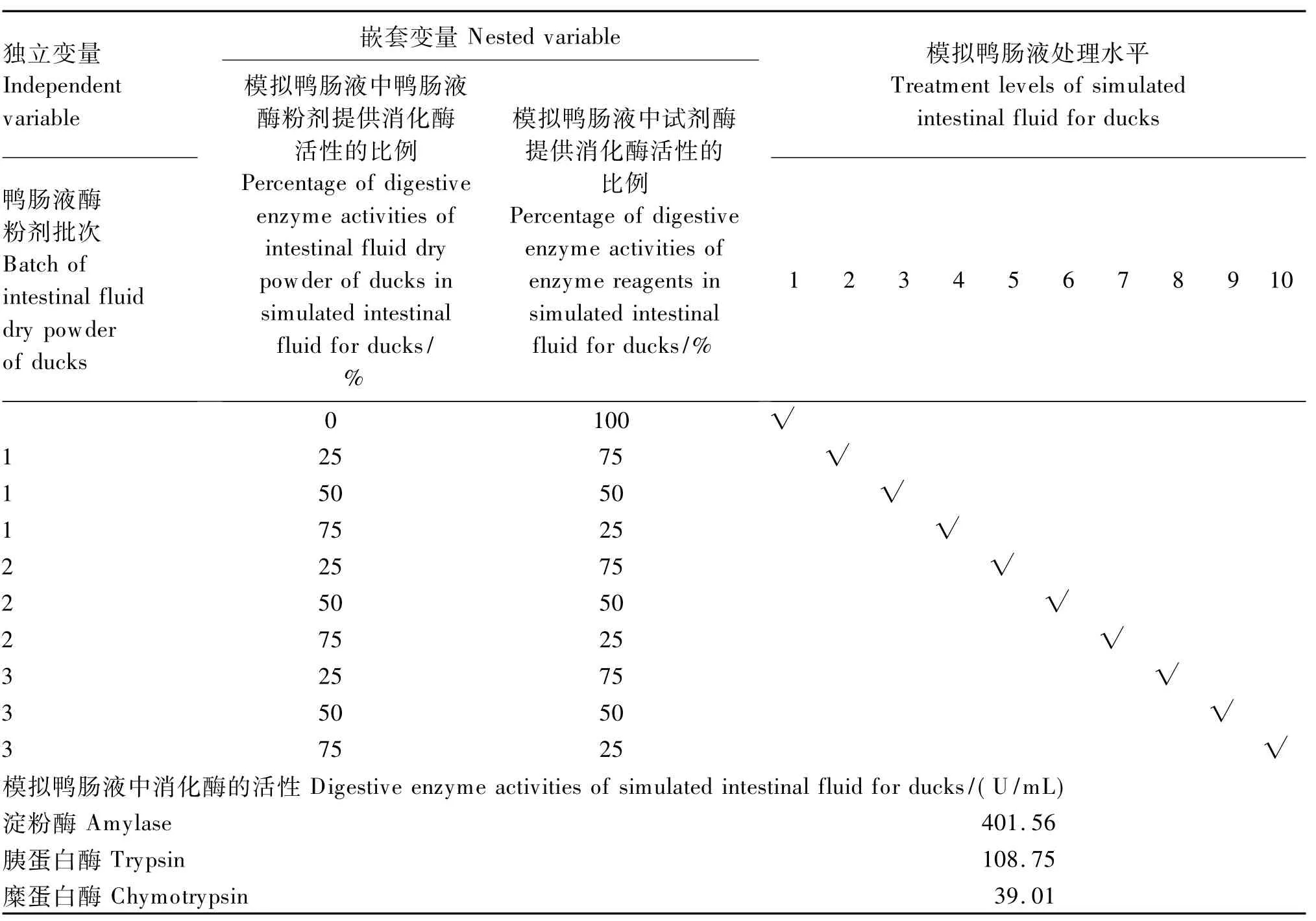
表3 试验设计与模拟鸭肠液处理水平Table 3 Experimental design and treatment levels of simulated intestinal fluid for ducks
模拟鸭肠液中消化酶的活性按照220 mL体积计算。The digestive enzyme activities of simulated intestinal fluid for ducks were measured in 220 mL.
在模拟鸭肠液中,同一鸭肠液酶粉剂批次内均呈现出随着鸭肠液酶粉剂提供的消化酶活性的比例从25%增加到75%时,模拟鸭肠液对玉米、豆粕、小麦麸的干物质表观消化率依次显著下降(P<0.05),但干物质真消化率相对稳定(最大绝对差值0.95%,相对差值0.95%),且干物质真消化率均显著地高于由试剂酶制备的模拟鸭肠液对这3种饲料原料的干物质真消化率(P<0.05)。这表明,模拟鸭肠液中鸭肠液酶粉剂提供的消化酶活性的比例从25%增加到75%时,其对饲料干物质的消化能力是比较稳定的,以鸭肠液酶粉剂为基础制备的模拟鸭肠液比由3种主要消化酶试剂制备的模拟鸭肠液对饲料干物质的消化能力高。
2.2 模拟鸭肠液中鸭肠液酶粉剂的批次来源及活性贡献对饲料原料酶水解物能值的影响
由表5可知,在模拟鸭肠液的消化酶来源对仿生消化中消化酶干物质残留量总能值的影响上,3个批次的鸭肠液酶粉剂的消化酶干物质残留量总能值为877.10~940.50 J/样,批次间无显著性差异(P>0.05)。在模拟鸭肠液中,同一鸭肠液酶粉剂批次内均呈现出随着鸭肠液酶粉剂提供的消化酶活性的比例从25%增加到75%时,仿生消化中消化酶干物质残留量总能值依次显著递增,从613.25 J/样增加到1 120.13 J/样(P<0.05),且都显著高于试剂酶制备的模拟鸭肠液的消化酶干物质残留量总能值(P<0.05),这与鸭肠液酶粉剂添加量的变化趋势是相对应的。
在模拟鸭肠液的消化酶来源对饲料原料酶水解物能值的影响上,3个批次的鸭肠液酶粉剂制备的模拟鸭肠液对玉米的酶水解物表观能值(16.21~16.33 MJ/kg)与真能值(16.74~16.85 MJ/kg)、豆粕的酶水解物表观能值(14.25~14.32 MJ/kg)与真能值(15.26~15.35 MJ/kg)、小麦麸的酶水解物表观能值(9.03~9.17MJ/kg)与真能值(9.53~9.65 MJ/kg)均无显著影响(P>0.05),且其差值均在SDS-2的测试精度范围内[12],这进一步证明了不同批次来源的鸭肠液酶粉剂制备的模拟鸭肠液的消化能力是接近的。
在同一鸭肠液酶粉剂批次制备的模拟鸭肠液内,随着鸭肠液酶粉剂提供的消化酶活性的比例从25%增加到75%时,模拟鸭肠液对玉米、豆粕、小麦麸的酶水解物表观能值均呈显著性递减(P<0.05),对酶水解物真能值间也有显著性影响(P<0.05),但鸭肠液酶粉剂提供的消化酶活性的比例从25%增加到50%范围内,模拟鸭肠液对玉米、豆粕、小麦麸的酶水解物真能值相对稳定(最大绝对差值0.17 MJ/kg,相对差值0.89%),与鸭肠液酶粉剂贡献75%的消化酶活性时配制的模拟鸭肠液的对应值有较大差异,且均显著高于由试剂酶制备的模拟鸭肠液对这3种饲料原料的酶水解物真能值(P<0.05)。这表明,模拟鸭肠液中鸭肠液酶粉剂提供的消化酶活性的比例从25%增加到50%时,其对饲料有机物的消化能力是比较稳定的。
3 讨论
3.1 模拟鸭肠液中鸭肠液酶粉剂的批次来源对饲料原料消化能力的影响
在体外模拟消化中,主要消化酶的动物种属来源可能会影响消化液所表现的综合酶学特性。据Irene等[9]报道,从生长猪与肉鸡体内获得的胃蛋白酶在酶学特性(针对不同底物的最适pH、消化能力)上存在着较大的差异。然而,长期以来,人们在家禽体外模拟消化方法的研究上,都采用猪小肠液[10-11]或猪胰液素[12]等猪源性消化酶来模拟家禽的小肠液。这种方法制备的家禽模拟小肠液可能与体内小肠液的酶学特性有一定偏差。为此,本实验室前期在建立了家禽肠道食糜的连续采集方法[7]、冷冻浓缩-透析-冷冻干燥制备鸭肠液酶粉剂的粗提纯方法[1]的基础上,研究了以鸭肠液酶粉剂为基础,通过加入少量试剂酶(淀粉酶、胰蛋白酶、糜蛋白酶、脂肪酶)制备的模拟鸭肠液的消化能力为对应消化酶活性的鸭体内空肠液消化能力的100.1%~101.8%(4种饲料原料,4种饲粮)[6]。由此表明,以鸭肠液酶粉剂为基础,通过调节几种主要消化酶的活性与体内肠液的消化酶活性相一致,可能是解决模拟鸭肠液同源性问题的有效手段。然而,以不同批次来源的鸭肠液酶粉剂为基础,通过调节几种主要消化酶的活性到同一水平制备的模拟鸭肠液是否具有相同的消化能力是检验通过该方法能否制备稳定模拟鸭肠液的关键问题之一。本试验中,以3个批次的鸭肠液酶粉剂为基础制备的模拟鸭肠液对玉米、豆粕和小麦麸3种饲料原料的干物质真消化率和酶水解物真能值的最大差异不超过0.60%,这一差异处于 SDS-2测试的系统误差范围之内[13]。由此可见,以不同批次来源的鸭肠液酶粉剂为主要酶源制备的模拟鸭肠液的消化能力是稳定的。
?

?
3.2 模拟鸭肠液中鸭肠液酶粉剂的活性贡献对饲料原料消化能力的影响
在模拟鸭肠液制备的消化酶活性的定量水平上,Valdes等[12]以4 mg/mL胰液素为主要酶源制备模拟鸡肠液,Clunies等[14]以猪小肠液(空肠食糜离心后的上清液)直接用于模拟鸡空肠液。这些制备方法除了在消化酶的种属同源性上与家禽体内的消化酶不同外,在消化酶的活性水平上也与动物体内肠液相差甚远,它们无法解决模拟消化液消化能力的重现性问题。本实验室前期研究了根据与鸭体内肠液中4种主要消化酶的活性相等的原则,通过4种试剂酶(淀粉酶、胰蛋白酶、糜蛋白酶、脂肪酶)制备模拟鸭肠液[4]。这种方法制备的模拟鸭肠液与对应体内肠液的消化能力虽然还有一定差距[6],但在模拟鸭肠液消化能力的重现性上,具有较好的重复性[13]。为了进一步提高模拟鸭肠液的仿真程度,本实验室研究了以鸭肠液酶粉剂为基础,通过加入少量试剂酶(淀粉酶、胰蛋白酶、糜蛋白酶、脂肪酶)制备的模拟鸭肠液与体内肠液的酶学特性非常接近[6]。在该方法中,鸭肠液酶粉剂与试剂酶各自贡献的消化酶活性占模拟鸭肠液消化酶总活性的比例在哪个范围内不会影响模拟消化液的消化能力是今后模拟鸭肠液制备规范的一个重要参数。从本试验的结果看,鸭肠液酶粉剂与试剂酶对模拟鸭肠液中消化酶总活性(以蛋白酶为基础)的贡献在25%和75%,50%和50%时,2种模拟鸭肠液对同一饲料原料的干物质真消化率和酶水解物真能值的差异均在0.88%、0.17 MJ/kg以内,这一差异处于SDS-2测试的系统误差范围之内[12]。而这2种模拟鸭肠液比75%和25%处理的模拟鸭肠液对饲料原料的干物质真消化率和酶水解物真能值分别高0.45%、0.67 MJ/kg。根据3个模拟鸭肠液的消化酶干物质残留量及对饲料原料的表观消化率的变化规律可以得出,75%和25%处理与其他2个处理的模拟鸭肠液对饲料原料的消化能力稍低可能与仿生消化中消化酶干物质残留的干扰有关。综合上述结果,鸭肠液酶粉剂对模拟鸭肠液中消化酶总活性的贡献在25%~50%就可以达到较好的模拟效果。与此同时也说明,鸭肠液酶粉剂还需要进一步纯化,以降低杂质对测试结果的干扰。
4 结论
①在模拟鸭肠液中,不同批次来源的鸭肠液酶粉剂对玉米、豆粕、小麦麸干物质消化率与酶水解物能值无显著性差异。
②在模拟鸭肠液内,鸭肠液酶粉剂对模拟鸭肠液中消化酶总活性的贡献在25%~50%时消化能力相对稳定。
[1] 胡光源.生长猪小肠仿生消化试剂设计依据的研究[D].硕士学位论文.北京:中国农业科学院,2010.
[2] BUCHMANN N B.In vitro digestibility of protein from barley and other cereals[J].Journal of the Science of Food and Agriculture,1979,30:583 -589.
[3] GAUTHER S F,VACHON C,SAVOIE L.Enzymatic conditions of an in vitro method to study protein digestion[J].Journal of Food Science,1986,51:960 -964.
[4] 赵峰.用酶法评定鸭饲料代谢能的方法学研究[D].博士学位论文.北京:中国农业科学院,2006.
[5] 郑卫宽.用仿生消化仪测定棉粕鸭真代谢能值的研究[D].硕士学位论文.北京:中国农业科学院,2009.
[6] 谢木林,赵峰,张宏福,等.鸭空肠液中全消化酶与主要消化酶体外总消化能力的比较研究[J].动物营养学报,2011,23(6):991 -997.
[7] 赵峰,张子仪,侯水生.鸭的空肠食糜连续采集方法及其空肠套管的设计[J].畜牧兽医学报,2006,37(7):672-675.
[8] 赵峰,张宏福,张子仪.单胃动物仿生消化系统操作手册[M].2版.北京:中国农业科学院,2011.
[9] IRENE C G,JOELLE G,JEAN P C,et al.Comparison of pig and chicken pepsins for protein hydrolysis[J].Reproduction Nutrition Development,1999,39:443-454.
[10] FURUYA S,SAKAMOTO K,TAKAHASHI S.A new in vitro method for the estimation of digestibility using the intestinal fluid of the pig[J].British Journal of Nutrition,1979,41:511 -520.
[11] SAKAMOTO K,ASANO T,FURUYA S,et al.Estimation of in vivo digestibility with the laying hen by an in vitro method using the intestinal fluid of the pig[J].British Journal of Nutrition,1980,43:389 - 391.
[12] VALDES E V,LEESON S.Measurement of metabolizable energy in poultry feeds by an in vitro system[J].Poultry Science,1992,59:359 - 363.
[13] 李辉.单胃动物仿生消化系统测定鸭饲料代谢能值的精度、变异因素及可加性研究[D].硕士学位论文.安徽:安徽农业大学,2010.
[14] CLUNIES M,LEESON S.In vitro estimation of dry matter and crude protein digestibility[J].Poultry Science,1984,63:89-96.

