鱼皮明胶蛋白膜的制备及其性质改良
陈书霖,陶 忠,吴菲菲,曹敏杰,翁武银
(集美大学生物工程学院,福建厦门361021)
鱼皮明胶蛋白膜的制备及其性质改良
陈书霖,陶 忠,吴菲菲,曹敏杰,翁武银
(集美大学生物工程学院,福建厦门361021)
利用罗非鱼鱼皮提取明胶制备蛋白膜,考察了浸提条件和戊二醛的添加对明胶蛋白膜性质的影响.结果表明,利用罗非鱼鱼皮可以制备成无色透明的明胶蛋白膜.在80℃水浴条件下,伴随着明胶浸提时间的延长,膜的抗拉伸强度 (TS)出现先上升后下降的趋势,在浸提时间为1.0 h时达到最大值.而膜的断裂延伸率 (EAB)和水蒸气透过率 (WVP)则随着浸提时间的增加而下降.然而,浸提时间对膜的透光率没有显著影响.另一方面,当利用质量分数为1%~4%(相对明胶蛋白)的戊二醛对蛋白膜进行改性时,膜的TS、EAB、WVP和溶解性均明显下降,而蛋白膜的色泽变黄,紫外线阻隔能力增强.利用SDS-PAGE分析发现,戊二醛的添加会使明胶分子发生交联反应,且反应更易在高分子成分之间发生.
罗非鱼;鱼皮;明胶;蛋白膜;戊二醛;理化性质
0 引言
近年来,塑料包装材料引起的食品安全问题逐渐受到关注,因此利用蛋白质、多糖、脂质等天然高分子材料制备可食性/可降解性包装膜将成为社会发展的必然趋势.另一方面,我国淡水鱼年养殖产量已经超过2×107t[1],加工中必然会产生大量的鱼皮、鱼鳞等下脚料.据报道,鱼皮中含有丰富的蛋白质,其含量甚至高于鱼肉,而且80%以上的蛋白质属于胶原蛋白[2].但目前鱼类加工下脚料主要是被用来生产饲料等低附加值产品,并没有得到有效利用.
明胶是胶原通过热变性衍生而来的产物,具有良好的成膜能力,在国际上作为蛋白可食膜制备材料日益受到广泛重视.有研究报道,利用热水提取的鱼皮明胶也具有良好的成膜性能[3].然而,有关鱼皮明胶蛋白膜的研究目前主要集中在鲈鱼[3]、金枪鱼[4]、大眼鲷[5]、鳕鱼[6]等大型海水鱼.近年来有学者尝试利用大型淡水鱼斑点叉尾 鱼皮制备明胶蛋白膜,结果发现其机械性能不仅优于海水鱼鱼皮明胶蛋白膜,甚至可以接近来源于哺乳动物的明胶蛋白膜[7].
罗非鱼具有生长快、肉质好、易养殖等特点,已成为联合国粮农组织六大主食之一.根据渔业年鉴统计数据,2010年我国的罗非鱼加工量已经接近6×105t[1].在罗非鱼鱼片加工中产生的鱼皮下脚料,不仅没有残余的鱼肉黏附,而且脂肪含量低于猪皮、牛皮.然而,关于利用罗非鱼鱼皮制备明胶蛋白膜的研究却鲜有报道.因此,本文利用罗非鱼鱼皮提取明胶制备蛋白膜,考察明胶蛋白的提取条件以及戊二醛的添加对蛋白膜性质的影响,探讨罗非鱼鱼皮加工利用的新途径.
1 材料与方法
1.1 材料与试剂
原料:新鲜的尼罗罗非鱼鱼皮由厦门同安源水水产食品有限公司提供.
主要试剂:甘油,AR,国药集团化学试剂有限公司;25%戊二醛溶液,AR,国药集团化学试剂有限公司;氢氧化钠,AR,广东光华化学厂有限公司;盐酸,AR,西陇化工股份有限公司;DC蛋白测定试剂盒,美国Bio-Rad公司.
1.2 主要仪器
Avanti J-25高速冷冻离心机 (美国Beckman公司);PSX智能型恒温恒湿箱 (宁波莱福科技有限公司);厚度仪 (日本Ozaki MFG公司);TMS-PRO质构仪 (美国Food Technology公司);UV-2600A型紫外分光光度计 (上海元析仪器有限公司);WSC-S测色色差计 (上海精密科学仪器有限公司);UM113型搅拌脱泡机 (日本Unix有限公司).
1.3 实验方法
1.3.1 鱼皮明胶提取
罗非鱼鱼皮通过0.05 mol/L NaOH在4℃下浸泡16 h,清水漂洗,利用0.05 mol/L HCl在室温下浸泡2 h,用蒸馏水漂洗至中性,然后利用80℃热水浸提制备.
1.3.2 鱼皮明胶蛋白膜的制备
明胶蛋白膜参考翁武银等[8]报道的方法进行制备.将明胶蛋白质量浓度调配成2%,甘油浓度按照蛋白质含量的20%添加后,利用搅拌脱泡机对其脱泡后调制成明胶蛋白膜液.将制备的膜液(4 g)倒在5 cm×5 cm的有机硅树脂框内,利用恒温恒湿箱,在(25±1)℃、相对湿度 (RH)为(50±5)%下干燥24 h后制备成明胶蛋白膜.将膜从有机硅树脂上小心剥离后,在(25±1)℃、RH为(50±5)%的恒温恒湿箱中调节24 h后,作为实验的测试样品.
另外,为了研究戊二醛的添加对明胶蛋白膜性质的影响,在可食膜的膜液中添加了质量分数为1%~4%(相对明胶蛋白)的戊二醛后,按照上述方法制备成明胶蛋白膜.
1.3.3 蛋白膜机械性能的测定
将切成宽20 mm、长45 mm的膜用厚度仪测定厚度,利用质构仪,间隔30 mm,拉伸速率1 mm/s进行拉伸试验.蛋白膜的抗拉伸强度 (TS)按照以下公式进行计算:TS(MPa)=F/S,其中:F为膜断裂时承受的最大张力 (N);S为膜的横断面积 (m2).断裂伸长率 (EAB)按照以下公式进行计算:EAB(%)=(E/30)×100,其中E为膜断裂时被拉伸的长度 (mm).
1.3.4 蛋白膜水蒸气透过率的测定
蛋白膜水蒸气透过率根据ASTM的方法进行测定[9].在瓶口内径2.2 cm的50 mL PET瓶中加入约40 g干燥硅胶,用蛋白膜封紧瓶口使膜与瓶口之间不留缝隙.然后将PET瓶置于30℃、RH为100%的玻璃干燥器中,每隔1 h测定PET瓶的质量.膜的水蒸气透过率WVP(g·m-1·s-1·Pa-1)=△m·d·A-1·t-1·△P-1,其中:△m为t时间内瓶的质量增加量 (g);d为膜的厚度 (m);A为瓶口面积 (m2);t为测定时间 (s);△P为膜两侧的水蒸气压差 (Pa).
1.3.5 蛋白膜颜色和透明度的测定
蛋白膜的颜色利用WSC-S测色色差计进行测定.膜的颜色参数为:L*(黑-白),a*(绿-红),b*(蓝-黄),其中白板的参数为:L*=91.86,a*=-0.88,b*=1.42.
1.3.6 蛋白膜的蛋白溶解率和固形物溶解率的测定
将明胶蛋白膜放在装有质量分数为0.1%的叠氮钠水溶液的锥形瓶中,在室温下震荡24 h后,未溶解的蛋白膜利用105℃常压干燥测定其质量,溶解在水中的蛋白质含量利用Lowry法[10]进行测定.其中,蛋白膜中的水分含量通过105℃常压干燥进行测定,总蛋白质含量利用凯氏定氮法进行测定.蛋白溶解率为溶解的蛋白质质量占膜中蛋白质质量的百分数.蛋白膜固形物溶解率按照溶解的蛋白膜干重占原始膜干重的百分数.
1.3.7 SDS-聚丙烯酰胺凝胶电泳 (SDS-PAGE)
明胶蛋白膜利用质量分数为2%的SDS、8 mol/L尿素、20 mmol/L Tris-HCl(pH=8.8)蛋白变性剂进行溶解后,溶解的蛋白质利用质量分数6%的分离胶在8 mA电流下进行电泳,电泳结束后用考马斯亮蓝R-250染色液染色,最后用脱色液(V(甲醇)∶V(乙酸)∶V(水)=30∶10∶60)脱色到背景完全透明为止.
1.3.8 数据统计与分析
所有数据采用SPSS 16.0软件分析,用ANOVA进行方差分析,显著性检验方法为邓肯多重检验,检测限为0.05[11].有关数据为3次以上平均值.
2 结果与讨论
2.1 浸提时间对明胶膜性质的影响
由前期的预实验结果可知,鱼皮明胶蛋白的提取率随着温度的升高而逐渐增大,但是在100℃浸提的过程中明胶蛋白在短时间内就会发生降解.因此,本研究将以80℃水浴浸提明胶蛋白并考察浸提时间对膜性质的影响.
2.1.1 蛋白膜的机械性能和水蒸气透过率
罗非鱼鱼皮明胶蛋白膜的TS、EAB以及WVP的测定结果如表1所示.由表1可见,随着浸提时间的延长,利用80℃热水浸提的罗非鱼鱼皮明胶制备成的蛋白膜,其TS呈现先上升后下降的趋势.同时还可以发现,浸提1.0 h的鱼皮明胶制备成的蛋白膜的TS达到最大值,超过了鲨鱼皮明胶蛋白膜(TS=34 MPa)的机械强度[8],达到了PVDC塑料膜(TS=65.6 MPa)的水平[12].另一方面,随着明胶浸提时间的延长,鱼皮明胶蛋白膜的EAB出现先下降后上升的趋势.通常,TS与EAB之间存在负相关关系[13],在本研究中也发现了同样的现象.
从表1还可以发现,鱼皮明胶蛋白膜的WVP随着浸提时间的延长呈现下降的趋势,WVP的测定值集中在(1.67 ~2.13)×10-10g·m-1·s-1·Pa-1,低于大眼鲷鱼鱼皮制备的明胶蛋白膜[3].一般情况下,胶原在水和热的作用下,会发生氢键断裂,三股螺旋结构解体,还会出现轻度的水解现象[14-15].在明胶凝胶成膜过程中,水解生成的小分子物质将进入高分子形成的网络结构的空隙中,增强膜阻隔水分子穿透的性能,结果导致膜的WVP下降.
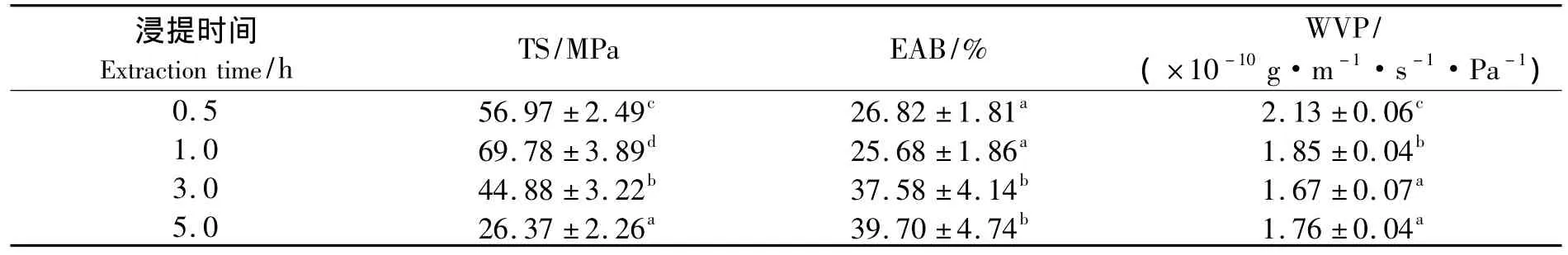
表1 浸提时间对蛋白膜的TS、EAB和WVP的影响Tab.1 Effect of extraction time on TS,EAB and WVP of fish skin gelatin films
2.1.2 蛋白膜的透光率
表2给出了明胶浸提时间对蛋白膜在波长200~800 nm范围内透光率的影响.由表2可知,罗非鱼鱼皮明胶蛋白膜在紫外区 (200~280 nm)的透光率范围为23.85%~30.74%,这与以甘油作为增塑剂制备的大眼鲷、红鲷鱼鱼皮明胶膜的27.5% ~29.5%相类似[3],但鱼肉蛋白膜在紫外区的透光率几乎为0[12].其原因主要是:鱼肉蛋白中富含苯丙氨酸、酪氨酸、色氨酸等芳香族氨基酸残基,在280 nm波长附近具有强烈吸收紫外线的能力[16],而明胶蛋白中缺乏芳香族氨基酸.此外,从表2还可以看出,在可见光范围内(400~800 nm)明胶蛋白膜具有较高的透光率,并且浸提时间对蛋白膜的透光率没有明显的影响.
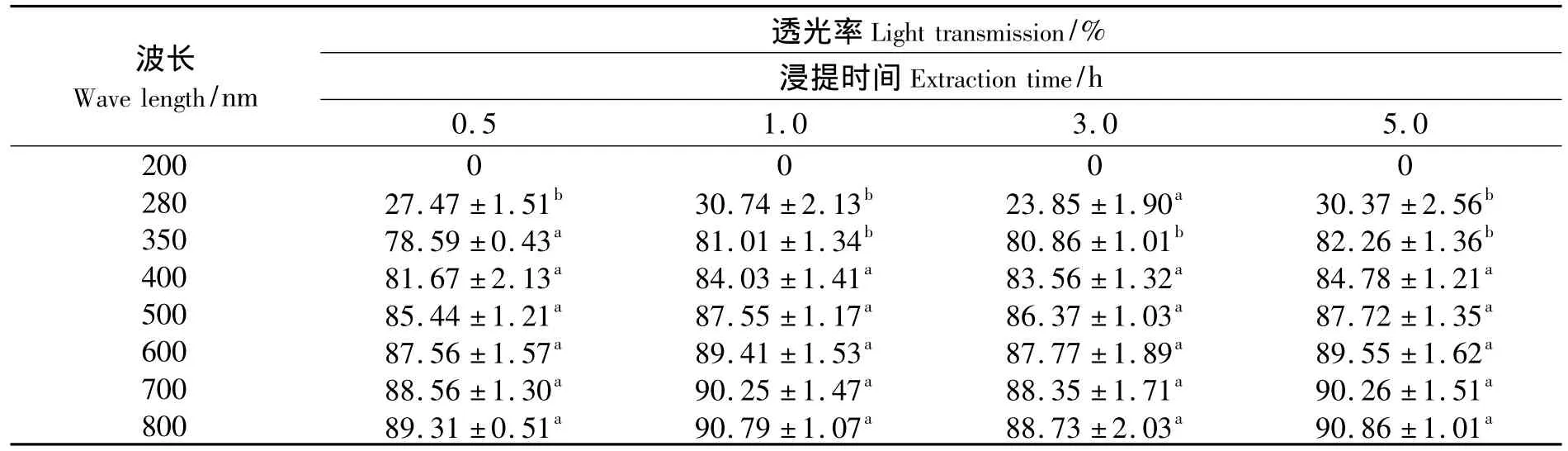
表2 浸提时间对鱼皮明胶蛋白膜的透光率的影响Tab.2 Effect of extraction time on light transmission of fish skin gelatin films
2.1.3 蛋白膜的颜色
通常,蛋白膜的颜色对于消费者可接受程度起着重要作用[17].表3显示的是明胶浸提时间对蛋白膜色泽影响的测定结果.由表3可知,蛋白膜的L*值和b*值都随着浸提时间的延长出现一定程度的上升趋势,a*值没有发现明显的变化.然而,不同浸提时间下制备的蛋白膜的L*、a*、b*值和白板都比较接近,表明本研究中的鱼皮明胶蛋白膜在外观上基本是无色.相对大豆蛋白膜[18](L*=53)的颜色,本研究制备明胶蛋白膜的颜色更接近白色,将使鱼皮明胶蛋白膜在色泽方面更具有优势.
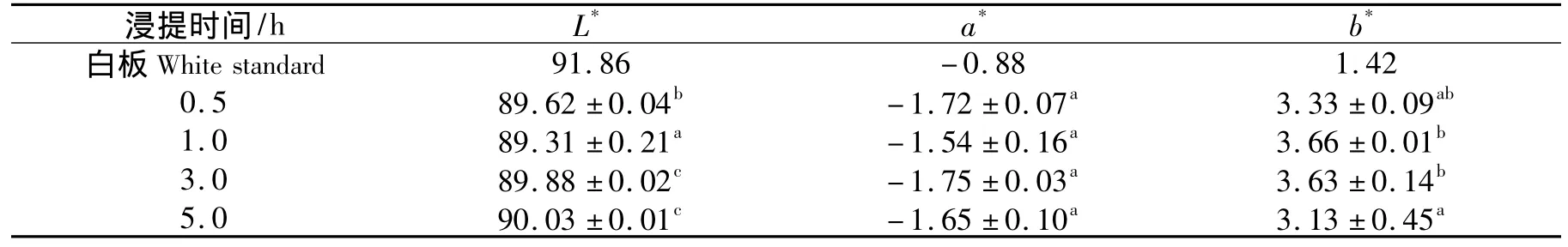
表3 浸提时间对鱼皮明胶蛋白膜颜色的影响Tab.3 Effect of extraction time on color values of fish skin gelatin films
2.1.4 蛋白膜的SDS-PAGE
为了了解浸提时间对明胶蛋白膜机械性能影响的机制,利用SDS-PAGE对罗非鱼鱼皮明胶蛋白膜中的蛋白质组分进行了分析,其结果如图1所示.由图1可见,在80℃下浸提0.5 h和1.0 h制备的明胶蛋白膜中,不仅可以观察到γ链、β链、α1链以及α2链等蛋白质成分,还可以观察到高于γ链和无法进入分离胶的高分子蛋白质成分.然而,随着浸提时间的延长,α链以上的高分子蛋白质开始发生降解,出现低于α2链的小分子降解产物.通常,在可食膜中成膜材料的高分子质量的组分越多,膜的机械强度越大[3],这与本研究的结果基本一致 (见表1、图1).虽然浸提0.5 h和1.0 h对明胶蛋白膜中的主要蛋白质组分没有明显的影响,但利用浸提1.0 h的明胶制备成的蛋白膜其TS明显大于0.5 h的 (见表1).这可能是因为适度的加热可以保留完整的亚基组分,更有利于在明胶凝胶成膜过程中交联形成类三股螺旋结构,进而增强膜的TS(见表1).当加热时间达到3.0 h以上时,明胶蛋白出现明显降解 (见图1),结果导致膜的TS下降 (见表1).因此,控制好鱼皮明胶蛋白的浸提时间对于制备明胶蛋白膜具有重要作用.
基于以上结果,罗非鱼鱼皮经过酸碱处理后,利用80℃热水浸提的明胶可以制备成无色透明的蛋白膜,当浸提时间为1.0 h时可以获得机械性能良好的蛋白膜.然而,由于明胶的凝胶性能属于热可逆性,利用鱼皮制备的明胶蛋白膜存在易溶于水的缺陷,本文还将尝试采用戊二醛交联剂探讨改良罗非鱼鱼皮明胶蛋白膜的性能.
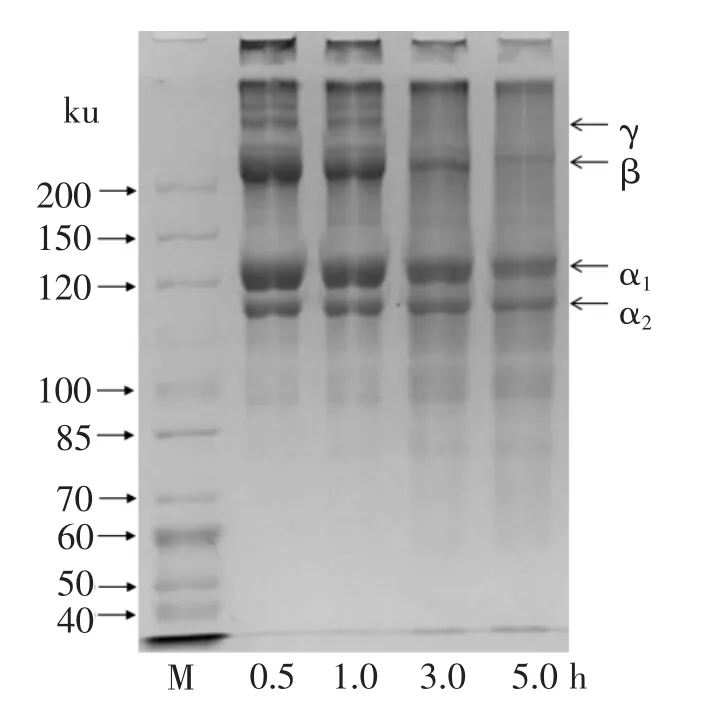
图1 不同浸提时间下鱼皮明胶蛋白膜电泳分析Fig.1 Protein pattern of films prepared from fish skin gelatin extracted for different time
2.2 戊二醛对明胶膜性质的影响
2.2.1 戊二醛对明胶蛋白膜机械性能和水蒸气透过率的影响
表4给出了戊二醛添加量对明胶蛋白膜的TS、EAB和WVP影响的测定结果.由表4可知,随着戊二醛的添加,明胶蛋白膜的TS逐渐呈现下降的趋势,当添加量增加到蛋白质质量分数的4%时,膜的TS下降了21%.另一方面,明胶蛋白膜的EAB也随着戊二醛添加而下降.由于戊二醛可以促进明胶中ε-氨基酸残基相互之间发生交联,形成多个蛋白质分子交接的网络结构[19],因此经常被应用于蛋白膜的性质改良.研究表明,戊二醛可以提高大豆蛋白膜的机械性能[18],但对阿拉斯加鳕鱼鱼皮明胶蛋白膜[20]的机械性能却没有显著影响.而且林海莉等[21]研究戊二醛添加对动物明胶膜性质影响时发现,少量的戊二醛可以提高膜的TS,而过量会导致膜的TS下降.因此,戊二醛对蛋白膜性质的影响不仅跟蛋白质的种类有关,而且跟戊二醛的添加量也有关系.
另一方面,伴随着戊二醛的添加,明胶蛋白膜的WVP也呈现出下降的趋势 (见表4).通常,水蒸气可以从蛋白膜的孔隙中穿过,也可以与蛋白膜的亲水基结合后移动穿过,因此蛋白膜的水蒸气阻隔能力与膜的网络结构致密程度以及亲水基含量具有一定的相关性.黄曼等[22]利用戊二醛对大豆分离蛋白进行改性,结果发现蛋白质的疏水性有提高的倾向.因此,根据表4的结果,可以推测,添加戊二醛可能促使蛋白质的亲水基团之间发生交联,结果导致膜的WVP下降.
2.2.2 戊二醛对膜透光率的影响
戊二醛添加量对罗非鱼鱼皮明胶蛋白膜透光率的影响结果如表5所示.由表5可知,在280 nm波长下,随着戊二醛添加量的增加,膜的透光率出现显著下降.据报道,戊二醛与明胶蛋白反应生成的吡啶高价正离子盐衍生物在240~270 nm范围对紫外光有较强的吸收[23].因此,经过戊二醛改性后明胶蛋白膜的紫外线阻隔能力得到明显的提高.另一方面,在400~800 nm的可见光范围内,戊二醛的添加对蛋白膜的透光率没有产生明显的影响.因此,本研究结果表明,利用戊二醛改性的明胶蛋白膜作为食品包装材料在阻碍紫外线诱导的油脂氧化作用方面具有一定的优势,可用于包装对紫外线敏感的食品,且其透明性还可以让消费者观察到内装食品的状态.
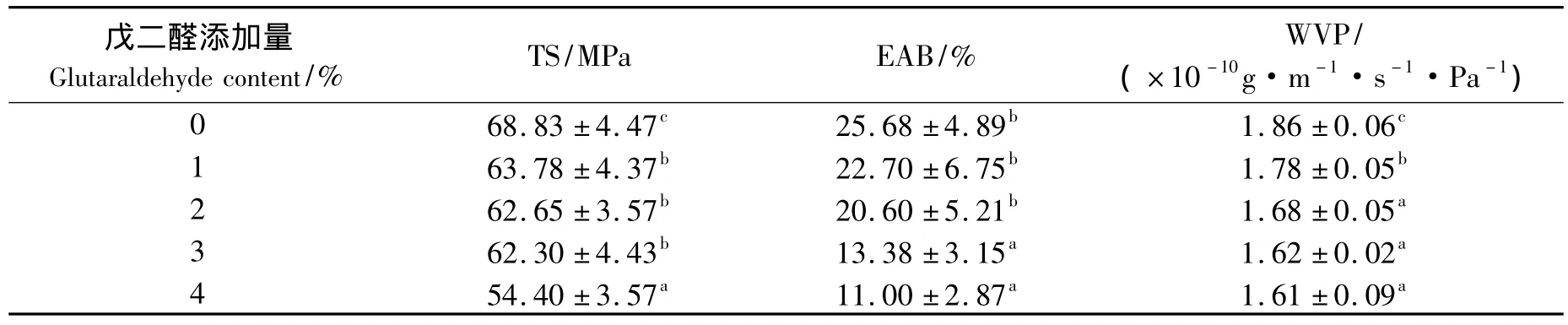
表4 戊二醛添加量对明胶蛋白膜的TS、EAB和WVP的影响Tab.4 Effect of glutaraldehyde content on TS,EAB and WVP of gelatin films
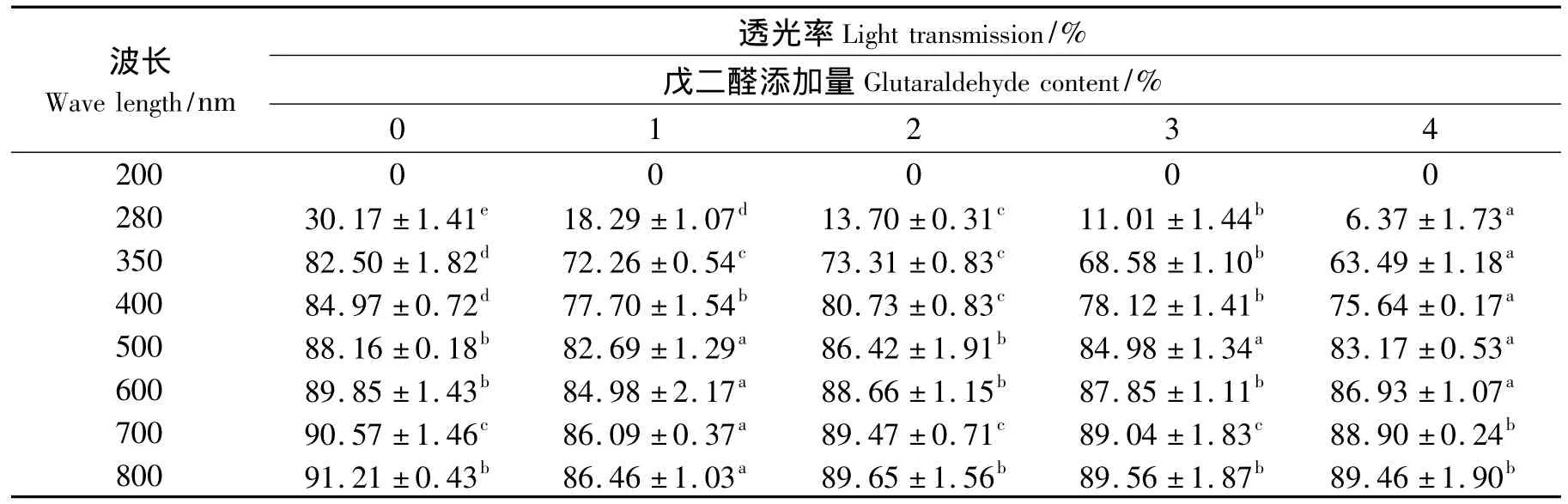
表5 添加戊二醛对蛋白膜的透光率的影响Tab.5 Effect of glutaraldehyde on light transmission of gelatin films
2.2.3 戊二醛对膜颜色的影响
表6显示的是戊二醛添加量对明胶蛋白膜颜色的影响.由表6可知,随着戊二醛的增加,L*值逐渐下降,a*值没有明显变化,b*值明显上升,说明添加戊二醛会使明胶蛋白膜的色泽变深、变黄.通常,醛类物质的羰基容易和蛋白质的氨基发生美拉德反应.因此,戊二醛添加量越多,干燥成膜过程中戊二醛和明胶蛋白之间的美拉德反应也越剧烈,结果导致明胶蛋白膜变得越黄.
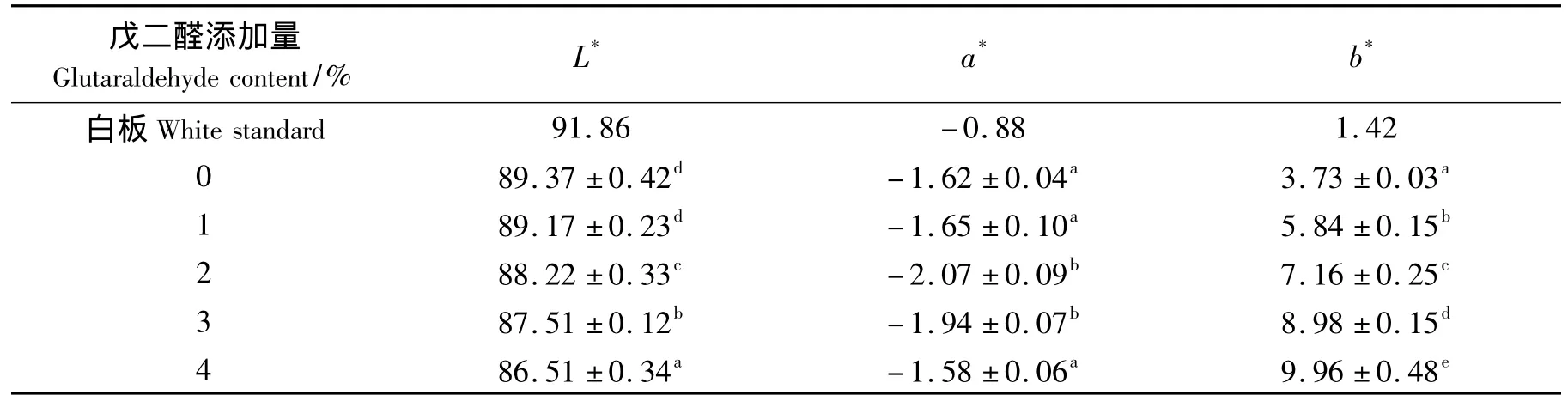
表6 添加戊二醛对鱼皮明胶蛋白膜颜色的影响Tab.6 Effect of glutaraldehyde on color values of gelatin films
2.2.4 戊二醛对膜溶解性的影响
为了评价改性明胶蛋白膜的耐水性能,对膜的蛋白溶解率和固形物溶解率进行了测定,结果如表7所示.从表7中可以看出,经过戊二醛改性明胶蛋白膜的蛋白溶解率、固形物溶解率都出现了显著的下降.添加蛋白质质量分数为1%的戊二醛可以使膜的蛋白溶解率、固形物溶解率分别下降了92.0%、71.8%,类似于McPherson等[24]报道的戊二醛处理后胶原纤维溶解度下降的结果.通常,蛋白膜的溶解率和交联度是成反比的,也就是说交联程度越高,膜的溶解率越低[16].因此,本研究的结果也证实了戊二醛与明胶蛋白之间发生了显著的交联作用.另一方面,虽然膜的固形物溶解率的变化趋势类似于蛋白溶解率,但膜的固形物溶解率明显高于蛋白溶解率,这可能是甘油增塑剂没有参与交联反应的缘故.表7的结果还进一步说明了,戊二醛改性可以提高明胶蛋白膜的耐水性能,使明胶蛋白膜在潮湿环境中应用成为可能,有利于拓宽明胶膜的应用范围.
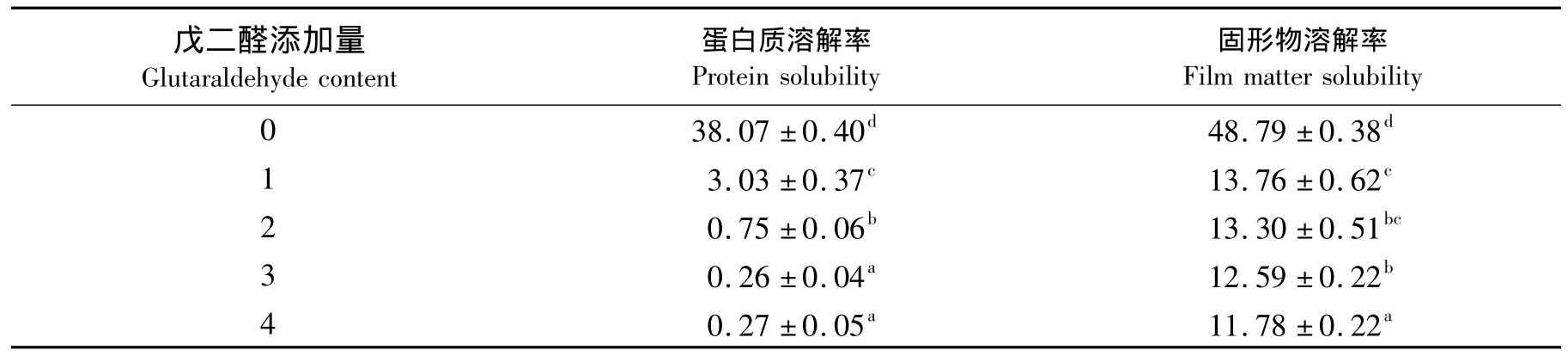
表7 添加戊二醛对明胶膜的蛋白溶解率和固形物溶解率的影响Tab.7 Effect of glutaraldehyde on protein solubility and film matter solubility of gelatin films %
2.2.5 改性膜蛋白组分的分析
利用SDS-PAGE分析戊二醛改性的鱼皮明胶蛋白膜中蛋白质组分,结果发现,当戊二醛的添加量超过蛋白质质量分数的2%时,明胶蛋白膜在2%SDS、8 mol/L尿素、20 mmol/L Tris-HCl(pH=8.8)的蛋白质变性剂中也不溶解,因此无法利用SDS-PAGE进行观察.当戊二醛的添加量为蛋白质质量分数的1%时,明胶蛋白膜中,β链、γ链以及高于γ链的高分子蛋白质条带在电泳图谱中无法观察到 (见图2),说明在戊二醛的作用下这些蛋白质组分之间先发生了相互交联,生成难溶于水以及蛋白质变性剂的高分子产物.
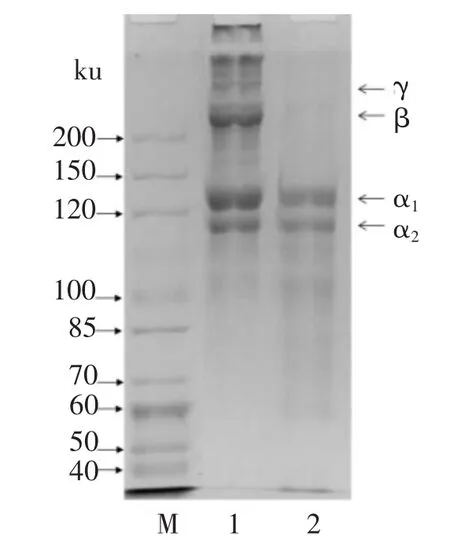
图2 戊二醛改性明胶膜中蛋白质组分的分析Fig.2 Protein pattern of glutaraldehyde modificated gelatin films
3 结论
1)利用罗非鱼鱼皮明胶可以制备无色透明、机械性能优越、具有一定阻湿性能的蛋白膜.其中,利用80℃水浴浸提1.0 h的明胶制备的蛋白膜机械性能最优.
2)戊二醛改性将使明胶蛋白膜的机械性能出现一定程度的下降,但膜的耐水性能、阻湿性能以及阻隔紫外线能力都得到显著的提高.
3)根据SDS-PAGE的结果,发现在戊二醛的作用下,罗非鱼鱼皮明胶蛋白的β链、γ链以及高于γ链的高分子组分之间容易发生交联反应.
[1]中华人民共和国农业部渔业局.中国渔业年鉴[M].北京:中国农业出版社,2011.
[2]韩凤杰,赵征,胡晓鹏.酶法制取鲮鱼皮胶原蛋白寡肽工艺的研究[J].现代食品科技,2006,22(2):135-137.
[3] JONGJAREONRAK A,BENJAKUL S,VISESSANGUAN W,et al.Characterization of edible films from skin gelatin of brownstripe red snapper and bigeye snapper [J].Food Hydrocolloids,2006,20(4):492-501.
[4] MUYONGA J H,COLE C G B,DUODU K G.Fourier transform infrared(FTIR)spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch(Lates niloticus)[J].Food Chemistry,2004,86(3):325-332.
[5] GÓMEZ-GUILLÉN M C,IHI M,BIFANI V,et al.Edible films made from tuna-fish gelatin with antioxidant extracts of two different murta ecotypes leaves(Ugni molinae Turcz)[J].Food Hydrocolloids,2007,21(7):1133-1143.
[6] PÉREZ-MATEOS M,MONTERO P,GÓMEZ-GUILLÉN M C.Formulation and stability of biodegradable films made from cod gelatin and sunflower oil blends [J].Food Hydrocolloids,2009,23(4):53-61.
[7] ZHANG S,WANG Y,HERRING J L,et al.Characterization of edible film fabricated with channel catfish(Ictalurus punctatus)gelatin extract using selected pretreatment methods [J].Journal of Food Science,2007,72(9):498-503.
[8]翁武银,刘光明,苏文金,等.鱼皮明胶蛋白膜的制备及其热稳定性[J].水产学报,2011,35(12):1890-1896.
[9] American Society for Testing and Material.Annual book of ASTM standards[M].Philadelphia:ASTM,1989.
[10] LOWRY O H,ROSEBROUGH N J,FARR A L,et al.Protein measurement with the folin phenol reagent[J].The Journal of Biological Chemistry,1951,193(1):265-275.
[11]STEEL R G D,TORRIE J H.Principles and procedures of statistics:a biometrical approach[M].New York:McGraw-Hill,1980.
[12] SHIKU Y,HAMAGUCHI P Y,TANAKA M.Effect of pH on the preparation of edible films based on fish myofibrillar proteins [J].Fisheries Science,2003,69(5):1026-1032.
[13] GENNADIOS A,WELLER C L,TESTIN R F.Property modification of edible wheat,gluten-based films [J].Transactions of the American Society of Agricultural Engineers,1993,36(2):465-470.
[14]俞艺萍,陆利霞,熊晓辉.鱼皮胶原蛋白提取研究进展 [J].食品研究与开发,2010,31(12):262-265.
[15] AHMAD M,BENJAKUL S.Characteristics of gelatin from the skin of unicorn leatherjacket(Aluterus monoceros)as influenced by acid pretreatment and extraction time [J].Food Hydrocolloids,2011,25(3):381-388.
[16] BENJAKUL S,ARTHARN A,PRODPRAN T.Properties of protein-based film from round scad(Decapterus maruadsi)muscle as influenced by fish quality [J].LWT-Food Science and Technology,2008,41(5):753-763.
[17] KUNTE L,GENNADIOS A,CUPPETT S,et al.Cast films from soy protein isolates and fractions[J].Cereal Chemistry,1997,74(2):115-118.
[18] PARK S,BAE D,RHEE K.Soy protein biopolymers cross-linked with glutaraldehyde [J].Journal of the American Oil Chemists'Society,2000,77(8):879-884.
[19]刘小杰,齐鲁,白立峰.改性明胶膜的制备及其力学性能探讨 [J].天津工业大学学报,2006,25(2):19-21.
[20] CHIOU B S,AVENA-BUSTILLOS R J,BECHTEL P J,et al.Cold water fish gelatin films:effects of cross-linking on thermal,mechanical,barrier,and biodegradation properties [J].European Polymer Journal,2008,44(11):3748-3753.
[21]林海莉,曹静,李艳.戊二醛交联明胶膜的制备与性能研究 [J].化学工程与装备,2010(6):56-58.
[22]黄曼,卞科.交联剂对大豆分离蛋白疏水性的影响 [J].郑州工程学院学报,2002,23(2):5-9.
[23] HARDY P M,HUGHES G J,RYDON H.Formation of quaternary pyridinium compounds by the action of glutaraldehyde on proteins [J].Journal of the Chemical Society,Chemical Communications,1976(5):157-158.
[24]MCPHERSON J M,LEDGER P W,SAWAMURA S,et al.The preparation and physicochemical characterization of an injectable form of reconstituted,glutaraldehyde cross-linked,bovine corium collagen [J].Journal of Biomedical Materials Research,1986,20(1):79-92.
(责任编辑 马建华 英文审校 曹敏杰)
Preparation and Improvement of Gelatin Films Based on Tilapia Skin
CHEN Shu-lin,TAO Zhong,WU Fei-fei,CAO Min-jie,WENG Wu-yin
(College of Biological Engineering,Jimei University,Xiamen 361021,China)
The effect of extraction conditions and glutaraldehyde(GLU)incorporation on the physical and chemical properties of the gelatin films prepared from tilapia skin was investigated.As a result,colorless and transparent edible film could be successfully prepared using tilapia skin gelatin.The tensile strength(TS)of films as prepared from gelatin extracted at 80℃increased and reached a peak after extraction for 1.0 h,while a gradual decrease of TS was observed when the extraction time was increased.The elongation at break(EAB)and water vapor permeability(WVP)of films were enhanced together with the increase of gelatin extraction time at 80 ℃.However,the light transmition of films was not affected by extraction time.On the other hand,when GLU was incorporated in the film-forming solutions at 1% ~4%(m/m)of protein,the TS,EAB,WVP and solubility of films all decreased,while the yellowness and barrier properties against UV lights increased.SDS - PAGE analysis indicated that the protein cross-linking reaction mainly involved in high molecular weight polymers was induced by GLU.
tilapia;fish skin;gelatin;protein films;glutaraldehyde;physical and chemical properties
S 985.1
A
1007-7405(2012)05-0335-08
2012-05-14
2012-07-01
福建省科技计划重点项目 (2010I0010);李尚大集美大学学科建设基金项目 (ZC2010009)
陈书霖 (1989—),男,硕士生,从事水产品加工研究.通讯作者:翁武银 (1974—),男,副教授,博士,从事蛋白质化学和水产品加工研究,E-mail:wwymail@jmu.edu.cn.

