响应面法优化蜂胶黄酮提取工艺及其抗氧化活性研究
李富华,夏春燕,刘燕妮,明 建,2,3,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715;3.农业部农产品贮藏保鲜质量安全与风险评估实验室,重庆400715)
响应面法优化蜂胶黄酮提取工艺及其抗氧化活性研究
李富华1,夏春燕1,刘燕妮1,明 建1,2,3,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715;3.农业部农产品贮藏保鲜质量安全与风险评估实验室,重庆400715)
采用响应面法对蜂胶黄酮提取工艺进行优化。以蜂胶为原料,基于单因素实验,以乙醇体积分数、液料比、提取时间和提取温度为相应因素、蜂胶黄酮提取率为响应值,采用四因素三水平的响应面分析法,确定最佳提取工艺条件为:液料比14∶1(mL·g-1)、提取温度72.6℃、提取时间2.5h、乙醇浓度80%(v/v),在此条件下理论提取率为33.9324%,与实测值基本相符,说明优化工艺可行。以VC为对照物,经DPPH法和铁氰化钾法验证蜂胶黄酮的抗氧化活性,发现蜂胶黄酮具有较强的清除DPPH自由基能力和还原能力,可作为优良的天然抗氧化剂资源。
蜂胶,黄酮,响应面法,抗氧化活性
Abstract:Propolis flavonoids were extracted by ethanol,and the extraction process was optimized by response surface analysis.On the basis of one-factor-at-a-time experiment,optimal extraction conditions for maximizing popolis flavonoids were determined by using a 4-variable,3-level Box-Behnken experimental design combined with response surface analysis as follows:the liquid-material ratio was 14∶1(mL·g-1),the extraction temperature was 72.6℃ ,the extraction time was 2.5h,the ethanol concentration was 80% (v/v),resulting in an propolis flavonoids yield of 33.82%,which was basic agreement with the predicted value of 33.9324%.Thus,the optimal process was reliable.The antioxidant activity in vitro condition of propolis flavonoids were evaluated by DPPH free radical scavenging assay and potassium ferricyanide reduction assay using VCas the control.Propolis flavones were found to have powerful DPPH free radical scavenging capacity and reducing power.Thus,propolis flavonoids could be developed as excellent natural antioxidant resources.
Key words:propolis;flavone;response surface methodology(RSM);antioxidant activity
蜂胶是蜜蜂从胶源植物的树芽、树皮等部位采集的树脂,再混合蜜蜂舌腺和蜡腺等腺体分泌物及少量花粉,经蜜蜂反复代谢合成的一种具芳香气味的粘性胶状固体,具有抵御病虫害和病原微生物入侵蜂巢的作用,也被用于修补巢房和内环境消毒杀菌。蜂胶常由55%的树脂,30%蜂蜡,10%芳香挥发油,5%花粉及杂质组成,其中的天然活性成分达20余类,300多种,主要有黄酮类、萜烯类、酚类、醛类、酸类、芳香类、酶类、氨基酸、脂肪酸、维生素和多糖类等,有“黄酮类化合物的宝库”和“紫色黄金”的美誉[1-3]。黄酮类物质的生理活性主要体现在其抗菌、抗病毒、抗肿瘤、抗炎症、免疫调节、抗氧化等方面,以功能性添加剂的形式被广泛应用于食品、药品、化妆品领域[4-9]。鉴于此,蜂胶已成为保健食品研究领域的开发热点,故对蜂胶活性成分——蜂胶黄酮提取的研究具有重要经济价值。本研究采用响应面(response surface methodology,RSM)分析法对蜂胶黄酮的提取工艺进行优化,以期获得最优工艺参数,并对蜂胶黄酮提取液的抗氧化活性进行了初步研究,旨为蜂胶的综合开发利用提供一定理论参考。
1 材料与方法
1.1 材料与仪器
蜂胶 奉节县百香蜂业有限公司提供;芦丁(生化试剂,含量≥95%) 上海融禾医药科技有限公司;DPPH(1,1-diphenyl-2-picrylhydrazyl) 美国Sigma公司;无水乙醇、三氯化铁、铁氰化钾、氢氧化钠、硝酸铝、抗坏血酸等 均为分析纯试剂。
FA2004型电子分析天平 上海恒平科学仪器有限公司;DFT-100型手提式高速中药粉碎机 温岭市大德中药机械有限公司;SHB-(Ⅲ)型循环水式多用真空泵 郑州长城科工贸有限公司;722型分光光度计 上海菁华科技仪器有限公司;HH-6型数显恒温水浴锅 金坛市富华仪器有限公司);冷冻离心机上海安亭科学仪器厂。
1.2 实验方法
1.2.1 蜂胶预处理 蜂胶经水洗除杂后于0℃下冷冻12h,在低温干燥状态时取样,快速短时粉碎(10s,以防发粘),收集粉末,密封,置于-18℃冰箱保存备用。
1.2.2 蜂胶总黄酮提取 精确称取2.50g蜂胶粉末,按1.2.4及1.2.5设置的工艺参数及条件进行提取,提取液经抽滤后,滤液用乙醇定容至100mL棕色容量瓶中,置于-80℃避光储存备用。
1.2.3 总黄酮含量测定 标准曲线的建立:采用硝酸铝比色法测定[10],准确称取11.2mg芦丁标准品,60%乙醇溶解并定容至50mL,得浓度为0.224mg/mL的芦丁标准液。分别吸取芦丁标准液0、1、2、3、4、5mL置于25mL棕色容量瓶中,加1mL 5%NaNO2,混匀静置6min,加1mL 10%Al(NO3)3溶液,混匀静置6min,加10%NaOH 10mL,60%乙醇定容,静置15min,以相应试剂为空白对照,于510nm处测定吸光值。以芦丁浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程:Y=12.985X-0.0019,R2=0.9995。
检测蜂胶总黄酮含量:准确吸取蜂胶提取液1mL,以60%乙醇为稀释液,依次稀释100、50、12.5倍,最终释至0.000016mg/mL,按上述方法测定样品中黄酮含量。
1.2.4 蜂胶总黄酮提取单因素实验 分别考察乙醇浓度、提取温度、提取时间和液料比4个因素对蜂胶总黄酮提取率的影响,每个实验重复三次。按以下公式计算提取率:

式中:X—由回归方程计算出蜂胶黄酮的浓度(mg/L);25—吸取不同体积的蜂胶黄酮提取液,最终定容至25mL;2.5—称取的蜂胶质量(g)。
除了考察提取时间对蜂胶黄酮提取率的影响时样品稀释倍数为2000,其余的样品稀释倍数均为2500。
1.2.4.1 乙醇浓度 在提取温度35℃、时间2h、液料比10∶1(mL/g)的条件下,考察50%、60%、70%、80%、90%、95%的乙醇溶液对蜂胶黄酮提取率的影响。
1.2.4.2 提取时间 在提取温度35℃、乙醇浓度80%、液料比10∶1的条件下,考察浸提时间0.5、1.0、2.0、3.0、4.0h对蜂胶黄酮提取率的影响。
1.2.4.3 提取温度 在乙醇浓度80%、提取时间2.0h、液料比10∶1的条件下,考察浸提温度35、45、55、65、75℃对蜂胶黄酮提取率的影响。
1.2.4.4 液料比 在乙醇浓度80%、提取时间2.0h、温度65℃的条件下,考察液料比5∶1、10∶1、15∶1、20∶1、25∶1(mL/g)对蜂胶黄酮提取率的影响。
1.2.5 响应面法优化工艺条件 根据Box-Behnken的中心组合实验设计原理,基于单因素实验结果,以乙醇体积分数(A)、液料比(B)、提取温度(C)、提取时间(D)为相应因素,蜂胶黄酮提取量(Y)为响应值,采用四因素三水平的响应面分析法进行实验设计,因素水平设计见表1。

表1 蜂胶黄酮提取响应面分析实验设计因素与水平表Table 1 Variables and levels in response surface design
1.2.6 抗氧化性测定
1.2.6.1 DPPH自由基清除率的测定[11]分别检测20、40、60、80、100μg/mL的VC对0.1mmol·L-1的DPPH溶液的自由基清除率并绘制曲线,以此作为对照;分别检测17、34、51、68、85μg/mL的黄酮提取液对0.1mmol·L-1的DPPH溶液的自由基清除率并绘制曲线,确定达到同一DPPH·自由基清除率时所对应的VC与黄酮的浓度值,浓度值越小其清除DPPH·自由基的能力越强,对应的抗氧化性也就越强;反之,清除DPPH·自由基的能力弱,对应的抗氧化性也弱。
准确吸取1mL蜂胶提取液,加入5mL 0.1mmol·L-1的DPPH溶液,室温下避光静置50min,以甲醇作空白,于517nm处测吸光值A,按下列公式计算清除率,以清除率为纵坐标,样品液浓度为横坐标作图,以VC作阳性对照。

式中:A样品为样液吸光值;A空白为空白液吸光值。1.2.6.2 还原力测定(铁氰化钾法)[4]分别检测10、20、30、40、50μg/mL的VC以及17、34、51、68、85μg/mL的黄酮提取液在700nm波长处的吸光值,并绘制对照品VC与蜂胶黄酮的还原力曲线,当达到同一吸光值时,所需的样品浓度值越小,证明其还原力越强,即其抗氧化性强。
1mL蜂胶提取液,加入1mL 0.2mol·L-1的磷酸盐缓冲液(Phosphate Buffered Saline,PBS),1mL 1%K3[Fe(CN)6]溶液,于50℃条件下水浴20min,加入1mL 10%三氯乙酸、5mL去离子水和2.5mL 0.1%FeCl3,混匀静置10min,于700nm处测吸光值。以吸光值为纵坐标,样液浓度为横坐标作图,以VC作阳性对照。
1.3 数据处理
所有数据均为3次重复实验的平均值,运用Excel数据处理软件和Design expert V 7.0统计软件进行数据分析。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 乙醇浓度 由图1可见,随乙醇浓度的升高,蜂胶黄酮提取率呈先上升后略微下降趋势,80%时达峰值。这是由于适当浓度的乙醇溶液有利于黄酮类物质的溶出,而当乙醇浓度过高时,提取液挥发性增强,同时醇溶性杂质、色素及亲脂性成分溶出量增加而与乙醇竞争结合黄酮类物质,从而导致乙醇提取率降低[12]。本实验将乙醇浓度的考察范围定为70%~90%。

图1 乙醇浓度对黄酮提取率的影响Fig.1 Effect of ethanol concentration on flavones extraction rate
2.1.2 提取时间 由图2可见,随提取时间延长,黄酮提取率呈先升后降趋势,2h时达峰值。这是由于黄酮本身具有还原性,长时间加热将使黄酮发生变性[13]。本实验将提取时间的考察范围定为1~3h。

图2 提取时间对黄酮提取率的影响Fig.2 Effect of extraction time on flavones extraction rate

图3 提取温度对蜂胶黄酮的影响Fig.3 Effect of extraction temperature on flavones extraction rate
2.1.3 提取温度 由图3可见,随温度升高,黄酮提取率呈先升后降趋势,65℃时达峰值。这是由于温度升高,杂质溶出量增大且黄酮类遭到破坏,此外,高温下乙醇挥发,液料比改变而导致提取率下降。本实验将提取温度的考察范围定为55~75℃。
2.1.4 液料比 由图4可见,随液料比增加,黄酮提取率呈先升后降趋势,15∶1时达峰值。溶剂量增加使物料与溶剂接触面积、溶液传质推动力均增大[14],将使黄酮提取率升高,但液料比过大使杂质溶出多,且浓缩成本高。本实验将液料比考察范围定为10∶1~20∶1。

图4 液料比对黄酮提取率的影响Fig.4 Effect of liquid/material ratio on flavones extraction rate
2.2 蜂胶总黄酮提取工艺优化结果与分析
2.2.1 数学模型的建立与检验 基于单因素实验,采用响应面法对蜂胶总黄酮的提取工艺进行优化,以乙醇浓度(A)、液料比(B)、提取温度(C)、提取时间(D)为响应因素,蜂胶总黄酮提取量(Y)为响应值,根据Box-Behnken的中心组合实验设计原理,得出蜂胶总黄酮得率的四因素三水平的实验设计及结果(见表2)。
采用国际通用的Design expert V 7.0统计软件对表2数据进行多元回归拟合,得到以蜂胶总黄酮提取率为目标函数,关于各条件编码值的二次回归方程为:

对该模型进行显著性检验,得方差分析表(表3)。
由表3可知,模型极显著(p=0.0001<0.01),实验所选取的二次多项模型具有高度的显著性,失拟项在a=0.05的水平上不显著(p=0.1378>0.05),其校正系数R2=89.57%,因此该模型拟合度较好。模型信噪比RSN=9.823远大于4,即该模型可用于预测。综合以上各参数表明该实验方法可靠,各因素水平间设计合理,因此可用该回归方程模拟实验真实点值对实验结果进行分析和预测。
该二次回归模型的一次项:B极显著(p=0.0086<0.01),A显著(p=0.0166<0.05);交互项:BC极显著(p=0.0063<0.01)、CD显著(p=0.0380<0.05);二次项:A2、B2、C2、D2均极显著(p<0.01)。各实验因素对蜂胶总黄酮提取率的影响排序为:提取温度>乙醇浓度>提取时间>液料比。
2.2.2 蜂胶总黄酮提取率的响应面分析 响应面图是响应值对各实验因素所构成的三维空间曲面图,可直观的反映各实验因素的交互作用[4,9,15]。对响应值进行统计分析,其中显著交互项的响应曲面图见图5~图7。

表2 蜂胶总黄酮提取响应面实验设计及结果Table 2 Process variables and levels in response surface designarrangement and experimental response values

表3 方差分析结果Table 3 Analysis of variance for quadric regression model

图5 乙醇浓度和提取时间对黄酮提取率的影响Fig.5 Effects of ethanol concentration and extraction time on flavones extraction rate

图6 提取温度和提取时间对黄酮提取率的影响Fig.6 Effects of extraction temperature and extraction time on flavones extraction rate
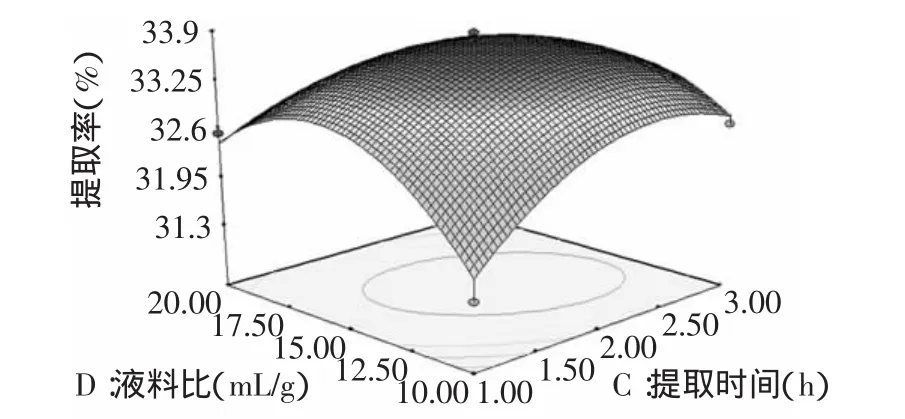
图7 液料比与提取时间对黄酮提取率的影响Fig.7 Effect of liquid/material ratio and extraction time on flavones extraction rate
图5~图7直观地展现出各因子交互作用的响应曲面3D分析图,等高线的形状可反映出交互作用的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反,同时有闭合的椭圆或圆表示有最大值[14-15]。
2.2.3 蜂胶总黄酮提取工艺条件的优化 经Design expert V 7.0统计软件优化,蜂胶总黄酮最佳提取工艺条件为:液料比13.91∶1(mL·g-1),提取温度72.58℃,提取时间2.55h和乙醇浓度80.64%,此时蜂胶总黄酮的最大提取率33.9324%。考虑到实际操作的可行性,将提取工艺条件修正为液料比14∶1(mL·g-1)、提取温度72.6℃、提取时间2.5h、乙醇浓度80%。为验证结果的可靠性,采用上述优化出的工艺参数进行3次重复实验,得到黄酮的实际平均提取率为33.82%,与理论预测值接近,表明建立的数学模型对蜂胶总黄酮提取工艺具有实用价值。
2.3 蜂胶黄酮抗氧化活性测定
2.3.1 DPPH·清除能力实验 从图8可见,一定浓度范围内,DPPH·清除率随浓度增加而增大。当清除率均达90%时,所需的VC和蜂胶黄酮提取液的浓度分别为40、80μg/mL左右,可见蜂胶黄酮具有一定的自由基清除力,但弱于VC。

图8 VC与蜂胶黄酮对多DPPH·自由基的清除能力Fig.8 DPPH·radical scavenging activities of VCand propolis flavone
2.3.2 还原能力实验 从图9可见,一定浓度范围内,VC和蜂胶黄酮的还原力随其浓度增加而增大。当吸光度均达0.3时,所需的VC和蜂胶黄酮提取液浓度分别为在30、50μg/mL,说明蜂胶黄酮具有较强的还原能力,但弱于VC。

图9 VC与蜂胶黄酮还原能力测定Fig.9 Reduceing power of VCand propolis flavone
3 结论
3.1 单因素实验结果表明,蜂胶黄酮的含量随着提取时间、提取温度、液料比的增加呈明显地先升高后下降趋势,而随着乙醇浓度的升高黄酮含量略显下降。
3.2 响应面分析法得到四因素对蜂胶黄酮提取率影响的大小关系是:提取温度>乙醇浓度>提取时间>液料比。优化出的蜂胶黄酮最优提取工艺为:液料比14∶1(mL·g-1)、提取温度72.6℃、提取时间2.5h、乙醇浓度80%。
3.3 蜂胶黄酮具有一定的抗氧化能力,可作为天然抗氧化剂的开发资源。
[1]罗宇倩,郭辉,钱俊青.蜂胶黄酮提取纯化的工艺研究[J].中国蜂业,2011,6(1):6-10.
[2]孟良玉,卢佳琨,兰桃芳,等.蜂胶提取物抗氧化稳定性研究[J].食品科学,2012,33(7):127-130.
[3]Kosalec I,Bakmaz,Pepeljnjak S,et al.Quantitative analysis of the flavonoids in raw propolis from northern Croatia[J].Acta Pharmaceutica,2004,54(1):65-72.
[4]Wang X S,Wu Q,Wu Y F,et al.Response Surface Optimized Ultrasonic-Assisted Extraction of Flavonoids from Sparganii Rhizoma and Evaluation of Their in Vitro Antioxidant Activities[J].Molecules,2012,17(6):6769-6783.
[5]徐坤.蜂胶有效成分提取方法比较[J].食品科技,2009,34(12):208-210.
[6]Nick K, Spyros J K,Elena T, et al.Chemical composition,antioxidant activity and antimicrobial properties of propolis extracts from Greece and Cyprus[J].Food Chemistry,2009,116(2):452-461.
[7]Rajibul A L,Ismail S,Nayan R.Antioxidant activity of Indian propolis and its chemical constituents[J].Food Chemistry,2010,122(1):233-237.
[8]Luerecia L C,Monica A N.Bioactivity of propolis from Santiago del Estero,Argentina,related tontheir chemical composition[J].Food Science and Technology,2009,42(8):1422-l427.
[9]Pan G Y,Yu G Y,Zhu C H,et al.Optimization of ultrasoundassisted extraction(UAE) of flavonoids compounds(FC) from hawthorn seed(HS)[J].Ultrasonics Sonochemistry,2012,19(3):486-490.
[10]赵喜红,何小维.柿叶黄酮类物质的乙醇提取工艺及其抗氧化性的研究[J].食品研究与开发,2007,28(3):49-52.
[11]Cheung L M,Peter C K Cheung,Vincent E C Ooi.Antioxidant activity and total phenolics of edible mushroom extracts[J].Food Chemistry,2003,81:249-255.
[12]阮征,胡筱波,赖富饶,等.油菜花粉中黄酮类物质提取工艺的优化研究[J].食品科学,2007,28(7):133-137.
[13]唐传核,杨晓泉.加热预处理对大豆胚芽风味及其异黄酮存在形式的影响[J].食品科学,2004,25(7):109-111.
[14]江明珠,陈星,颜辉,等.响应曲面法优化女贞子总黄酮的超声波提取工艺[J].江苏科技大学学报:自然科学版,2010,24(6):604-608.
[15]王大为,杜彩霞,周清涛,等.响应面法优化玉米皮纤维双螺杆挤出工艺[J].食品科学,2011,32(18):6-10.
Optimization of extraction process of propolis flavonoids by response surface methodology and its antioxidant activity research
LI Fu-hua1,XIA Chun-yan1,LIU Yan-ni1,MING Jian1,2,3,*
(1.College of Food Science,Southwest University,Chongqing 400715,China;2.Chongqing Special Food Programme and Technology Research Center,Chongqing 400715,China;3.Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservation(Chongqing),Ministry of Agriculture,Chongqing 400715,China)
TS201.1
B
1002-0306(2012)20-0226-05
2012-06-25 *通讯联系人
李富华(1986-),女,硕士研究生,研究方向:食品化学与营养学。
国家星火计划项目(2010GA811001)。

