三草酸合铁(Ⅲ)酸钾的合成实验优化
曹小霞,蒋晓瑜
(福建工程学院环境与设备工程系,福建福州350108)
三草酸合铁(Ⅲ)酸钾的合成实验优化
曹小霞,蒋晓瑜
(福建工程学院环境与设备工程系,福建福州350108)
在三草酸合铁(Ⅲ)酸钾合成实验中,原实验操作步骤较笼统、操作条件控制不严格,导致多数学生只能得到较少的产物,有些甚至无法得到晶体,或得到白色晶体,实验的重现性也较差。本文对三草酸合铁(Ⅲ)酸钾合成的实验条件进行了深入探索,改善了实验结果的重现性,提高了产品的产率,获得了优化条件:(1)过氧化氢加40℃下慢速加入;(2)将溶液微沸2min左右去除剩余过氧化氢;(3)将溶液置于20℃的水浴中,交替加入9mL饱和H2C2O4和3mL饱和K2C2O4溶液后,加无水乙醇15mL,即可得到高产率的翠绿色三草酸合铁(Ⅲ)酸钾晶体。
三草酸合铁(Ⅲ)酸钾;合成;优化
福建工程学院工科类学生的无机与分析化学课程实验“三草酸合铁(Ⅲ)酸钾的制备”[1]为综合设计性实验,涉及称量、溶液配置、减压过滤、固液分离等多种基本操作,实验内容融合了无机的四大基本原理,即沉淀溶解、配合反应、氧化还原反应和草酸电离平衡。三草酸合铁(Ⅲ)酸钾制备中的化学现象变化多,(NH4)2Fe(SO4)2·6H2O水溶液为浅绿色、[Fe(C2O4)3]4-呈橙红色、FeC2O4·2H2O为淡黄微晶沉淀、Fe(OH)3为棕色沉淀、[Fe(C2O4)3]3-呈鲜翠绿色、K3[Fe(C2O4)3]·3H2O为翠绿色鲜艳粗大晶体,实验过程中出现多变的色彩,对学生产生了吸引力。
实验操作步骤较笼统,没有严格限定操作条件,合成过程需要反复控温、调节酸和氧化剂加入速度、加入量及多次进行沉淀的洗涤,如果教师未能有效地进行指导,按教材设定的操作步骤进行实验时,大部分学生只能得到较少的产物,一部分学生甚至无法得到晶体,或得到白色晶体,实验的重现性也较差,既影响后续的产品组分分析,又影响了学生进一步实验的积极性。
许多高校实验教师对本实验的操作条件进行了研究与改进[2-7],但仍存在晶体析出的时间过长和实验重现性较差等问题。如按文献[5]饱和草酸溶液加入的量操作步骤:溶液置于75~80℃的水浴,加入饱和H2C2O44mL后,在不断搅拌下缓慢滴加饱和H2C2O4至溶液中的沉淀消失,溶液呈透明的亮绿色。在本实验过程中,消耗饱和H2C2O4溶液:先倒入饱和H2C2O4溶液5mL,后改用胶头滴管慢慢滴加使沉淀溶解,共消耗饱和H2C2O4溶液16mL,此时pH值接近1,避光放置两天后仍无晶体析出。按文献[6]可观察到翠绿色大块单斜晶体,但结晶时间需要1~2天。为保证实验顺利进行,本文采取设计对比实验的研究方法,针对如何缩短产物的合成时间、提高产品的产率和纯度等问题,对实验的主要条件进行了优化,在2 h内获得晶体产物的可行方法。优化后的实验具有更强的操作性,更好的实验效果,对实验教学具有一定的指导意义。
1 实验过程
1.1 主要的仪器与试剂
1.仪器:恒温磁力搅拌水浴锅;循环水式多用真空泵;电子天平。
2.试剂:(NH4)2Fe(SO4)2·6H2O(固体);H2C2O4(饱和溶液);K2C2O4(饱和溶液);H2O2(6%);H2SO4(6mol·L-1);KOH(0.2mol·L-1);无水乙醇,均为分析纯。
1.2 实验原理
本实验涉及的主要反应如下
(NH4)2Fe(SO4)2+H2C2O4=FeC2O4(s)+(NH4)2SO4+H2SO4(沉淀)
6FeC2O4+3H2O2+6K2C2O4(过量)=4K3[Fe(C2O4)3]+2Fe(OH)3(s)(氧化配位)
2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O(酸溶配位)
1.3 优化后的实验方法
将5 g(NH4)2Fe(SO4)2·6H2O(s)溶于20mL水中,加入5滴6mol/LH2SO4酸化(防止Fe2+水解),加热使其溶解。在不断搅拌下加入25mL饱和H2C2O4溶液,加热至沸静置。待黄色沉淀FeC2O4完全沉降后,倾去上层清夜,用蒸馏水洗涤沉淀3~4次(每次用水约20mL),洗涤至pH值为5~7。
在上述沉淀中加入10mL饱和K2C2O4溶液,水浴恒温维持40℃左右,缓慢滴加10mL 6%H2O2溶液(保持1 d·s-1,快速搅拌),此时溶液有棕色的Fe(OH)3沉淀生成。加热溶液微沸2min左右(H2O2基本分解),将溶液置于20℃的水浴中,交替加入9mL饱和H2C2O4和3mL饱和K2C2O4后,在不断搅拌下,至溶液中的沉淀消失,此时溶液呈透明的亮绿色(若体系浑浊可趁热过滤)。加无水乙醇15mL,将溶液置于暗处结晶(大约需0.5h)。结晶完全后,抽滤,用50%乙醇洗涤晶体,抽干,产品在60~70℃干燥,称量,计算产率。
2 结果与讨论
2.1 滴加H2O2时的温度与速度的影响
用H2O2将FeC2O4氧化为三价铁,在其他条件不变时,滴加H2O2时的温度与速度对实验最终产率的影响见表1。
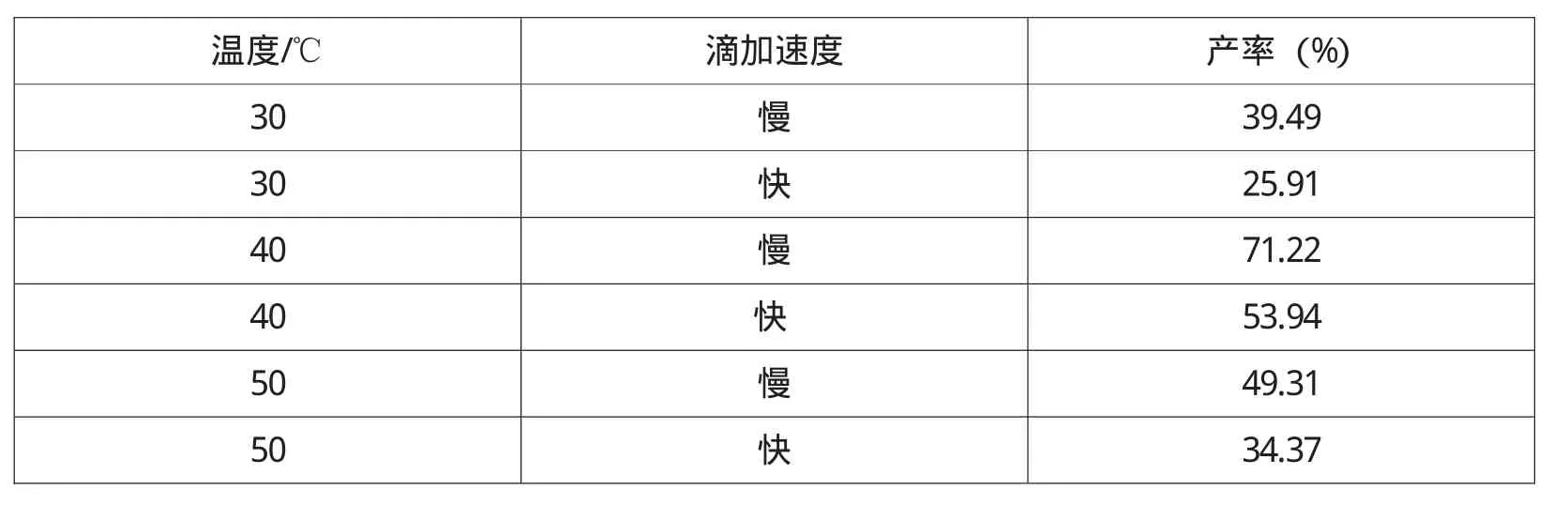
表1 温度及滴加速度对实验产率的影响
由表1可知,反应温度应控制在40℃左右,产率较高,说明FeC2O4氧化较完全,二价铁转化成为三价铁的转化率较高。温度过高或过低均影响FeC2O4氧化完全程度,主要原因是温度太低Fe2+的氧化速度较慢,温度太高,虽能够加快非均相反应速度,但是也促进H2O2分解,影响Fe2+的氧化程度。同时该过程需要不断搅拌,以加速扩散过程,使各反应物充分混合与接触。H2O2滴加速度的快慢,对Fe2+的氧化过程影响很大。若加入速度太慢,体系中H2O2浓度过低,氧化过程时间延长;但太快则会因H2O2局部过浓,造成部分H2O2分解,Fe2+的氧化程度降低,使得酸溶配位后,体系仍是混浊的。抽滤后在滤纸上有黄色的固体,说明有一部分Fe2+没有氧化成Fe3+,还是FeC2O4固体。
实验表明,二价铁转化成为三价铁的转化率,是决定最终产率的关键步骤。在改进的实验中,我们采用增加过氧化氢的用量、放慢过氧化氢加入量、严格控制反应温度等办法,收到满意的结果。
2.2 剩余过氧化氢的去除时间对产率的影响
剩余H2O2的去除时间直接影响到实验结果。采用上述优化的氧化条件,考察了加热煮至溶液微沸的时间对实验产率的影响,结果见表2。

表2 H2O2处理方式对实验产率的影响
加热煮沸的作用在于使Fe(OH)3沉淀完全,使胶体状沉淀转化为易于过滤的沉淀。由表2可知,去除H2O2时,加热煮至微沸溶液2~3min最为合适,可得到较高的产率。因为煮沸时间过短,H2O2未完全分解,影响后续反应;煮沸时间过长,使Fe(OH)3发生团聚,颗粒变粗大和致密,使下一步酸溶配位反应缓慢,时间增长。
2.3 饱和草酸溶液加入方式、加入的量对实验结果的影响
饱和草酸溶液加入方式、加入的量对实验结果影响见表3。
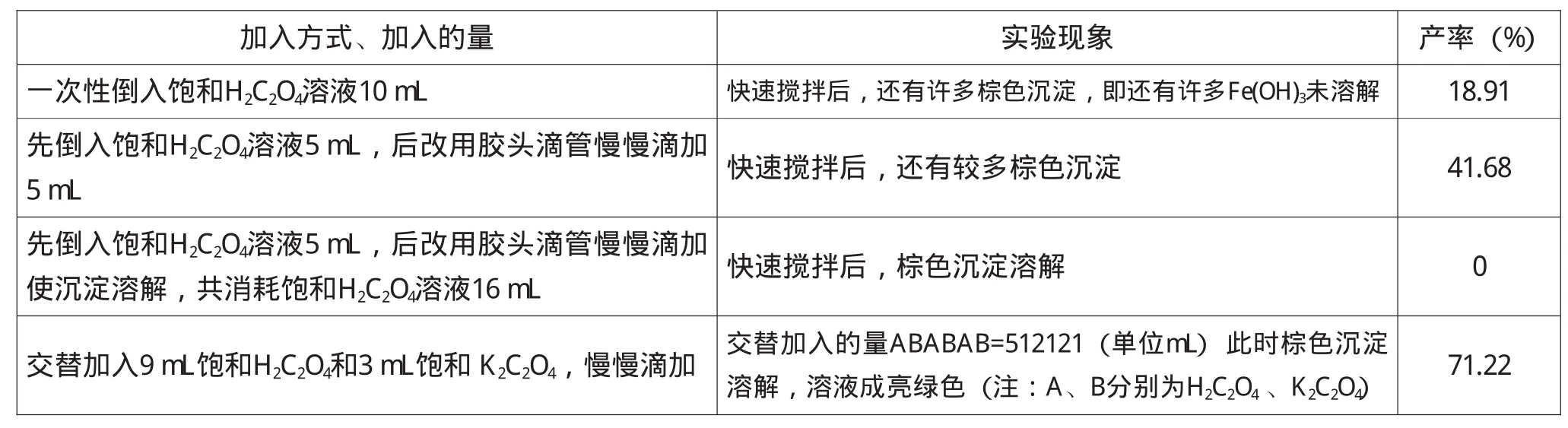
表3 饱和草酸溶液加入方式、加入的量对实验结果的影响
由表3可知,一次性倒入饱和草酸溶液导致局部浓度过高,反应不能充分进行,产率低。先加入5mL饱和草酸溶液(边加边搅拌),后改用胶头滴管慢慢滴加至沉淀溶解,此时共消耗饱和H2C2O4溶液16mL,pH值接近1,避光放置两天后仍没有晶体析出。用0.2mol·L-1KOH调节样品的pH值,第二天在杯底析出一层小颗粒晶体。
实验表明,饱和草酸溶液加入方式、加入的量对实验结果的影响很大。采用交替加入饱和H2C2O4和饱和K2C2O4,慢慢滴加,实验操作时间适中,产率最高,达71.22%。
2.4 酸溶过程中的水浴温度对产率的影响
酸溶过程中的水浴温度也是影响实验的重要条件,本实验考察了酸溶过程中的水浴温度对产率影响,实验结果见表4。
由表4可知酸溶配位反应,水浴温度20℃时,产率最高。酸溶过程水浴温度接近100℃时,发生副反应[5]2Fe(OH)3+Fe2(C2O4)3+H2C2O4+2H2O=4FeC2O4·2H2O↓+2CO2↑,生成掺有FeC2O4·2H2O黄色杂质的晶粒,致使按照原来文献要求的75~80℃酸溶温度操作时,溶液呈黄绿色。

表4 不同的水浴温度对实验产率的影响
通过试验,获得酸溶最佳温度为20℃。该操作温度比文献[4-6]中75~80℃的最佳酸溶温度大大降低,同时又减少了副反应,改善了实验条件,节约了能源。
2.5 晶体析出条件的优化
K3[Fe(C2O4)3]·3H2O2晶体析出的条件会直接影响产率、纯度和晶体颗粒大小。在保证晶体短时间内析出的前提下,考察3种不同的结晶方式,对K3[Fe(C2O4)3]·3H2O2晶体形成的影响,实验结果见表5。
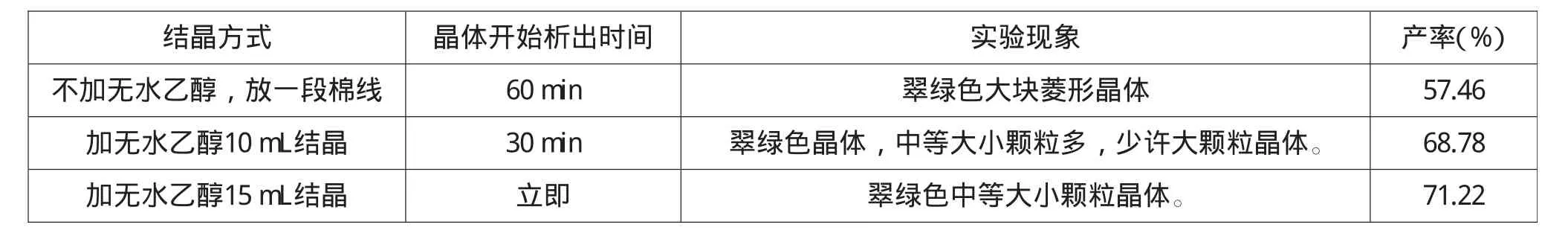
表5 结晶方式对实验的影响
由表5可知:不加无水乙醇,放一段棉线,晶型均匀规则、颗粒大、色泽鲜艳,但产率较低,晶体析出速度最慢,析出时间偏长,影响后续实验的成分分析。加无水乙醇则较快析出晶体,加入无水乙醇10 mL等待30min后有晶体析出;当无水乙醇的加入量达15mL,则立即有晶体析出。采用无水乙醇后,晶体颗粒大小均一、产率比较理想,同时缩短了实验时间。
3 结论
本文对三草酸合铁(Ⅲ)酸钾合成的实验条件进行了深入的探索,改善了实验结果的重现性,提高了产品的产率,显著提高了实验教学效果。主要优化结果如下。
(1)通过增加过氧化氢的用量、放慢过氧化氢加入量、严格控制反应温度(40℃)等办法,收到满意的结果。
(2)通过对剩余H2O2的去除时间的考察,结果表明将溶液微沸2min左右去除剩余过氧化氢,可获得较高的产率。
(3)饱和草酸溶液加入方式、加入的量的优化条件是:将溶液置于20℃的水浴中,交替加入9mL饱和H2C2O4和3mL饱和K2C2O4后,加无水乙醇15mL。本试验首次提出酸溶最佳水浴温度为20℃,该操作温度比75~80℃的最佳酸溶温度大大降低,同时减少了副反应的产生,节约了能源。
[1]南京大学.无机及分析化学实验[M].4版.北京:高等教育出版社,2006:173-175.
[2]陈小利,崔华莉,李平,等.三草酸合铁(Ⅲ)酸钾的制备实验的探索与改进[J].广州化工,2011,39(11):148-150.
[3]唐树和,顾云兰,张根成.三草酸合铁(Ⅲ)酸钾制备实验的探究[J].广州化工,2011,39(3):168-170.
[4]卢季红,高翔,胡兴龙,等.无机化学实验教学中对三草酸合铁(Ⅲ)酸钾制备的实验改进[J].教学教改天地,2011(1):90-92.
[5]李芳,陈静芬,李灵丽,等.三草酸合铁(Ⅲ)酸钾制备条件的优化[J].台州学院学报,2009(3):49-51.
[6]姜述芹,陈虹锦,梁竹梅,等.三草酸合铁(Ⅲ)酸钾制备实验探索[J].实验室研究与探索,2006,25(10):1194-1196.
[7]郑臣谋,林的的,杨学强,等.对“三草酸合铁酸钾的制备”的改进[J].大学化学,1999,14(2):41-42.
Abstract:The traditional experiment in the preparation of potassium ferrioxalate has some defects,such as cursory processesand undemandingoperation conditions.Itcauses the following problems.Firstly,moststudentsobtain limited yields.Secondly,some studentsonly getwhite crystalsor even nothing.thirdly,the reproducibility of the experiment is dissatisfying.The paper carries out the detailed analysis on the experimental conditions of synthesizing potassium ferrioxalate,and it improves the reproducibility of the experiment,and increases the yields and optimizes the results.Emerald grain crystals can be obtained ata high rate ofyieldsby:(1)slowly adding H2O2at40℃;(2)gently boiling the solution for 2minutes to eliminate the remaining H2O2;(3)Bathing the solution at 20℃,then adding 9mL saturated H2C2O4and 3mL saturatedK2C2O4in turn,and finally adding15mLanhydrousethanol.
Key words:potassium ferrioxalate;synthesizing;optimization
The Optim ization Experim ent of Synthesizing Potassium Ferrioxalate
CAOXiao-xia,JIANGXiao-yu
(Departmentof Environmentand EquipmentEngineering,Fujian University of Technology,Fuzhou 350108,China)
O61-4
A
1008-178X(2012)09-0042-04
2012-03-15
曹小霞(1974-),女,福建永定人,福建工程学院环境与设备工程系实验师,从事化学实验教学与研究。

