胃肠道间质瘤治疗新方法的探讨
郭 花,盛剑秋,余长忠,金 鹏,李 娜,赵晓军,王海红,王昕,李爱琴,余东亮,谢 惠
北京军区总医院消化内科,北京 100700
胃肠道间质瘤治疗新方法的探讨
郭 花,盛剑秋,余长忠,金 鹏,李 娜,赵晓军,王海红,王昕,李爱琴,余东亮,谢 惠
北京军区总医院消化内科,北京 100700
目的 探讨胃镜与腹腔镜双镜联合及内镜黏膜下挖除术(endoscopic submucosal excavation,ESE)治疗胃肠道间质瘤的效果和安全性。方法 经胃(肠)镜、超声内镜及病理学、免疫组化证实的胃肠道间质瘤患者37例,对其中28例患者采用ESE、9例采用胃镜与腹腔镜双镜联合进行瘤体切除。结果 ESE及双镜联合治疗的所有患者均完整切除瘤体,两种方法均无术中及术后迟发性出血、剧烈腹痛等并发症,瘤体位于贲门者,切除后患者贲门功能保持良好,术后随访无复发。结论 胃镜与腹腔镜双镜联合技术及ESE是治疗胃肠道间质瘤的微创、安全、有效的新方法。
胃肠道间质瘤;内镜黏膜下挖除术;胃镜与腹腔镜双镜联合
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)属于消化道间叶性肿瘤,具有非定向分化和潜在恶性的特点[1-2]。随着人们对GIST分子机制探讨的深入[3]、内镜和超声内镜检查的普及,越来越多的患者被诊断出GIST。其传统的治疗方式以手术切除为主,随着内镜技术的不断发展,ESE可切除部分位于黏膜肌层的GIST,但对于起源于固有肌层者,单独ESE治疗发生出血、穿孔的风险较大,因此胃镜与腹腔镜双镜联合治疗克服了各自的局限性,实现优势互补,是治疗GIST微创、有效的新方法。回顾性分析我院联合应用胃(肠)镜和超声内镜(endoscopic ultrasonography,EUS)发现,并经病理学确诊GIST患者37例,探讨采用ESE或胃镜与腹腔镜双镜联合切除瘤体的治疗效果及安全性。现报道如下。
1 对象与方法
1.1 研究对象 我院2007年6月—2012年6月经胃(肠)镜检查发现消化道黏膜下肿物,经超声内镜及病理学、免疫组化证实为GIST患者37例,男15例,女22例,年龄31~79 岁,平均年龄(58.8 ±11.7)岁;临床表现主要为上腹不适、腹痛、腹胀、反酸、呕血、黑便等。
1.2 胃(肠)镜联合EUS检查 胃(肠)镜检查发现消化道黏膜下隆起性病变,同时行EUS检查,使用电子线阵式超声内镜(Olympus GF-UE260)或微型超声探头(Olympus EndoEcho EU-M2000)确定病变大小、起源、回声、与周围脏器的关系等。
1.3 治疗方法
1.3.1 ESE切除:适用于位于黏膜肌层或固有肌层浅层、向腔内生长的瘤体。方法:内镜下沿病变边缘用氩气刀标记切除范围,黏膜下多点注射甘油果糖-美兰使病变抬起,用IT刀或dual刀切开肿瘤外侧缘黏膜,沿病变四周分离组织,对于创面可见的小血管及切缘,应用热凝止血,逐步剥离、挖除病灶,瘤体剥离后钛夹闭合创面。
1.3.2 胃镜与腹腔镜双镜联合切除:适用于瘤体位于固有肌层、腔外生长、与浆膜层分界不清或瘤体较大难以内镜下完整切除时。方法分为两种:①腹腔镜辅助胃镜手术:即在胃镜下以APC法标记病灶边缘,在病灶周围黏膜下注射甘油果糖-美兰,用IT刀或dual刀沿标记环形切开,逐层剥离病灶,深挖至病灶基底部,若剥离瘤体后出现胃壁穿孔或出血,则腹腔镜监视可立即发现,行腹腔镜下胃壁修补、缝合或止血治疗。若内镜下剥离大部分瘤体却又无法完整剥离瘤体时,行腹腔镜下瘤体切除;② 内镜辅助腹腔镜手术:胃镜通过“顶”、“推”等方法对肿物进行精确定位,同时腹腔镜下监视胃镜定位效果,明确病变位置后利用腹腔镜切除瘤体、缝合切口,最后经胃镜或腹腔镜取出肿物[4]。
1.4 病理学检查 所有组织在我院病理科行苏木精-伊红(hematoxylin-eosin,HE)染色,并使用免疫组化法测定 CD34、CD117、SMA、S-100、Desmin 和 DOG.1 的免疫表型。
1.5 随访及术后辅助治疗 依据美国国立卫生研究所(NIH)原发GIST切除后的风险分级(2008版)对所有内镜下完整切除瘤体的患者进行风险分级评估。对于中高危GIST患者每3个月进行1次随访,对于低危患者每6个月进行1次随访,随访内容包括复查胃镜、腹盆腔增强 CT 等[5]。
1.6 统计学方法 所有资料采用计量资料或计数资料表示,采用SPSS 13.0进行统计学分析,计量资料间比较采用t检验,计数资料采用χ2分析,P<0.05为差异有统计学意义。
2 结果
2.1 瘤体大小及分布 GIST在内镜下表现为球形或半球形隆起,表面光滑,部分较大瘤体中央出现充血、糜烂或凹陷性溃疡,瘤体直径约0.3~6 cm,平均(2.4±1.9)cm,位于食管8例,胃22例(胃底12例、胃体6例、胃窦4例),十二指肠1例,回盲部1例,降结肠1例,直肠4例。
2.2 超声内镜结果 超声内镜显示病变起源于固有肌层或黏膜肌层,大多数病例呈低-中密度回声,部分瘤体内部还可出现高密度回声,内部回声均匀或不均匀,超声内镜对GIST的正确诊断率可达92%(见表1)。

表1GIST的超声内镜下特点[例数(%)]Tab 1 The feature of EUS in GIST[n(%)]
2.3 治疗结果 所有患者均完整切除瘤体(见图1),无术中及术后迟发性出血、剧烈腹痛发生,无中转开腹手术病例及死亡病例发生,仅有1例患者术后出现严重肺部感染及腹腔感染,经抗感染治疗后痊愈。ESE治疗组(28例)平均瘤体直径明显小于双镜联合治疗组(P<0.05)。两组瘤体起源层次比较,差异有统计学意义(P<0.05)。两组GIST在超声内镜下的回声情况,统计学结果显示无明显差异(P>0.05,见表2)。
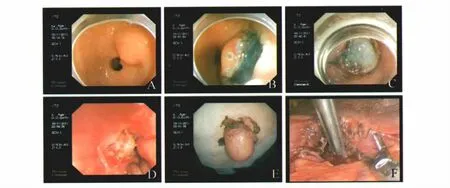
图1 胃镜与腹腔镜双镜联合切除胃间质瘤 A:胃窦间质瘤;B:沿病灶周围环形切开;C-D:胃镜下逐步剥离病灶;E:剥离的瘤体;F:腹腔镜下缝合胃壁Fig 1 Laparoscopy combined with gastroscopy removal GIST A:the GIST in gastric antrum;B:circumferentially incise around the tumor;C-D:excavate the tumor step by step;E:excavated tumor;F:suture the gastric wall under laparoscope
2.4 术后风险分级及随访 所有内镜下完整切除瘤体的37例患者中,极低危20例,低危9例,中危5例,高危3例(见图2)。术后随访2~12个月,尚无术后复发病例出现。
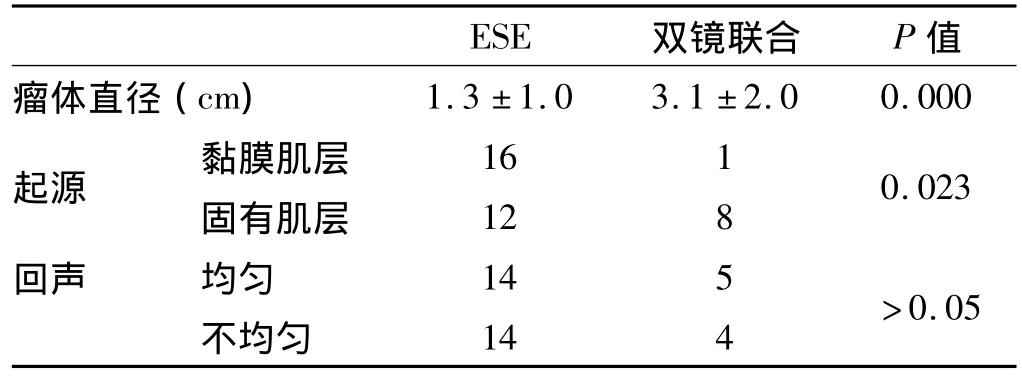
表2 ESE治疗组与双镜联合治疗组的比较Tab 2 The comparison between ESE treatment group and laparoscopy combined with endoscopy treatment group
3 讨论
GIST的发病年龄多为40~80岁,中位年龄为60岁,发生部位最多见于胃(45% ~65%),其次为小肠(15% ~25%),食管、十二指肠、直肠的发生率分别约5% ~10%、3% ~5%、5% ~10%[6]。本研究中 GIST的平均发病年龄(58.8±11.7)岁,最多见于胃;其次为食管、直肠、结肠和小肠,其中小肠GIST发现较少的原因可能与小肠镜检查不如胃镜、结肠镜检查普及,小肠疾病的检查手段相对有限相关。
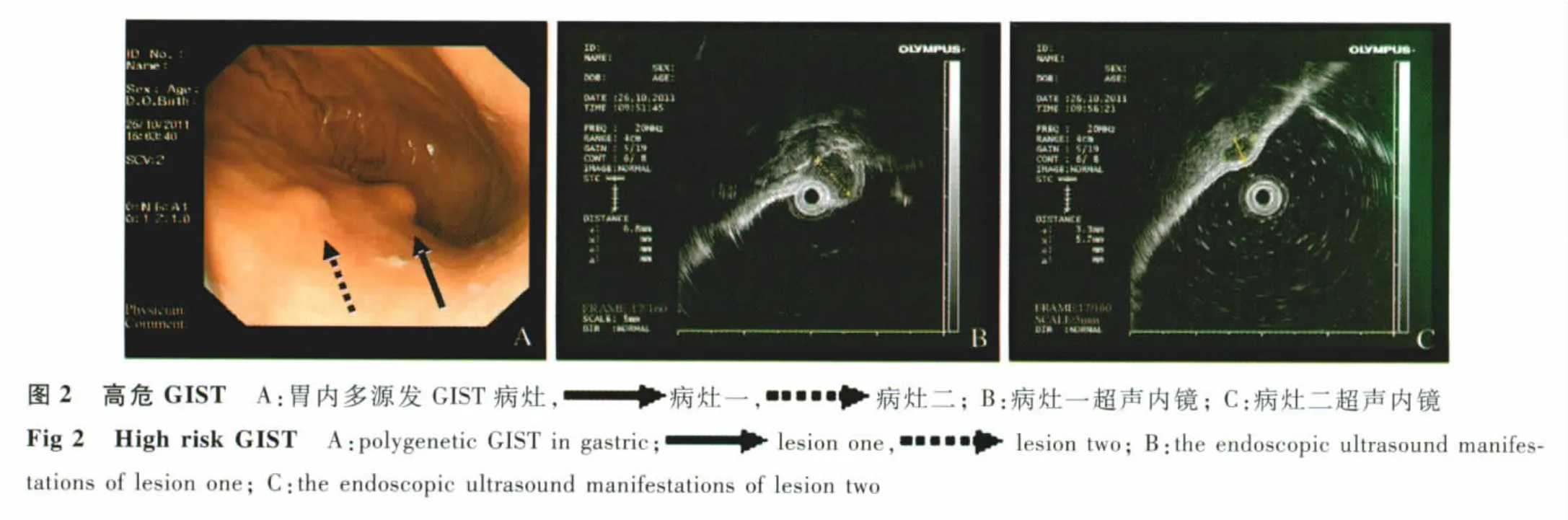
在治疗GIST前必须进行超声内镜检查,以明确肿物大小、回声、起源、生长方向等,这对治疗方式的选择及良恶性判断有重要意义。Palazzo等[7]认为瘤体<3 cm、边界光滑、内部回声均匀,提示为极低危GIST;瘤体>4 cm、边界不规则、瘤体内高低回声并存,提示为高危GIST。本研究发现,3例高危胃GIST均起自固有肌层,为低-中密度回声,且内部回声不均匀,最大直径分别为 0.7、0.8、3.0 cm,与 Palazzo 等认为恶性GIST一般情况下瘤体直径>3 cm不一致。本研究结果表明,瘤体大小与其危险等级评估可能并不呈正比,应结合超声内镜下回声是否均匀、边界是否清楚及病理学等指标进行综合判断。
我们在研究中还发现1例GIST在胃内呈多源性生长,其两处病灶最大直径分别为0.7 cm、0.6 cm,相距2 cm,超声内镜显示为中低回声,密度欠均匀,其中1处病灶术后病理提示为高危GIST,术后给予患者口服格列卫分子靶向治疗,目前随访疾病稳定。目前,关于多源性GIST与高危GIST的相关性问题,国内外未见其他报道,尚待进一步研究。
本研究结果表明,ESE适用于治疗直径<2 cm、位于黏膜肌层或固有肌层浅层、向腔内生长的瘤体。若瘤体位于固有肌层、向腔外生长、与浆膜层分界不清时,单纯内镜下治疗发生出血、穿孔的风险较大。本研究中3例GIST,其超声内镜显示瘤体起源于黏膜肌层、部分与浆膜界限不清、向腔外生长、直径均<2 cm,采用以内镜为主的腹腔镜辅助内镜手术,首先在胃镜下对GIST进行挖除,由于少部分瘤体与浆膜分离困难,术中发生了胃壁穿孔,继而在腹腔镜下对穿孔进行修补缝合。此两种技术相结合,既可完整切除瘤体,也避免了开腹手术,患者器官功能保留完整、创伤小。腹腔镜手术对病灶较小(瘤体直径<2 cm)和一些特殊部位的肿瘤(如腔内生长型或胃后壁肿瘤)定位困难[8],因此手术过程中可利用内镜的冷光源透射、内镜下钛夹标记等方式为腹腔镜手术进行准确定位。
学者Mochizuki等[9]认为腹腔镜下切除 GIST大小是有限度的,适合切除直径<5 cm的胃GIST。但Nguyen等[10]研究报道在腹腔镜下成功完整切除直径11.5 cm的胃GIST。本研究中采用胃镜腹腔镜双镜联合的方式,对6例直径>5 cm的胃GIST进行了成功切除,术后患者一般情况及创面愈合良好。由于GIST瘤体质脆,胃镜腹腔镜联合切除时推荐术中使用取物袋,避免肿瘤破裂播散[11]。因此只要术中操作细心得当,直径>5 cm的GIST可以安全、完整的在双镜联合下切除。
在本研究中,1例胃底后壁GIST瘤体深大,造成手术时间较长,患者术后出现肺部感染、腹腔感染,但后经抗感染治疗痊愈。从此例我们总结到,对于胃底体部较大瘤体者,应尽早选择腹腔镜为主的内镜辅助腹腔镜手术,采取腹腔镜通过胃前壁切口伸入胃内切除瘤体,这样可节省术中操作时间,减少患者术后并发症的发生。
位于胃底贲门的GIST也不少见,由于贲门具有重要功能,若行外科手术切除瘤体,则无法保留贲门功能[12],患者还会出现严重并发症,如重度反流性食管炎甚至食管狭窄等。本研究中有4例GIST位于胃底贲门附近,最近者距贲门仅1 cm,部分瘤体直径达6 cm,采用胃镜与腹腔镜双镜联合不仅可完整切除瘤体还使患者贲门功能保存良好,最大程度地减少了术后并发症,术后随访均无复发。
综上所述,胃镜与腹腔镜双镜联合及ESE是治疗GIST的微创、安全、科学、有效的新方法。胃镜与腹腔镜双镜联合技术有准确定位、创伤小、并发症少、对器官功能影响小等优点[13],双镜联合技术能很好地弥补腹腔镜和内镜治疗的局限性,增加了治疗的安全性,对GIST的治疗具有广阔的应用前景。
[1] Muenst S,Thies S,Went P,et al.Frequency,phenotype,and genotype of minute gastrointestinal stromal tumors in the stomach:an autopsy study[J].Hum Pathol,2011,42(12):1849-1854.
[2] Pelz AF,Agaimy A,Daniels M,et al.Gastrointestinal stromal tumor presenting as a rectovaginal mass.Clinicopathologic and molecular-genetic characterization of a rare tumor with a literature review[J].Hum Pathol,2011,42(4):586-593.
[3] Ho MY,Blanke CD.Gastrointestinal stromal tumors:disease and treatment update[J].Gastroenterology,2011,140(5):1372-1376.
[4] Lu AG.The technical advantages of laparoscopy combined with endoscopy in gastrointestinal tumors treatment[J].Chinese Journal of Practical Surgery,2010,30(3):226-228.
陆爱国.双镜联合治疗胃肠道肿瘤的技术优势[J].中国实用外科杂志,2010,30(3):226-228.
[5] Gastrointestinal Stromal Tumor of Chinese Expert Group.Gastrointestinal stromal tumors diagnosis and treatment of Chinese expert consensus[J].Chin J Gastrointest Surg,2009,12(5):536-539.
胃肠道间质瘤中国专家组.胃肠道间质瘤诊断与治疗中国专家共识[J].中华胃肠外科杂志,2009,12(5):536-539.
[6] Machairas A,Karamitopoulou E,Tsapralis D,et al.Gastrointestinal stromal tumors(GISTs):an updated experience [J].Dig Dis Sci,2010,55(12):3315-3327.
[7] Palazzo L,Landi B,Cellier C,et al.Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours[J].Gut,2000,46(1):88-92.
[8] Ma JJ,Hu WG,Zang L,et al.Laparoscopic gastric resection approaches for gastrointestinal stromal tumors of stomach[J].Surg Laparosc Endosc Percutan Tech,2011,21(2):101-105.
[9] Mochizuki Y,Kodera Y,Fujiwara M,et al.Laparoscopic wedge resection for gastrointestinal stromal tumors of the stomach:initial experience[J].Surg Today,2006,36(4):341-347.
[10] Nguyen SQ,Divino CM,Wang JL,et al.Laparoscopic management of gastrointestinal stromal tumors[J].Surg Endosc,2006,20(5):713-716.
[11] Hohenberger P,Ronellenfitsch U,Oladeji O,et al.Pattern of recurrence in patients with reptured primary gastrointestinal stromal tumour[J].Br J Surg,2010,97(12):1854-1859.
[12] Frankel TL,Wong SL.Surgical management of gastriintestianl stromal tumours[J].Curr Probl Cancer,2011,35(5):271-282.
[13] Walsh RM,Ponsky J,Brody F,et al.Combined ecdoscopic/laparoscopic intragastric resection of gastric stromal tumors[J].J Gastrointest Surg,2003,7(3):386-392.
The study of newMethodsin gastrointestinal stromal tumor therapy
GUO Hua,SHENG Jianqiu,YU Changzhong,JIN Peng,LI Na,ZHAO Xiaojun,WANG Haihong,WANG Xin,LI Aiqin,YU Dongliang,XIE Hui
Department of Gastroenterology,the Military General Hospital of Beijing PLA,Beijing 100700,China
ObjectiveTo explore the efficacy and safety of laparoscopy combined with endoscopy and endoscopic submucosal excavation(ESE)in gastrointestinal stromal tumor therapy.Methods37 patients were identified gastrointestinal stromal tumor by endoscopy,endoscopic ultrasonography,pathology and immunohistochemicalMethods.28 patients underwent endoscopic submucosal excavation(ESE),9 patients underwent laparoscopy combined with endoscopy.ResultsThe tumer was resected completely in all.All patients underwent endoscopic therapy resected the tumor completely.No bleeding and abodminal pain happened during and after the operation.Patient with gastric cardia tumor remained good function after the tumor resection.ConclusionLaparoscopy combined with endoscopy and ESE are minimal invasive,safe and effective newMethodsin gastrointestinal stromal tumor therapy.
Gastrointestinal stromal tumor;Endescopic submueosal excavation;Laparoscopy combined with endoscopy
R57
A
1006-5709(2012)08-0736-04
2012-05-10
10.3969/j.issn.1006-5709.2012.08.015
盛剑秋,E-mail:jianqiu@263.net

