纯六方相钛酸锌粉体的制备与表征
喻佑华 夏 萌 吴伟杰
(景德镇陶瓷学院材料与工程学院,江西景德镇 333001)
纯六方相钛酸锌粉体的制备与表征
喻佑华 夏 萌 吴伟杰
(景德镇陶瓷学院材料与工程学院,江西景德镇 333001)
以钛酸四丁酯、冰醋酸、盐酸、六水合硝酸锌为主要原料,采用溶胶-凝胶法,以去离子水作为溶剂制备出具有钛铁矿结构的纯六方相ZnTiO3粉体,并利用TG/DTA,XRD,FE-SEM和FT-IR对其组织结构和形貌进行了研究。实验结果表明:前驱体干凝胶在550℃热处理4h可制得纯六方相ZnTiO3,且六方相稳定存在的温度范围相对较宽,从550℃到900℃。当温度升高到950℃后,六方相ZnTiO3将分解为立方相Zn2TiO4和金红石相TiO2。在550℃热处理制得的ZnTiO3粉体粒径约为50nm。
溶胶-凝胶;低温烧结;纳米;ZnTiO3
0 引言
钛酸锌是一种白色粉体,由于其在高温脱硫吸附剂[1],微波介质陶瓷[2-4],白色颜料[5],NO,CO 探测传感器[6]和光致发光材料[7-9]等领域具有重要的应用潜力,近年来受到国内外研究人员的广泛关注。通常认为在ZnO-TiO2体系中存在三相:即偏钛酸锌ZnTiO3,正钛酸锌 Zn2TiO4和三钛酸锌 Zn2Ti3O8[10~12]。其中,Zn2TiO4是面心立方晶体结构,而ZnTiO3通常是六方菱形晶体结构,并且在温度高于945℃时会分解成正钛酸锌Zn2TiO4和金红石相TiO2[13]。处于亚稳态结构的Zn2Ti3O8是简单立方晶体结构,被认为是低温ZnTiO3的结构形式,存在于820℃以下[14]。
立方相Zn2TiO4可以比较容易的通过传统固相反应法制得,但是ZnTiO3在温度高于945℃时会分解成Zn2TiO4和TiO2,所以通过固相法混合物质的量之比为1∶1的ZnO和TiO2制备纯相ZnTiO3较难实现[10,15]。由于固相法合成ZnTiO3的诸多困难,加上成品的颗粒过大,化学均一性不好,因此溶液提供的良好均一性就能弥补这方面的不足。近年来,溶胶-凝胶法在陶瓷、玻璃、纤维和薄膜的制备中被广泛使用,并显示出优于传统固相法的许多优点,包括成分控制准确,热处理温度低以及液相中分子水平上的均匀混合等。在制备纳米ZnTiO3粉体方面,溶胶-凝胶法也备受青睐,但是绝大多数的研究者都会用到有机物作为溶剂(比如乙醇,乙二醇等),鲜有报道称使用无机溶剂(比如去离子水)合成钛酸锌粉体。
本文采用溶胶-凝胶法,以去离子水作为溶剂制备出纯六方相ZnTiO3粉体,并对其组织结构和形貌进行了表征。
1 实验部分
实验使用的原料均为分析纯试剂,分别为:钛酸四丁酯 Ti(OC4H9)4,冰醋酸 CH3COOH,盐酸 HCl,六水合硝酸锌Zn(NO3)2·6H2O等,实验步骤如图1。首先,按摩尔比CH3COOH/Ti(OC4H9)4=3.6∶1将适量冰醋酸加入到钛酸四丁酯中,室温下搅拌均匀,作为A液。将一定量盐酸稀释到1mol/L,盐酸和水的体积比为1∶10.9,作为B液。然后将A液缓缓滴加到B液中,边滴加边搅拌,钛酸四丁酯与盐酸摩尔比为1.4∶1,记为C液。最后,将六水合硝酸锌溶液按Zn/Ti=1∶1的摩尔比加入到C混合液中,继续在60℃加热搅拌直到形成淡黄色半透明清液。将清液置于100℃烘箱内干燥48h得到前驱体干凝胶,其中一部分用于热分析,另一部分在不同温度下煅烧,高温保温时间均为4h。
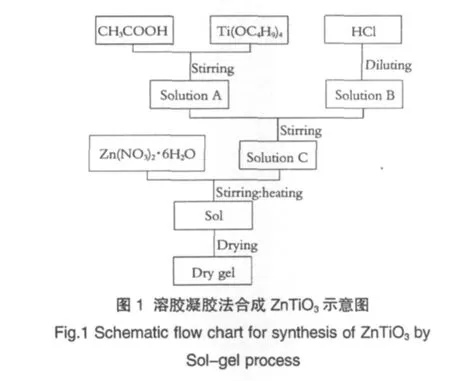
前驱体干凝胶的热分析(TG/DTA)采用NETZSCH STA 449C热分析仪进行,测试条件:空气气氛,温度范围:25~1000℃,升温速率:10℃/min;粉体相结构(XRD)采用Bruker AXS D8Advance X射线衍射仪分析,靶材为Cu靶,扫描速率1.0°/min,步长0.02°;显微结构(FE-SEM)采用JSM-6700F场发射扫描电镜分析;红外振动分析(FT-IR)采用NICOLET 5700傅立叶变换红外光谱仪表征,测量范围:400~4000cm-1。
2 实验结果与讨论
2.1 热分析
图2是将前驱体干凝胶进行热重-差热分析(TG/DTA)得到的实验图谱。从图中可以看出,前驱体的热重变化可以分为3个阶段:第一个阶段从室温到300℃,失重率14.72%。由于吸附水的挥发一般起始于80℃,而醋酸的挥发温度在190℃左右,所以这部分失重可以归因于水和有机酸的挥发,对应的在DTA曲线上75~300℃之间出现了一个明显的吸热峰。320~400℃是失重的第二阶段,失重率18.21%,这主要是由于Ti-OH的脱羟基作用形成TiO2引起的,在DTA曲线上360℃左右对应着一个非常尖锐的吸热峰。最后一个失重阶段发生在430~570℃,这是NO3-的热分解和六方相ZnTiO3的结晶作用共同导致的,失重率11.64%。在600℃以上,基本观察不到样品的失重现象,但在950℃左右出现了一个吸热峰,这是由于六方相ZnTiO3的分解所致,与文献报道相符[13]。
2.2 物相分析
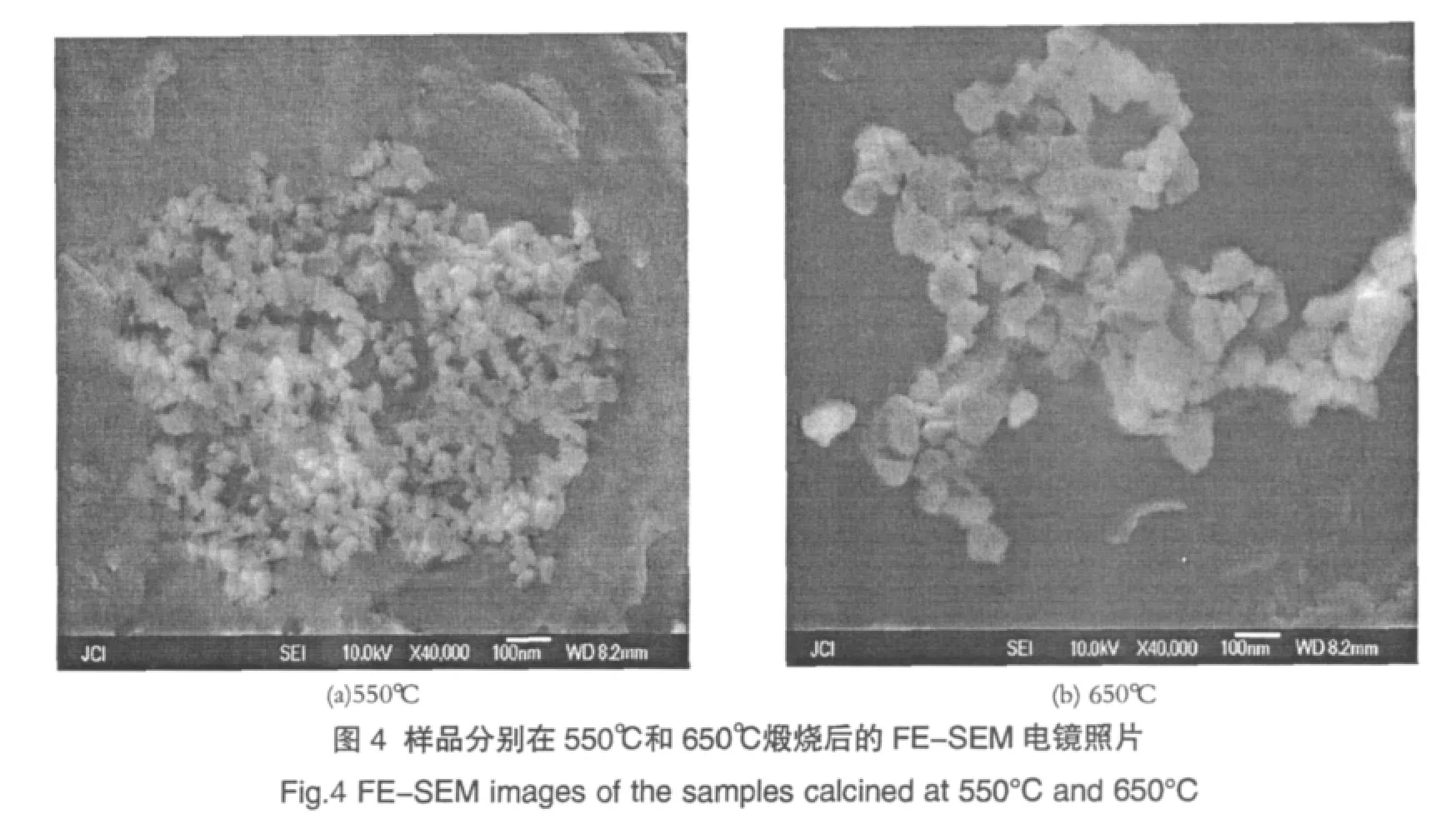
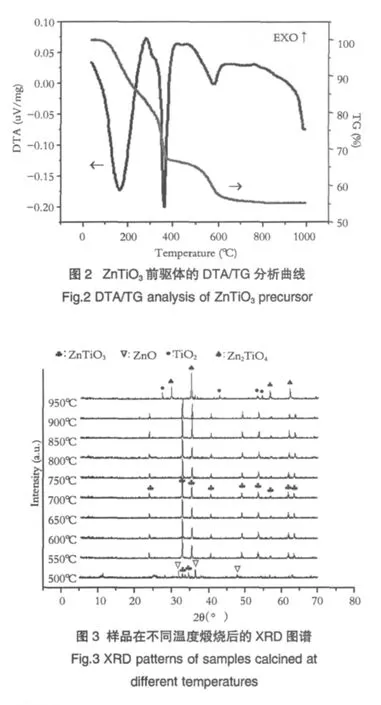
图 3 为前驱体分别在 500、550、600、650、700、750、800、850、900 和 950℃煅烧,高温保温 4h 得到的粉体XRD图谱。从图中可以看出,样品在500℃煅烧后,六方相ZnTiO3开始形成,但是衍射峰强度不高,且样品中还有ZnO相残留。这说明ZnTiO3的结晶作用正在进行,还没完全结束。因为前驱体首先要经过Ti-OH的脱羟基作用和Zn(NO3)2的分解分别产生TiO2和ZnO,然后TiO2和ZnO在一定温度下通过化学反应才能生成ZnTiO3。当温度提高到550℃之后,ZnTiO3成为样品中唯一晶相,经JCPDF卡对照确定为钛铁矿结构的六方相ZnTiO3,晶格常数为:a=5.079Å,c=13.927Å。这与 DTA 曲线中 560℃左右出现的吸热峰相对应。随着煅烧温度进一步升高,样品中除了主晶相的衍射峰强度更大之外,没有其他任何变化,这说明晶粒发育逐渐趋于完整,热分析在这个阶段也几乎观察不到任何变化。温度升高到950℃时,样品中出现了立方相Zn2TiO4和金红石相TiO2,这是六方相ZnTiO3分解所致,对应于DTA曲线上950℃左右的吸热峰。ZnTiO3的分解可能是由于高温下氧化锌向挥发性锌的转变,从而导致了钛酸锌中锌的缺乏,继而产生亚化学计量。
从XRD图谱还可以看出,六方相ZnTiO3稳定存在的温度可以从550℃到900℃,这一温度范围与目前文献中报道的比较相对更宽。
2.3 形貌分析
图4为前躯体分别在550℃和650℃煅烧4h后的场发射扫描电镜(FE-SEM)照片。图4(a)为样品在550℃煅烧4h后的电镜照片,可以看出粉体颗粒大小比较均匀,但形状不规则,颗粒尺寸在50nm左右;图4(b)是样品在650℃煅烧4h后的电镜照片,与图4(a)相比,图4(b)中的颗粒尺寸明显增大,约为100nm,说明随着煅烧温度的提高,晶粒逐渐发育完全,晶型不断趋于完整,这与XRD图谱的分析结果相一致。
2.4 红外光谱分析
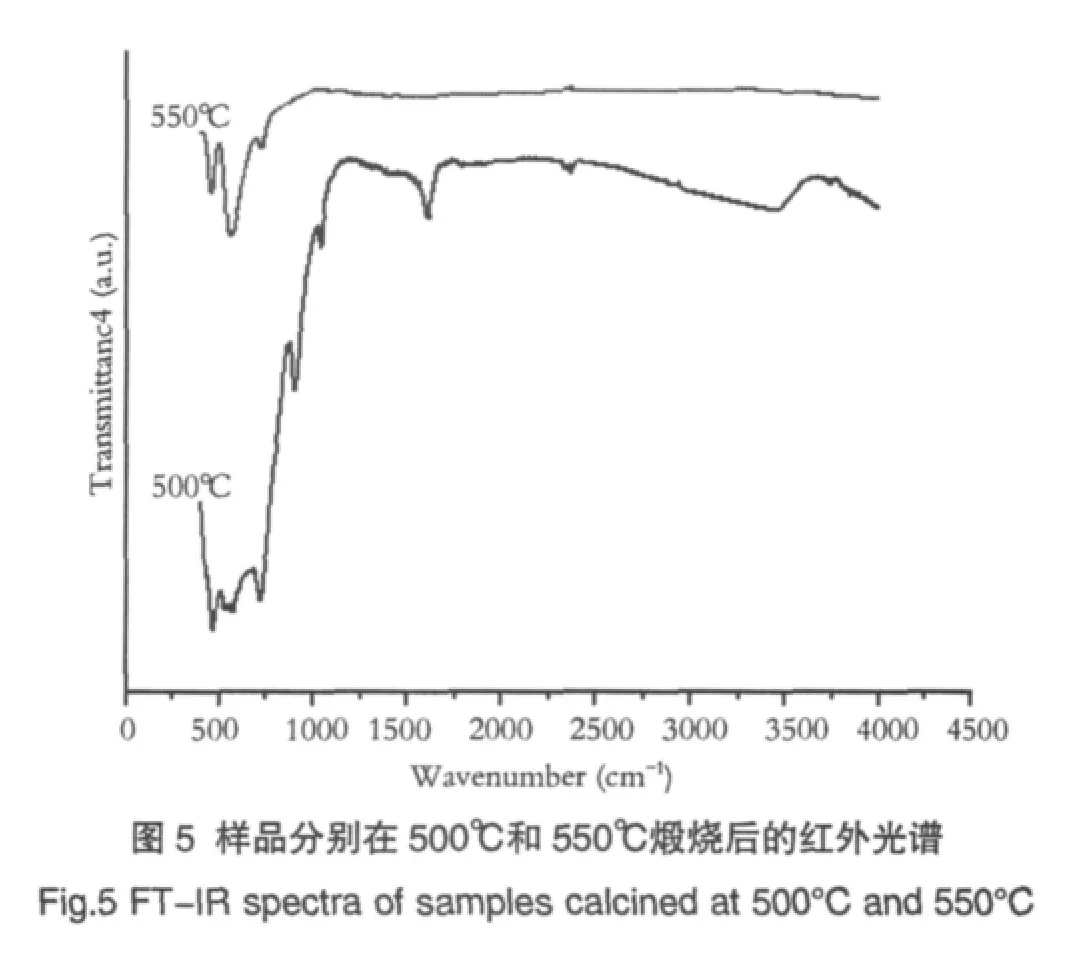
图5为样品分别在500℃和550℃煅烧后得到的红外光谱。从图中可以看出,在400~1200cm-1的波长范围内,500℃和550℃煅烧的粉体中均出现了非常明显的吸收带,这是由于Ti-O键的伸缩振动[16]引起的,因为 ZnTiO3,Zn2TiO4和 Zn2Ti3O8中都存在 TiO6基团,这与Yamaguchi的报道[13]相符。在1500~1700cm-1范围内,500℃煅烧的样品中出现了对应于N-O键振动的明显吸收带,而在550℃煅烧的样品中却没有观察到这一现象。产生的这一结果的原因是随着煅烧温度的提高,NO3-逐渐分解完全,这与热分析和物相分析的结果一致。
3 结论
本文采用溶胶-凝胶法,以去离子水作为溶剂,在550℃煅烧4h制备出具有钛铁矿结构的纳米纯六方相ZnTiO3粉体。随着温度升高,晶粒发育更加完全且晶型趋于完整。纯六方相ZnTiO3可以稳定存在的温度范围是:550~900℃。在550℃煅烧得到的粉体颗粒尺寸约为50nm。
1 MOJTAHEDI W,ABBASIAN J.Cyclic tests.Energy&Fuels,1995,9:429~434
2 HAGA K,ISHII T,MASHIYAMA J,et al.Jpn.J.Appl.Phys.,1992,31:3156~3159
3 KIM H T,BYUN J D,KIM Y.Mater.Res.Bull.,1998,33:963~973
4 KIM H T,KIM S H,NAHM S,et al.J.Am.Ceram.Soc.,1999,82:3043~3048
5 MCCORD A T,SAUNDER H F.Ceram.Abs.,1945,24:155
6 OBAYASHI H,SAKURAI Y,GEJO T.Solid State Chem.,1976,17:299~303
7 WANG S F,LM K,GU F,et al.Inorg.Chem.Commun.,2003,6:185~188
8 WANG S F,LU M K,GU F,et al.J.Phys.Chem.Solids.,2004,65:1243~1245
9 WANG S F,LU M K,GU F,et al.Chem.Phys.Lett.,2003,373:223~227
10 DULIN F H,RASE D E.J.Am.Ceram.Soc.,1960,43:125~131
11 CHANG Y S,CHANG Y H,CHEN I G,et al.J.Alloys Compd.,2003,354:303~309
12 KIM H T,NAHM S,BYUN J D,et al.J.Am.Ceram.Soc.,1999,82:3476~3480
13 YAMAGUCHI O,MORIMI M,KAWABATA H,et al.J.Am.Ceram.Soc.,1987,70:C97~C98
14 STAINIKE U,WALLIS B.Cryst.Res.Technol.,1997,32:187~193
15 BARTRAM S F,SLEPETYS R A.J.Am.Ceram.Soc.,1961,44:493~499
16 LAST J T.J.Phys.Rev.,1957,105:1740~1750
Synthesis and Characterization of Pure Hexagonal ZnTiO3Powder
YU YouhuaXIA MengWU Weijie
(School of Material Science and Engineering,Jingdezhen Ceramic Institute,Jingdezhen Jiangxi 333001 China)
Pure hexagonal ZnTiO3powder was successfully synthesized by sol-gel method using deionized water as solvent.The as-prepared powder was characterized by thermogravimetric/differential thermal analysis(TG/DTA),X-ray diffraction(XRD),field emission scanning electron microscopy(FE-SEM)and Fourier-transforming infrared spectroscopy(FT-IR).The results showed that pure hexagonal ZnTiO3powder could be obtained by calcining the resultant derived from sol-gel process at a relatively low temperature of 550℃.Moreover,it had been found that the pure hexagonal ZnTiO3could exist in a relatively wide temperature range of 550~900℃.When the temperature increased up to 950°C,hexagonal ZnTiO3would decompose into cubic Zn2TiO4and rutile.The size of the particles calcined at 550℃is about 50nm.
sol-gel process;low temperature sintering;nanometer;ZnTiO3
on Feb.21,2012
T Q 1 7 4.7 5
A
1000-2278(2012)03-0300-04
2012-02-21
江西省教育厅科技基金资助项目(No.赣教技字[2007]220号)
夏萌,E-mail:xiameng326@hotmail.com
XIA Meng, E-mail: xiameng326@hotmail.com

