纳米银在小鼠体内的组织分布
张姗姗 薛玉英 唐 萌 张 婷 刘晓闰 张 鹏 张智勇
(1东南大学环境医学工程教育部重点实验室,南京 210009)
(2东南大学江苏省生物材料与器件重点实验室,南京210009)
(3东南大学公共卫生学院,南京 210009)
(4中国科学院高能物理研究所,北京 100049)
纳米银在小鼠体内的组织分布
张姗姗1,2,3薛玉英1,2,3唐 萌1,2,3张 婷1,2,3刘晓闰1,2,3张 鹏4张智勇4
(1东南大学环境医学工程教育部重点实验室,南京 210009)
(2东南大学江苏省生物材料与器件重点实验室,南京210009)
(3东南大学公共卫生学院,南京 210009)
(4中国科学院高能物理研究所,北京 100049)
将分散在生理盐水中的纳米银以尾静脉注射的方式注入小鼠体内,采用电感耦合等离子质谱(ICP-MS)法检测其在小鼠体内的组织分布情况,并利用DAS药物动力学软件分析其在血液中的动力学参数.实验结果显示:纳米银经尾静脉注射进入小鼠体内后,血液中的w(Ag)在染毒1 h内呈快速下降趋势,其后的24 h内w(Ag)处于平稳状态;纳米银在体内的消除半衰期为22.8 h,分布容积为26.8 L/kg;进入体内的纳米银可随血液循环快速分布到全身各脏器,6 h后即可在小鼠的多个主要脏器中检测到银的存在,其中脾脏中的w(Ag)约为203 μg/g;滞留在体内的银主要分布在肝脏和脾脏中.由此可见,纳米银具有较高的组织亲和力,肝脏和脾脏可能是纳米银的主要蓄积作用靶器官.
纳米银;尾静脉注射;组织分布
银是一种应用历史悠久的贵金属,具有良好的杀菌能力.利用现代纳米技术将银纳米化后,银显示出非同寻常的理化特性和生物效应,并具有极强的杀菌效能[1-2].与其他纳米材料一样,纳米银具有量子尺寸效应、表面效应、宏观量子隧道效应以及光催化性等独特的性能.这些特性使纳米银广泛应用于医学、电学、光学等各个方面,成为商品化程度最高的纳米材料.在骨植入手术中,用纳米银作为抗菌剂,既有良好的抗菌效应,又能将其对体内细胞的毒性降到最低.纳米银可通过多种途径进入人体,与人体的组织、细胞甚至生物大分子直接接触,并可能产生多种生物效应,对人类健康产生潜在影响.研究表明,纳米银作用于胚胎干细胞时,可以引起细胞线粒体功能的损伤和LDH水平的升高[3];纳米银还会引起动物体内多个脏器发生病理改变[4-6].因此,纳米银的生物安全性受到极大关注.了解纳米银的生物分布是研究其生物效应的前提,需要定量检测出纳米银在不同组织器官中的分布.相关报道表明,纳米银可从暴露部位穿越生物屏障进入体循环,进而分布到全身不同组织[5-7].体内动力学行为的研究有助于了解纳米银在生物转运和转化过程中的动态规律;根据所得的动力学参数,阐述一定剂量、途径下纳米银的吸收、分布、消除特征,为完善纳米材料毒性研究的实验设计提供依据.本文采用静脉注射的方式将纳米银注入小鼠体内,采用ICP-MS法检测纳米银在体内的生物分布情况,为进一步研究纳米银的生物学效应和生物应用提供科学依据.
1 材料和方法
1.1 试剂和仪器
主要试剂包括:粒径为12~20 nm的纳米银粉体(上海沪正纳米科技有限公司);BV-Ⅲ级硝酸(北京化学试剂研究所);MOS级质量分数为30%的过氧化氢(北京化学试剂化学所);Ag标准溶液(国家钢铁材料测试中心钢铁研究总院);In标准溶液(国家钢铁材料测试中心钢铁研究总院).
主要仪器包括:X7型电感耦合等离子体质谱仪(美国Thermo Elemental公司);AT201型电子天平(瑞士Mettler-Toledo仪器有限公司);Milli-Q纯水仪(美国Millipore公司);S-4800型扫描电子显微镜(日本Hitachi公司);Nano-ZS90型粒径分析仪(英国Malvern公司).
1.2 纳米银的材料表征
经过扫描电镜分析后,将纳米银粉体分散在生理盐水中.涡旋混匀后采用超声处理45 s,以达到稳定状态.然后,用粒径分析仪分析溶液中粒子的粒径.
1.3 动物
实验中所用的ICR小鼠购自江苏省南京市青龙山动物繁殖场,动物许可证号为scxk(苏)2008-0010.实验动物饲养于东南大学公共卫生学院SPF实验动物中心,严格控制饲养环境:温度为(22±2)℃,相对湿度为(65±10)%,正常通风换气,每日人工照明12 h.小鼠饲养于垫有消毒木屑的塑料笼内,每笼5只,每周更换垫料2次.在整个实验中,小鼠可以自由饮用灭菌去离子水和摄入标准饲料.
1.4 纳米银在小鼠血液中的动力学分析
实验中选用90只ICR小鼠,其体重为24~26 g,随机分为9组,其中8组为实验组,1组为对照组,将质量比为120 μg/g的纳米银溶液尾静脉注射入小鼠体内.染毒时,将小鼠扣住,固定尾部使小鼠尾巴绷直,缓慢地将注射器插入尾静脉中,单只动物染毒在40 s内完成.对照组注射生理盐水.纳米银溶液于临用前配制.染毒后,按照不同时间点(0.15,0.3,0.5,1,3,6,12,24 h)分批摘除眼球取血,每只动物取血量为 0.7 ~1.0 mL.对照组于24 h时摘除眼球取血.血样于-60℃下保存待测.利用ICP-MS检测血液中的w(Ag)后,采用DAS药物动力学软件对数据进行处理,计算浓度-时间曲线下面积(Ac-t)、半衰期(t1/2)、平均驻留时间(TMR)、清除率(CL)以及分布容积(Vd)等动力学参数.其中,浓度-时间曲线下面积是指血液中的w(Ag)对时间作图所得曲线下的面积,积分求得;半衰期是指血液中的w(Ag)下降一半所需要的时间,即t1/2=0.693/k,其中k为消除速率常数;平均驻留时间是指纳米银在体内的平均驻留时间,大于消除半衰期;清除率是指单位时间内生物体所有途径能够消除的纳米银占有的血浆容积值,即CL=kVd=X0/Ac-t,其中X0为染毒质量浓度;分布容积是指1 kg生物体中纳米银均匀分布时所占体液的体积,即Vd=X0/C0,其中C0为染毒开始时血液中纳米银的质量浓度.
1.5 纳米银在小鼠体内的分布
实验中选用80只ICR小鼠,其体重为24~26 g,随机分为8组,其中5组为实验组,3组为对照组.染毒质量浓度和方式同1.4节.染毒后,按照设定时间点(0.25,0.5,1,7,14 d)剖取肺、肝、脾、肾.向对照组注射生理盐水,并于1,7,14 d剖取肺、肝、脾、肾.对脏器进行称重,计算出脏器系数,而后置于-60℃下保存待测.
1.6 样品处理与ICP-MS分析
称量血液样本约0.1 mL或组织样品40~80 mg,置于锥形瓶中,加入5 mL HNO3,静置过夜.次日,加入1 mL质量分数为30%的H2O2溶液.将混合物置于电热板上消解,电热板缓慢升温至200℃,使锥形瓶中的混合物挥发至1 mL左右,再将液体转移到离心管中,用质量分数为2%的HNO3溶液将其定容至 10 mL,进行 ICP-MS分析[8].配制一系列浓度的标准银溶液,用以绘制标准曲线,进行纳米银的定量检测.标准曲线为Y=5 741.5X+138,相关系数为0.999 9.
1.7 数据处理
实验数据均以平均数和标准差相组合的方式表示,用SPSS 13.0软件进行单因素方差分析.实验组与对照组的比较采用Dunnett's法,实验组之间的两两比较采用LSD法、SNK法或Dunnett's法,当p<0.05时认为差异具有统计学意义.
2 实验结果
2.1 纳米银的表征结果
扫描电子显微镜结果显示,纳米银粉体中颗粒分散均匀,无团聚现象(见图1).粒径分析结果显示,质量浓度为12 mg/mL的纳米银溶液中颗粒大小不均匀,平均粒径为54.99 nm,较粉体状态时稍大(见表1).

图1 纳米银的扫描电子显微镜照片

表1 纳米银溶液中颗粒粒径分布表
2.2 血液中的w(Ag)和动力学参数
纳米银以120 μg/g的剂量经小鼠尾静脉注射到生物体内后,血液中w(Ag)的经时变化见图2.血液中的w(Ag)在1 h内呈快速下降趋势,1 h时出现一谷浓度,随后w(Ag)略有升高,并在24 h内呈平稳状态.对照组血样中w(Ag)等于0.
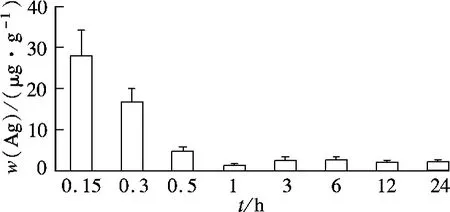
图2 不同时间点小鼠血液中的w(Ag)
纳米银经过单次尾静脉注射进入体内后,根据血液中w(Ag)的变化,采用DAS药物动力学软件计算得到主要动力学参数.10只小鼠血液中的平均动力学参数见表2.

表2 尾静脉注射纳米银后10只小鼠血液中的平均动力学参数
2.3 脏器中的w(Ag)
对小鼠尾静脉注射纳米银溶液后,于1,7,14 d剖取主要脏器(肺、肝、脾和肾),称重计算脏器系数.在每个对照组和实验组中,均对10只小鼠主要脏器的脏器系数进行统计,结果见表3.由表可知,染毒1 d后的脾脏(p=0.001)、7 d后的肾脏(p=0.044)、14 d 后的肝脏(p=0.00)和脾脏(p=0.002)的脏器系数与相应时间对照组结果比较具有统计学差异.
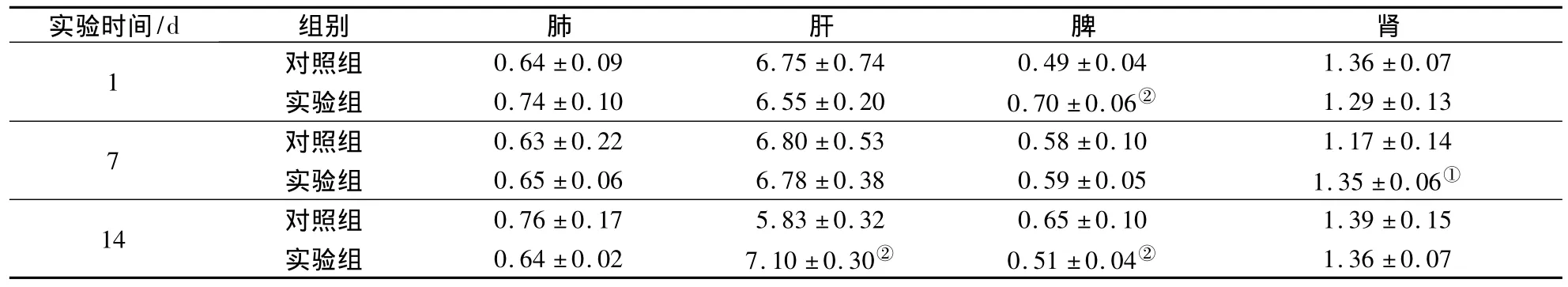
表3 小鼠主要脏器的脏器系数
小鼠染毒后,按照设定时间点剖取脏器,利用ICP-MS检测脏器中的w(Ag),统计结果见图3.由图可知,各时间点脾脏中的w(Ag)最高,是肾脏中的20~80倍,随着时间的变化,脾脏中的w(Ag)并未出现明显降低;染毒1 d内肝脏中的w(Ag)约为120 μg/g,1 d后此数值明显降低;肺脏中的w(Ag)在染毒1 d后开始显著下降;肾脏中的w(Ag)在染毒14 d后略有升高.
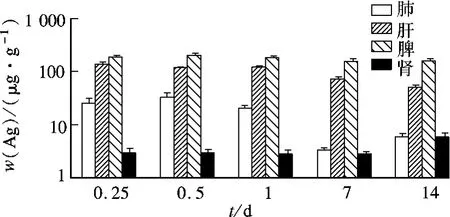
图3 不同时间点小鼠主要脏器中的w(Ag)
3 讨论
在医疗卫生领域,含有纳米银的医疗产品与人体密切接触,其负载的纳米银可能在人体内蓄积而产生潜在影响[9].现有研究表明,纳米银具有神经毒性[10]、细胞毒性[3,11]和蓄积性[12],因此其生物安全性及生物学效应备受关注.了解纳米银的生物分布是研究纳米银生物学效应的前提.本文利用尾静脉注射的方法,模拟纳米银直接与生物血液接触,研究其在血液中的动力学变化以及生物分布.
单次尾静脉注射纳米银后,1 d内定时取血,检测血液中的w(Ag).血液中约90%的银在1 h内消除,血液动力学分析结果显示:血液中银的消除半衰期为(22.81 ±10.85)h.1 h后血液中的w(Ag)略有升高,这可能是由于纳米银到达各个脏器后重新分布的结果.注射1 d后,各主要脏器中的w(Ag)均较高,特别是在肝脏和脾脏中,w(Ag)分别是血液中的53倍和80倍,表明纳米银对肝脏和脾脏有较强的组织亲和性,其蓄积器官与纳米四氧化三铁的蓄积器官相近[13].利用DAS药物动力学软件进行数据处理,经统计矩非房室模型拟合,获得纳米银在血液中的动力学参数.血液中银的消除半衰期为(22.81±10.85)h,清除率为(0.89 ±0.24)L/(h·kg),分布容积为(26.84 ±8.96)L/kg;大的分布容积为纳米银可能在组织器官中产生蓄积提供了数据支持.这与Chen等[14]的研究结果一致.组织分布研究表明,纳米银可迅速分布至肺、肝、脾、肾等主要脏器,特别是在肝脏和脾脏中,染毒14 d后w(Ag)仍然维持在较高水平,说明纳米银在肝脏和脾脏存在蓄积.此外,实验中还发现其他组织器官中也有少量的纳米银检出,检出量小于1 μg/g.
已有研究发现,纳米银可能导致肝脏[4-5]和肺脏[4-6]发生组织病理改变.在本文实验中,染毒6 h后肝脏中的w(Ag)为 139.25 μg/g,1 d 后开始明显降低,由此推测,小鼠体内部分纳米银在染毒1 d后就开始通过肝脏排泄.这与Fuchner等[15]的研究结果一致.脾脏中的w(Ag)是各主要脏器中最高的,且滞留量至14 d时仍未出现明显的降低趋势;肝脏中的w(Ag)次之.因此,脾脏和肝脏是纳米银主要的蓄积作用靶器官.经皮下植入的纳米银同样可以在动物的多个脏器中蓄积,其中脾脏中的w(Ag)最高,约为肾脏中的 1.5 倍[16].经呼吸道进入生物体内的纳米银主要蓄积于肺脏[5],这可能与纳米材料的暴露方式不同有关.由此推测,不同纳米材料经过不同的途径进入生物体内,其蓄积作用靶器官不同.
4 结语
根据纳米银在小鼠体内的血液动力学和组织分布情况得出,纳米银具有较高的组织亲和力,且脾脏和肝脏可能是纳米银的主要蓄积作用靶器官.纳米材料的多样性及其所具有的尺寸效应、表面效应等特性,都可能影响其在体内的动力学变化和生物分布,从而影响其生物效应.因此,对纳米材料体内动力学变化和组织分布的深入研究,有助于阐明作用靶器官,为揭示作用机制和安全性评价奠定基础.
[1]Lee K S,El-Sayed M A.Gold and silver nanoparticles in sensing and imaging:sensitivity of plasmon response to size,shape,and metal composition [J].J Phys Chem,2006,110(39):19220-19225.
[2] Liu H H,Cao X,Yang Y,et al.Array-based nano-amplification technique was applied in detection of hepatitis E virus[J].J Biochem Mol Biol,2006,39(3):247-252.
[3] Braydich-Stolle L,Hussain S,Schlager J J,et al.In vitro cytotoxicity of nanoparticles in mammalian germline stem cells[J].Toxicol Sci,2005,88(2):412-419.
[4]张姗姗,杨扬,陆敏玉,等.纳米银溶液尾静脉注射的小鼠急性毒性研究[J].中国公共卫生,2011,27(3):326-327.
Zhang Shanshan,Yang Yang,Lu Minyu,et al.Acute toxic effects of nanosilver in mice via intravenous injection[J].Chinese Journal of Public Health,2011,27(3):326-327.(in Chinese)
[5] Kim Y S,Kim J S,Cho H S,et al.Twenty-eight-day oral toxicity,genotoxicity,and gender-related tissue distribution of silver nanoparticles in sprague-dawley rats[J].Inhalation Toxicology,2008,20(6):575-583.
[6] Takenaka S J,Erwin K,Christa R,et al.Pulmonary and systemic distribution of inhaled ultrafine silver particles in rats[J].Environ Health Perspect,2001,109(4):547-551.
[7] Loeschner K,Hadrup N,Qvortrup K,et al.Distribution of silver in rats following 28 days of repeated oral exposure to silver nanoparticles or silver acetate[J].Particle and Fibre Toxicology,2011,8(1):18-31.
[8] Mo T Z,Wei Y F,Yun W,et al.Particokinetics and extrapulmonary translocation of intratracheally instilled ferric oxide nanoparticles in rats and the potential health risk assessment[J].Toxicological Sciences,2009,107(2):342-351.
[9]薛玉英,唐萌.纳米银生物学效应研究进展[J].东南大学学报:自然科学版,2009,39(6):1315-1320.
Xue Yuying,Tang Meng.Research progresses in biological effects of nanosilver[J].Journal of Southeast University:Natural Science Edition,2009,39(6):1315-1320.(in Chinses)
[10] Tang J L,Xiong L,Wang S,et al.Distribution,translocation and accumulation of silver nanoparticles in rats[J].Journal of Nanoscience and Nanotechnology,2009,9(8):4924-4932.
[11] Hsin Y H,Chen C F,Huang S,et al.The apoptotic effect of nanosilver is mediated by a ROS-and JNK-dependent mechanism involving the mitochondrial pathway in NIH3T3 cells[J].Toxicol Lett,2008,179(3):130-139.
[12] Kiruba D,Tharmaraj V,Anitha S T,et al.Toxicity and immunological activity of silver nanoparticles[J].Applied Clay Science,2010,48(4):547-551.
[13] Wang Jun,Chen Yue,Chen Baoan,et al.Pharmacokinetic parameters and tissue distribution of magnetic Fe3O4nanoparticles in mice[J].Int J Nanomedicine,2010,21(5):861-866.
[14] Chen Zhen,Chen Hu,Meng Huan,et al.Bio-distribution and metabolic paths of silica coated CdSeS quantum dots[J].Toxicology and Applied Pharmacology,2008,230(3):364-371.
[15]Fuchner J E,Richmond C R,Drake G A.Comparative metabolism of radionuclides inmammals—Ⅳ:retention of sliver-110m in the mouse,rat,monkey,and dog[J].Health Phys,1968,15(6):505-514.
[16]陈丹丹,奚延斐,白净,等.纳米银和微米银在大鼠组织器官中的分布[J].北京生物医学工程,2007,26(6):164-179.
Chen Dandan,Xi Yanfei,Bai Jing,et al.Nanosilver subchronic toxicity and silver distribution in different rat tissues [J].Beijing Biomedical Engineering,2007,26(6):164-179.(in Chinese)
Biodistribution of nanosilvers in mice
Zhang Shanshan1,2,3Xue Yuying1,2,3Tang Meng1,2,3Zhang Ting1,2,3Liu Xiaorun1,2,3Zhang Peng4Zhang Zhiyong4
(1Key Laboratory of Environmental Medicine and Engineering of Ministry of Education,Southeast University,Nanjing 210009,China)
(2Jiangsu Key Laboratory for Biomaterials and Devices,Southeast University,Nanjing 210009,China)
(3School of Public Health,Southeast University,Nanjing 210009,China)
(4Institute of High Energy Physics,Chinese Academy of Sciences,Beijing 100049,China)
Nanosilvers dissolved in saline were injected intravenously by tail vein into mice.The concentration of nanosilvers in blood and organs was detected by the inductively coupled plasma mass spectrometry(ICP-MS),and the kinetic parameters in blood were evaluated by the drug and statistical software(DAS).The experimental results indicate that the concentration of nanosilvers in blood is dropped rapidly in one hour after injection,and gradually becomes stable in the following 24 h.The elimination half-life in blood is 22.8 h,and the volume of distribution is 26.8 L/kg.After injection,the nanosilvers are quickly distributed to the organs following blood circulation.After 6 h the nanosilver can be detected in the main organs,and the maximum concentration of nanosilvers,about 203 μg/g,is in spleen.The majority of the nanosilvers are accumulated in liver and spleen.Therefore,nanosilvers have good biocompatibility with the tissues.The liver and spleen are the main target organs for nanosilvers.
nanosilver;tail vein injection;biodistribution
R994.6
A
1001-0505(2012)02-0388-05
10.3969/j.issn.1001 -0505.2012.02.037
2011-08-19.
张姗姗(1985—),女,硕士生;薛玉英(联系人),女,博士,教授,yyxue@seu.edu.cn.
国家重点基础研究发展计划(973计划)资助项目(2011CB933404)、国家自然科学基金资助项目(30972504)、江苏省自然科学基金资助项目(BK2011606)、东南大学科技基金资助项目(KJ2010440).
张姗姗,薛玉英,唐萌,等.纳米银在小鼠体内的组织分布[J].东南大学学报:自然科学版,2012,42(2):388-392.[doi:10.3969/j.issn.1001 -0505.2012.02.037]

