复方特比萘芬纳米乳的皮肤安全性及经皮渗透性试验
刘梅雪,欧阳五庆,吴敬超,宋 冰,芮 弦
(西北农林科技大学 动物医学院,陕西 杨凌712100)
特比萘芬是广谱抗真菌新一代丙烯胺类药物,其作用机制是通过高选择性抑制真菌细胞膜内麦角甾醇合成过程中的角鲨烯环氧化酶使鲨烯积聚而产生杀菌作用,其抗菌谱广,抗菌作用强,作用持久且毒性低[1]。纳米乳是由油相、水相、表面活性剂及助表面活性剂以适当比例混合形成的一种透明或半透明、低黏度的动力学和热力学稳定体系,其粒径一般介于1~100nm之间[2]。纳米乳作为极具潜力的新型药物载体,具有其他药物载体不可比拟的优点,如增强药效、提高药物生物利用度、缓释靶向和透皮性好等优点[3]。近年来,透皮吸收制剂的应用开发越来越多,而纳米乳因其特有的理化性质,在透皮吸收制剂的研究方面受到了极大的关注。
在皮肤真菌病中,由于真菌菌丝可侵入角质层深部,因此,抗真菌药物中表皮给药剂型的疗效与其经皮渗透能力有关。本试验以小鼠皮肤为模型,应用改良的Franz立式扩散池,对受试动物复方特比萘芬纳米乳进行了体外经皮透过性评价,考察了其主药特比萘芬的经皮渗透性[4],并通过皮肤刺激性试验、皮肤急性毒性试验和皮肤过敏试验对复方特比萘芬纳米乳进行安全性评价,以期为兽医临床安全给药提供科学依据。
1 材料与方法
1.1 主要药品与试剂 特比萘芬,购自大连美仑生物技术有限公司;肉豆蔻酸异丙酯,购自浙江物美化学品有限公司;吐温-80,购自天津市恒星化学试剂制造有限公司;甲醇、乙腈为色谱纯试剂,其他试剂如醋酸铵、磷酸二氢铵等均为国产分析纯。
1.2 试验动物 健康家兔70只,体重约在2.0~2.5kg之间;白色豚鼠30只,体重约在250~300g之间;昆明系小鼠6只,体重在20~22g之间,均购自中国人民解放军第四军医大学实验动物中心。
1.3 主要仪器 UV-2450紫外-可见分光光度计(日本岛津公司);Hitachi高效液相色谱仪配紫外检测器(日本 Hitachi公司);HC-188透皮扩散仪(天津市正通科技有限公司);Diamonsil C18柱、电子天平及AS-3120超声仪等。
1.4 复方特比萘芬纳米乳及空白纳米乳的制备
1.4.1 复方特比萘芬纳米乳的制备 室温下,按配方量将特比萘芬及其复方成分溶于肉豆蔻酸异丙酯(IPM)中,然后加入无水乙醇使其全部溶解,再加入吐温-80搅拌均匀,最后边搅拌边滴加配方量的蒸馏水,即可制备出复方特比萘芬纳米乳。
1.4.2 空白纳米乳的制备 室温下,按配方量将肉豆蔻酸异丙酯加入无水乙醇中使其全部溶解,再加入吐温-80搅拌均匀,最后边搅拌边滴加配方量的蒸馏水,即可制备出空白纳米乳。
1.5 皮肤刺激性试验
1.5.1 动物分组 选择健康家兔36只(单次给药皮肤刺激性试验和多次给药皮肤刺激性试验各18只),随机分为生理盐水组、空白纳米乳组和复方特比萘芬纳米乳组,每组6只(完整皮肤和破损皮肤各3只)。
1.5.2 试验动物的处理 将上述已分好组别的家兔于给药前24h,用剪毛剪除去脊柱两侧被毛,然后均匀涂抹脱毛剂,2min后,用干棉球沾温水将脱毛剂和脱落的被毛一并洗干净,去毛面积约150 cm2。去毛24h后检查去毛部位皮肤是否有损伤,以无红斑、水肿及破损为佳。破损皮肤组需建立损伤皮肤模型,方法是用无菌针头在脱毛区皮肤上划“井”字,以划破表皮渗血为宜,并控制左右两侧皮肤的破损程度基本保持一致。
1.5.3 单次给药皮肤刺激性试验 采用左右侧自身对比,左侧脱毛区按0.5mL/只涂复方特比萘芬纳米乳,右侧不涂抹作对照,用双层纱布覆盖,胶布固定,每只家兔单笼饲养。给药24h后,用温水清洗涂抹部位,去除残留药物,观察记录去除药物后1、24、48h和72h时涂抹部位有无红斑和水肿反应。涂抹部位依据皮肤刺激性反应评分标准[5]进行皮肤刺激反应评分,并计算其刺激分值。刺激分值=(红斑反应总分+水肿反应总分)/每组动物数,生理盐水组、空白纳米乳组试验方法同复方特比萘芬纳米乳组。
1.5.4 多次给药皮肤刺激性试验 采用左右侧自身对比,左侧脱毛区按0.5mL/只涂复方特比萘芬纳米乳,右侧不涂抹作对照,并用双层纱布覆盖,胶布固定。每只家兔单笼饲养,每天定时涂抹给药1次,连续涂抹7d。在每次去除药物后1h,观察记录涂抹部位有无红斑和水肿反应,并进行评分,计算每天每只动物平均积分,判定皮肤刺激性强度。生理盐水组、空白纳米乳组试验方法同复方特比萘芬纳米乳组。
1.6 皮肤急性毒性试验
1.6.1 动物分组 选择健康家兔32只,随机分为4组,分别为生理盐水组,空白纳米乳组、1%复方特比萘芬纳米乳组、2%复方特比萘芬纳米乳组,每组8只(完整皮肤和破损皮肤各4只)。
1.6.2 试验动物的处理 将上述已分好组别的家兔于给药前24h脱毛,每组用4只家兔进行完整皮肤刺激性试验,另4只建立损伤皮肤模型,方法同1.5.2项。
1.6.3 方法 对照组涂生理盐水,其余3组分别在脱毛区及划破皮肤区涂敷各自浓度的药物(0.5 mL/只),用双层纱布覆盖,胶布固定,每只家兔单笼饲养。给药24h后,用温水清洗涂抹部位,去除残留药物,每日观察,连续7d,观察家兔皮肤、眼、黏膜及呼吸、活动等情况,并在给药后第3天、第5天和第7天称取家兔体重。
1.7 皮肤过敏性试验
1.7.1 动物分组 将豚鼠随即分成3组,每组10只。第1组涂抹1%复方特比萘芬纳米乳,第2组为空白纳米乳,第3组为2,4-二硝基氯代苯。
1.7.2 试验动物的处理 试验前24h用脱毛膏在豚鼠颈背部脊柱两侧3cm范围内脱毛。
1.7.3 致敏接触 取0.2mL 1%复方特比萘芬纳米乳涂于滤纸上,将其贴敷在左侧脱毛区,两层纱布一层油纸覆盖,再用无刺激的胶布密封固定6h。第7天和第14天在背部同一区域以同样的方式操作。
1.7.4 激发接触 末次致敏后14d,以相同的方法将复方特比萘芬纳米乳贴敷在豚鼠右侧脱毛区,6h后去除贴敷物,即刻观察,并于24、48、72h再次观察皮肤过敏反应情况,皮肤过敏反应评分标准按文献[4]评定(空白纳米乳与2,4-二硝基氯代苯试验方法同复方特比萘芬纳米乳)。
1.8 特比萘芬分析方法的建立
1.8.1 色谱条件的选择 色谱柱 Diamonsil C18 5μm 250×4.6mm;流动相:甲醇-0.05mol/L醋酸铵缓冲液溶液(80∶20);检测波长:282nm;流速为1.2mL/min;柱温:室温;进样量:20μL。
1.8.2 标准曲线的建立 用流动相稀释特比萘芬对照品溶液,精密配制浓度分别为10、15、20、25、30 μg/mL的特比萘芬对照品系列溶液,按上述色谱条件进样测定,以对照品药物浓度(x)对色谱峰面积(y)进行线性回归。
1.8.3 回收率试验 精密量取特比萘芬对照品溶液适量,置10mL容量瓶中,加入空白纳米乳定容至刻度,用流动相配制成浓度分别为20μg/mL、25 μg/mL、30μg/mL的待测溶液进行测定,每个浓度重复进样3次,将测定的峰面积值代入标准曲线方程,计算出实测浓度,并计算其回收率、平均回收率和相对标准偏差(RSD)。
1.9 透皮试验
1.9.1 离体鼠皮的制备 将小鼠处死,用脱毛剂脱毛,剥离腹部皮肤,小心刮去皮下脂肪和粘连物,用生理盐水冲洗干净,冷冻保存,待用。
1.9.2 透皮方法 将小鼠腹部皮肤固定在Franz扩散池的2个半池之间,温度为37℃,转速为转速为600r/min。接受液为pH值7.4的磷酸盐缓冲液。取1mL复方特比萘芬纳米乳适量均匀涂布予皮肤表明,分别于0.25、0.5、1、1.5、2、3、4、6、8、10、12h取样1mL(同时补充等量同温接收液),用0.45μm微孔滤膜过滤,用1.8项所建立的特比萘芬含量测定方法进行测定。按下式计算单位面积透皮量(Qn),并计算稳态透皮速率(J)[μg/(cm2)·h][6]。对照组为药物的饱和溶液组,试验方法同复方特比萘芬纳米乳。
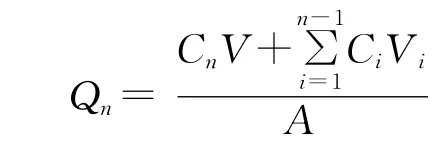
其中,Cn为第n个取样点测得的药物浓度(μg/mL);V为接收液体积(5mL);Ci为第i个取样点测得的药物浓度(μg/mL);Vi为取样体积(1mL);A为渗透面积(0.758cm2)。以单位面积累计渗透量为纵坐标,时间为横坐标,进行回归,所得直线的斜率为稳态透皮速率J。
2 结果与分析
2.1 皮肤刺激试验 在对家兔单次给药皮肤刺激性试验中,复方特比萘芬纳米乳和空白纳米乳对完整皮肤,均未引起红斑和水肿刺激反应,各观察时间点的刺激分值均为0,属无刺激性;复方特比萘芬纳米乳和空白纳米乳对破损皮肤,在观察时间点1h时,刺激分值均为0.5,属温和的轻度刺激性,1h后的刺激分值均小于0.5,属无刺激性。复方特比萘芬纳米乳和空白纳米乳对完整皮肤多次给药,均未引起红斑和水肿刺激反应,每天每只动物的平均刺激分值均为0,属无刺激性;复方特比萘芬纳米乳和空白纳米乳对破损皮肤多次给药时,均未引起水肿刺激反应,在前4d每天每只动物的平均刺激分值在0.50~0.65之间,属轻度刺激性;5d后其平均刺激分值均小于0.5,属无刺激性;试验结束时,计算得到的每天每只动物平均刺激分值均为0.3,属无刺激性。
2.2 皮肤急性毒性试验 在皮肤急性毒性试验中,各试验组中家兔均未出现异常反应和死亡,其采食、体质量、脱毛区皮肤、眼睛结膜、呼吸、循环、中枢神经系统、四肢活动均未见明显异常。初步认为复方特比萘芬纳米乳对家兔正常生长无明显的影响,外用安全低毒。试验中家兔体质量增长情况见表1。
表1 不同浓度复方特比萘芬纳米乳皮肤急性中毒对家兔体重的影响 (±SD,n=8)

表1 不同浓度复方特比萘芬纳米乳皮肤急性中毒对家兔体重的影响 (±SD,n=8)
组别 试验前体重(kg)试验后体重(kg)第3天 第5天 第7天1%复方特比萘芬纳米乳2.12±0.12 2.21±0.10 2.28±0.12 2.34±0.11 2%复方特比萘芬纳米乳 2.12±0.20 2.22±0.19 2.29±0.20 2.34±0.20空白纳米乳组 2.05±0.21 2.16±0.22 2.20±0.21 2.26±0.22生理盐水组2.14±0.19 2.24±0.20 2.29±0.19 2.36±0.20
2.3 皮肤过敏试验 在皮肤过敏试验中,2,4-二硝基氯代苯阳性对照组致敏发生率为100%,而复方特比萘芬纳米乳和空白纳米乳的皮肤过敏反应评分值为零,属弱致敏物。
2.4 复方特比萘芬纳米乳中特比萘芬含量的测定方法 通过线性回归求得特比萘芬的标准曲线方程为y=20 922x+8 320.2,R2=0.995 1(见图1),特比萘芬在1~15μg/mL检测浓度范围内线性关系良好。加样回收率试验结果表明,特比萘芬的平均回收率为(98.80±1.55)%,RSD为1.57%,表明测定方法的准确度高。
2.5 透皮试验 经回归得到复方特比萘芬纳米乳中特比萘芬的Qn方程为y=0.840 3x+0.191 6(r=0.979),其透皮速率为0.840 3μg/cm·h。特比萘芬饱和溶液的Qn方程为y=0.266 8x-0.155 5(r=0.981),透皮速率为0.2668μg/cm·h。复方特比萘芬纳米乳中特比萘芬与其饱和溶液相比,透皮速率增加将近4倍,说明纳米乳促进了特比萘芬的透皮吸收(图2,3)。
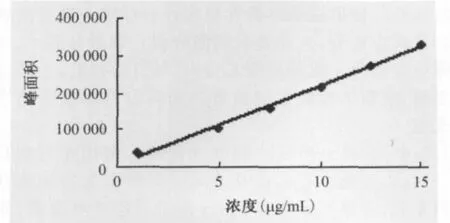
图1 特比萘芬的标准曲线

图2 特比萘芬对照品及复方特比萘芬纳米乳样品色谱图

图3 累计渗透量-时间曲线
3 讨论
药物安全性评价是为评价药物的安全性,在实验室条件下,用试验系统进行的各种毒性试验。它是新药研发的必需组成部分,其目的在于了解药物单次或短时间多次给药后,动物所产生的毒性反应及其严重程度,为临床安全用药及监测提供一定的参考,并对判断一种药物能否进入临床研究,预测临床研究的风险程度,为临床研究提供重要的安全性依据。本研究结果显示,复方特比萘芬纳米乳在皮肤刺激性试验、皮肤急性毒性试验和皮肤过敏性试验中,对家兔完整皮肤和破损皮肤无明显刺激反应,对豚鼠无皮肤过敏反应,对家兔无明显急性毒性反应,说明本制剂毒性甚小,是一种安全性较好的外用制剂。
纳米乳制剂促进特比萘芬经皮渗透的作用可能与以下两方面因素有关:一是纳米乳剂型本身有促进药物透皮吸收的特点[7-8];二是纳米乳的组成成分有促透作用,复方特比萘芬纳米乳的组成成分包括IPM,IPM本身就是一种常用的渗透促进剂[9]。
本研究对复方特比萘芬纳米乳进行了安全性及透皮能力的考察,为其临床应用提供了理论依据。由于本制剂是特比萘芬的一种全新药物剂型,因此需进行全面的临床疗效验证,考察其治疗疾病效果,期望为兽医临床提供一种安全可靠、高效的治疗皮肤病的新型纳米药物。
[1] 安惠霞,斯拉普·艾白,古丽娜·达吾提,等.特比萘芬的抗菌作用及机制的研究[J].中国抗生素杂志,2010,35(6):479-483.
[2] 李红磊,张忠义,马蕾蕾,等.丹参酮微乳的制备及大鼠在体肠吸收[J].中国中药杂志,2007,32(11):1024-1027.
[3] Wu W ,Wang Y ,Que L.Enhanced bioavailability of silymarin by self-microemulsifying drug delivery system [J].Eur J Pharm Biopharm ,2006,63(3):288-294.
[4] 王 晶,郭俊生,王晓黎.微乳系统在透皮给药中的应用[J].中国医药工业杂志,2007,38(10):739-742.
[5] 刘昌孝.药物评价学[M].北京:化学工业出版社,2005:255-257.
[6] 刘梅,王庆伟,刘雪英,等.八角茴香挥发油经皮渗透性及对布洛芬透皮吸收的影响[J].医药导报,2011,30(3):294-295.
[7] 张阳德.纳米药物学[M].北京:化学工业出版社,2005:163-188.
[8] 徐辉碧.纳米医药[M].北京:清华大学出版社,2004:77-97.
[9] 朱盛山.药物新剂型[M].北京:化学工业出版社,2003:69.

