党参皂苷D对HepG-2细胞增殖时间效应和细胞周期的影响
俞 星,韩春姬,朴惠善,李 琚
(1.延边大学基础医学院生理学教研部,吉林 延吉 133002;2.延边大学基础医学院预防医学教研部,吉林 延吉 133002;3.延边大学药学院药物化学教研部,吉林 延吉 133002)
原发性肝癌由于发病隐匿、恶性度高、生长快等特点,其临床治疗效果并不理想,因而探索高效低毒的抗肝癌药物一直是热点问题。近年来研究[1-3]发现:轮叶党参(Codonopsislanceolata)中含有皂苷、黄酮类、生物碱类、三萜类化合物、植物甾醇类及挥发油类等药用成分。轮叶党参药理学研究[4-5]表明:其具有抗突变、抗疲劳、抗氧化作用。本文作者前期研究[6-7]结果表明:轮叶党参总皂苷能明显诱导人肝癌细胞HepG-2的凋亡,发酵轮叶党参乙醇提取物明显提高清除自由基的能力。为了明确轮叶党参抑制肝癌细胞生长并促进癌细胞凋亡的活性成分及其作用机制,本研究从轮叶党参中分离出党参皂苷D(lancemaside D),探讨其对HepG-2细胞增殖的时间效应和细胞周期的影响。关于党参皂苷D体外抑制肝癌细胞增殖及其作用机制方面的研究国内外尚未见报道。
1 材料与方法
1.1 材料、试剂及仪器轮叶党参采集自吉林省安图县。采用溶剂萃取和柱色谱方法分离纯化党参皂苷D,根据理化性质和波谱学数据鉴定其结构,见图1。DMEM培养基(Gibco公司),特级胎牛血清(北京华美生科生物技术有限公司),MTT粉剂(Sigma公司),细胞周期检测试剂盒(碧云天生物技术研究所)。所用仪器有CO2培养箱(Sanyo公司)、流式细胞仪(美国BD公司)及酶联免疫检测仪(南京华东电子集团医疗装备有限责任公司)。人肝癌细胞HepG-2由延边大学肿瘤研究中心惠赠。
1.2 细胞生长抑制实验取对数生长期的HepG-2细胞,配成细胞数为1×104mL-1的单细胞悬液,接种于96孔板,每组设7个复孔。待细胞贴壁后,加入党参皂苷D,终浓度达25 mg·L-1。在37℃、5% CO2条件下分别培养12、24、48和72 h后加入MTT溶液(5 g·L-1),孵育4 h。吸尽孔内培养液,每孔加入DMSO,低速震荡10 min,用酶标仪于492 nm波长处测其光密度(A)值,并计算细胞生长抑制率,细胞生长抑制率(%)=(对照组平均A值-实验组平均A值)/ 对照组平均A值×100%。

图1 党参皂苷D结构式
1.3 绘制细胞生长曲线取对数生长期的HepG-2细胞,配成细胞数为1×104mL-1的单细胞悬液,接种于24孔板,2 mL/孔,每组设3个复孔。贴壁后加入不同浓度(5、10、15、20和25 mg·L-1)党参皂苷D,每隔24 h取出,用台盼蓝拒染法进行活细胞计数,每孔计数5次,取平均值。连续计数5 d。最后根据细胞计数结果,以单位细胞数(×104mL-1)为纵坐标,以时间(d)为横坐标绘制细胞生长曲线。
1.4 检测细胞周期的变化取对数生长期HepG-2细胞,配成细胞数为1×106mL-1的单细胞悬液,接种于6孔板,每孔5 mL,每组设5个平行样本,贴壁后加入不同浓度(5、10、15、20和25 mg·L-1) 党参皂苷D培养72 h。小心收集细胞培养液和贴壁细胞,加入1 mL预冷70%乙醇中,轻轻吹打混匀,4℃固定过夜。1 000 g离心3~5 min,沉淀细胞,用1 mL 预冷的PBS洗涤后,用碘化丙啶染色液染色后上机检测。
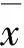
2 结 果
2.1 党参皂苷D作用后HepG-2细胞增殖抑制率的变化MTT法结果显示:加入终浓度为25 mg·L-1的党参皂苷D培养12、24、48和72 h后,细胞增殖抑制率均明显高于对照组,差异具有统计学意义(P<0.01)。12~48 h内,随着培养时间的延长,细胞增殖抑制率逐渐增高。见表1。
表1 党参皂苷D作用后HepG-2细胞增殖抑制率的变化
2.2 党参皂苷D作用后HepG-2细胞总数的变化党参皂苷D作用于HepG-2细胞24 h后,各个浓度组细胞总数与对照组比较差异均无统计学意义(P>0.05);作用48、72、96 和120 h后,各个浓度组细胞总数明显低于对照组,差异有统计学意义(P<0.05);党参皂苷D 5、15、20及25 mg·L-1组间比较,差异有统计学意义(P<0.05)。HepG-2细胞生长曲线见图2。随着党参皂苷D浓度增加,HepG-2细胞增殖速度缓慢,表现为同一时间的活细胞数目随着药物浓度的增加而减少。

图2 党参皂苷D作用下HepG-2细胞的生长曲线
2.3 党参皂苷D作用下HepG-2细胞周期的变化各浓度党参皂苷D组G0/G1期细胞所占比例明显高于对照组(P<0.05),15 mg·L-1组与10 mg·L-1组之间比较差异无统计学意义(P>0.05)。25、20、15和10 mg·L-1组S期细胞所占百分比明显低于对照组(P<0.05)。见表2和图3(插页二)。

表2 党参皂苷D作用后HepG-2细胞周期时相的改变
3 讨 论
轮叶党参除了含有各种营养素之外,还含有丰富的皂苷、黄酮类、多酚类及多糖等化合物。轮叶党参中的皂苷多为五环三萜类[8-9],很多中草药都含有五环三萜皂苷成分,如三七、远志等。其多以游离形式存在于自然界中,主要分为齐墩果烷型、乌苏烷型、羽扇豆烷型和木栓烷型等。现代药理学研究[10-12]表明:五环三萜皂苷具有广泛的药理作用和抗肿瘤活性。
本研究结果表明:党参皂苷D作用于HepG-2细胞48和72 h后均能抑制肝癌细胞的增殖,且作用48和72 h后各组细胞A值之间比较差异无统计学意义。党参皂苷D作用下HepG-2细胞生长曲线的变化结果显示:随着党参皂苷D加入量的提高细胞增殖抑制率增加,当加入浓度达到20 mg·L-1时细胞倍增时间延长为4 d,对照组倍增时间为2 d,并且在其生长曲线中细胞未出现明显的指数增长期,即曲线斜率未出现明显的改变而出现一个平台。本实验结果表明:党参皂苷D能很好地抑制肝癌细胞的增殖扩散。
细胞周期分为两个阶段,即间期与分裂期。间期又分为DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。M期为细胞分裂期,G0期为暂时离开细胞周期,停止细胞分裂,去执行一定生物学功能的细胞所处的时期[13-14]。很多肿瘤化学预防剂阻止了细胞中的纺锤丝的形成,从而抑制了细胞的有丝分裂,使细胞分裂停止于G0阶段,有效地遏制了癌细胞的恶性增殖和扩散。Eli等[15]的实验发现:吲哚美辛可以使S期及G2/M期的肿瘤细胞比例减少,而G1期细胞比例增加;孟宪瑛等[16]研究结果表明:80 μmol·L-1的Celecoxib作用于甲状腺癌TT细胞48和72 h后,肿瘤细胞被阻滞于G0/G1期,G2及S 期比例明显减少。本实验结果表明:党参皂苷D作用于HepG-2细胞72 h后,G0/G1期细胞所占百分比明显高于对照组,25、20、15和10 mg·L-1组S期细胞所占百分比明显低于对照组,与Eli和孟宪瑛等的研究结果一致。在细胞分裂周期中G1期是决定细胞生长速度和细胞凋亡的关键,因此推测党参皂苷D通过阻碍癌细胞DNA的合成而诱导凋亡。
本实验结果表明:党参皂苷D在一定剂量范围内抑制人肝癌HepG-2细胞增生,并呈剂量依赖性,使G0/G1期细胞比例增加,诱导细胞凋亡。随着党参皂苷D作用机制的阐明,可能为肝癌的防治提供广阔的应用前景。
[参考文献]
[1]Chang YK,Kim SY,Han BH.Chemical studies on the alkaloidal constituents of codonopsis lanceolata[J].Yakhak Hoechi,1986,30(1): 1-7.
[2]Yoo HH,Baek SH,Park YK,et al.Quality control of dried roots of codonopsis lancedoata[J].Kor J Pharmacogn,2002,33(2): 85-87.
[3] 余雄英,任启生,宋新荣.山海螺挥发油的GC-MS分析[J].中国中药杂志,2003,28(5):467- 468.
[4]朴奎善,韩春姬,申英爱,等.轮叶党参对大鼠SOD活力和MDA含量的影响[J].中国中医药科技,1998,5(4):239-241.
[5]Han CJ,Han LZ,Ye M,et al.Experimental studies on the anti-mutagenic effect of the total saponin of codonopsis lanceolata[J].Environ Occup Med,2004,21(5):397-400.
[6]俞 星,李 林,韩春姬,等.轮叶党参总皂苷对HepG-2细胞凋亡的研究[J].吉林大学学报:医学版,2011,37(6):1090-1093.
[7]刘婷婷,俞 星,韩春姬.发酵轮叶党参提取物清除DPPH自由基的作用[J].吉林大学学报:医学版,2011,37(6):1088-1090.
[8]Ichikawa M,Ohta S,Komoto N,et al.Simultaneous determination of seven saponins in the roots of codonopsis lanceolata by liquid chromatography-mass spectrometry[J].J Nat Med,2009,63(1):52-57.
[9]Ushijima M,Komoto N,Sugizono Y,et al.Triterpene glycosides from the roots of codonopsis lanceolata[J].Chem Pharm Bull,2008,56(3): 308-314.
[10]Fukuda Y,Sakai K,Matsunaga S,et al.Cancer chemopreventive activity of lupane- and oleanane-type triterpenoids from the cones of Liquidamber styraciflua[J].Chem Biodivers,2005,2(3): 421-428.
[11]Laszczyk MN.Pentacyclic triterpenes of the lupane,oleanane and ursane group as tools in cancer therapy[J].Planta Med,2009,75(15): 1549-1560.
[12]Zhang Z,Wang S,Qiu H,et al.Waltonitone induces human hepatocellular carcinoma cells apoptosisinvitroandinvivo[J].Cancer Lett,2009,286(2): 223-231.
[13]张 震,付 聪,王冰一,等.地塞米松和1,25-(OH)2D3对EC1细胞增殖和细胞周期的影响[J].郑州大学学报:医学版,2011,46(5):664-666.
[14]李瑞萍,胡雪梅,吕银凤,等.苦参碱对人卵巢癌细胞增殖的影响及其机制[J].西安交通大学学报:医学版,2010,31(5):621-624.
[15]Eli Y,Przedecki F,Levin G,et al.Comparative effects of indomethacin on cell proliferation and cell cycle progression in tumor cells growninvitroandinvivo.[J].Biochem Pharmacol,2001,61(5): 565-571.
[16]孟宪瑛,王广义,张 强,等.塞来昔布对人甲状腺髓样癌TT细胞增殖及细胞周期分布的影响[J].中国实验诊断学,2011,15(8):1259-1261.

