纳米SnO/Ti电极电催化还原KBO2制备KBH4
朱传高,王凤武,徐 迈
(淮南师范学院化学系,安徽淮南232001)
纳米SnO/Ti电极电催化还原KBO2制备KBH4
朱传高,王凤武,徐 迈
(淮南师范学院化学系,安徽淮南232001)
先在乙二醇中电解锡片,制备得到锡醇盐配合物,再将电解液水解后凝胶,在钛丝表面通过提拉法涂抹、300℃煅烧2 h制备得到纳米SnO/Ti电极.在0.3~1.2 mol/L KOH+0.2~0.8 mol/L KBO2的溶液中测试SnO/Ti电极的催化还原性能,研究影响电解还原KBO2的主要因素,并通过X射线衍射(XRD)和透射电子显微镜(TEM)表征SnO/Ti电极和KBH4的结构.结果表明,纳米SnO/Ti电极表面颗粒分散均匀,修饰电极催化性能较好,放电电流增大,产率和电流效率分别为16.9%和29.2%.
电催化还原;纳米SnO/Ti电极;硼氢化钾;电流效率
目前,氢能作为一种来源广泛、储量丰富、能量密度高的绿色能源及能源载体已引起人们广泛关注[1-2].硼氢化钾(KBH4)的储氢质量分数为7.47%,在释放氢时,KBH4可使水成为氢源,在较低温度下释放出氢气,是理想的贮氢材料[3-4].目前工业生产KBH4的材料通常为NaBH4和KCl(或KBr),其中NaBH4的合成[5-6]需要大量的贵重金属钠,导致KBH4生产成本较高.KBO2不仅价格低,而且也是KBH4燃料电池的氧化产物,将其作为电解法制备KBH4的原材料,可实现KBH4的循环使用,降低使用成本,并解决KBO2的回收利用.在常温常压下可通过电解NaBO2制备,曹余良等[9]利用电场作用下负电荷向阳极运动,在阳极方向上设置多孔Ni或储氢合金电极,可将输送到阴极,该方法应用前景广阔.本文在电化学[10]反应器中采用“电子”作为反应试剂,在阴极还原KBO2生成KBH4,实现了由MBO2直接循环再生为MBH4,并耦合储氢和制氢过程,使硼得到循环利用.
1 仪器和试剂
石英亚沸蒸馏水自制;化学试剂均为分析纯,在使用前真空干燥有机胺导电盐,打磨金属钛丝和锡片,经活化后待用.采用LK98BⅡ型电化学微机分析系统(天津兰力科电子高技术公司)测定电化学.采用自行设计的无隔膜两电极玻璃电解槽电解还原KBO2,电解电源用直流电源(HYL-A型).采用XD-3A衍射仪(日本SHIMADZU公司)检测纳米SnO和KBH4的微晶结构,Cu Kα(λ=1.540 6 nm),速率为4°/min,电压35 kV,电流25 mA.
2 电极制备与KBH4合成
2.1 纳米SnO粉体的制备 采用含有0.04 mol/L(Bu4N)Br的乙二醇溶液作为电解液.将清洗处理后的锡片(2.0 cm×3.0 cm)作为阳极移入无隔膜电解槽中.在氩气保护下,控制电流密度为30 mA/cm2、电解温度30℃,电解7 h.在电解液中加入体积比1∶10的稀氨水,控制pH=9.0,磁力搅拌电解液约4 h后形成白色胶状物,放置陈化得到白色胶体.真空干燥凝胶24 h得到干凝胶粉体,在300℃煅烧2 h后得到纳米SnO粉体.
2.2 SnO/Ti电极的制备与KBH4合成 用砂纸将Ti丝打磨去油后,将上述胶状物采用提拉法涂覆在Ti丝表面,并置于马弗炉中300℃恒温煅烧30 min,重复操作4次后,即可制得纳米SnO/Ti电极(膜厚约为0.1 mm).在三室离子膜电解槽中测试SnO/Ti电极的催化还原性能,两边为阴极室,中间为阳极室.阳极为Pt电极,阴极为纳米 SnO/Ti电极,阴极液为 0.3~1.2 mol/L KOH+0.2~0.8 mol/L KBO2溶液,阳极液为0.3~1.2 mol/L KOH溶液.在自行设计的无隔膜电解槽中电解还原KBO2,电解温度25~30℃.电化学制备KBH4可能发生如下反应:
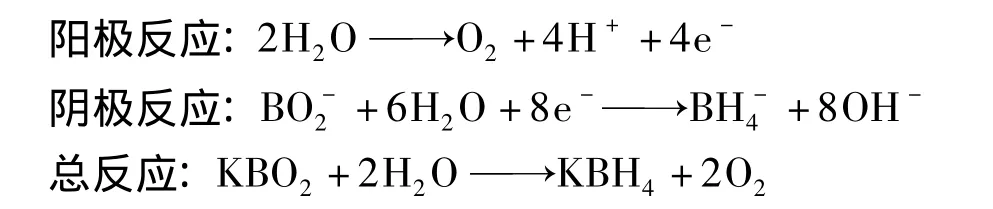
3 结果与讨论
3.1 纳米SnO/Ti电极制备与性能测试 图1为纳米SnO粉体的XRD谱.由图1可见,产物SnO分别在 14.08°,14.69°,15.53°,24.72°,26.13°,27.02°处出现明显的衍射峰,分别与 SnO 的(101),(011),(111),(112),(211),(121)晶面峰对应,峰的位置和强度与标准卡片(PDF24-1342)相符.XRD谱中未出现杂质峰,表明晶体粉末较纯净.图2为纳米SnO/Ti电极放大1万倍的SEM照片.由图2可见,电极表面粒径为100~200 nm,颗粒尺寸分布较均匀,未发生严重的团聚现象.这是因为干凝胶中含有较多的有机体,有机体在煅烧过程中发生分解而产生空隙,抑制了粉体团聚所致.图3为纳米SnO/Ti电极在KBO2溶液中的循环伏安特性曲线(电位范围-1.6~0 V,扫描速度50 mV/s),在0.5 mol/L KOH溶液中测试.由图3可见:电极电位在-1.59 V处出现拐点,表明此时溶液中析出氢气;在1.36 V处为氢的氧化峰,析氢电位与氢的氧化电位变化较小;随着KBO2浓度的增大,电流略增大,这是由于KBO2本身起到了导电盐的作用,同时浓度增大,反应速度加快所致.

图1 纳米SnO颗粒的XRD谱Fig.1 XRD pattern of nano SnO
3.2 电解还原KBO2的主要影响因素 在浓度为0.6 mol/L的KOH溶液中,对不同浓度的KBO2溶液进行电解测试,得到槽电流与槽电压的变化关系列于表1.由表1可见:当KBO2溶液浓度相同时,槽电流随槽电压的增大而增大;当槽电压相同时,槽电流随KBO2浓度的增大而增大;当KBO2浓度为0.6 mol/L时,电流下降,这是由于溶液的黏度增大,气泡无法迅速脱离电极表面,使得大量气泡散布于溶液中,导致溶液和电极的导电性降低.

图2 纳米SnO/Ti电极的SEM照片Fig.2 SEM micrograph of nano SnO/Ti electrode

图3 在不同浓度KBO2中纳米SnO/Ti电极的伏安特性曲线Fig.3 Cyclic voltammogram of nano SnO/Ti electrode in KBO2solution
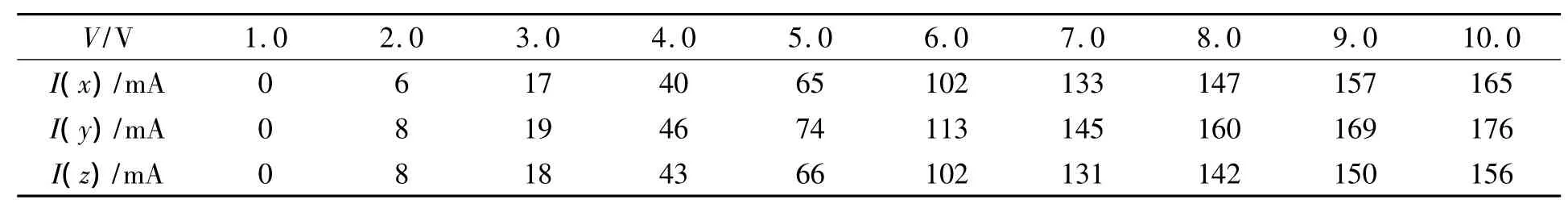
表1 槽电压与槽电流在不同KBO2浓度下的变化关系*Table1 Relationship between groove voltage and current in different KBO2solutions
在浓度为0.4 mol/L的KBO2溶液中,不同KOH浓度对电流与电压变化关系的影响列于表2.在电解过程中KOH主要起抑制KBH4水解和导电的作用,因此在溶液中加入一定浓度的KOH有利于反应进行.但浓度过高会使溶液黏度增加,不利于电极与气泡的分离,从而影响电极吸附反应物,并腐蚀SnO/Ti电极,导致电极的使用寿命降低.由表2可见,当KOH浓度为0.6 mol/L时,随着槽电压增大,槽电流变化较快,电流效率较高.

表2 槽电压与槽电流在不同碱浓度下的变化关系*Table2 Relationship between groove voltage and current in different KOH solutions
在0.4 mol/L的KBO2溶液中,电极电势与槽电压在不同碱浓度下的变化关系列于表3.由表3可见,槽电压与电极电势在不同碱浓度下的变化基本一致,碱浓度对电极电势随槽电压变化情况影响较小.当槽电压大于6 V时,电极电势改变较小.由于碱浓度过高会导致溶液黏度增加,产生较多不利影响,因此结合表2,c(KOH)=0.6 mol/L.
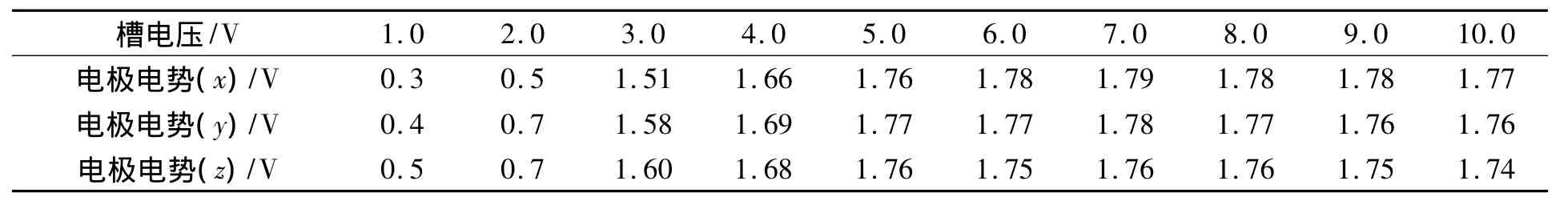
表3 槽电压与电极电势不同碱浓度下的变化关系*Table3 Relationship between bath voltage and electrode potential in different KOH solutions
4 KBH4的电解合成与结构表征
在阴极液为0.3 ~1.2 mol/L KOH+0.2 ~0.8 mol/L KBO2溶液中进行纳米 SnO/Ti电极的电催化还原实验,结果列于表4.由于OH-参与电极反应,因此,为增加电极的还原性能,可适当提高溶液的碱性.电极反应如下:

由电极反应(1)和(2)可见,碱性增强有利于生成Sn2O3和Sn(OH)3.

表4 纳米SnO/Ti电极电解合成KBH4Table4 Electro-synthesizing KBH4at nano SnO/Ti electrode
由于电极中Sn(Ⅲ)活性点的数量及KBO2的浓度决定KBO2的还原反应速度,因此,通过SnO修饰电极后可明显改善电极的催化性能,提高电极的放电容量.经多次电解实验和较长时间扫描,该电极结构均较稳定,未发现膜溶解或脱落现象.
图4为纳米KBH4的XRD谱.由图4可见,KBH4的晶面峰分别为 23.17°(111),26.77°(200),38.14°(222),44.88°(311),其晶体特征峰的强度和位置与标准卡片(PDF 08-0227)相符.样品的衍射峰出现了明显的宽化现象,表明其粒径较小.

图4 纳米KBH4的XRD谱Fig.4 XRD pattern of nanometer KBH4
综上所述,本文测试了纳米SnO/Ti修饰电极在阴极液为0.3~1.2 mol/L KOH+0.2~0.8 mol/L KBO2溶液中的电化学性能.结果表明,利用金属醇盐溶胶-凝胶法得到的纳米SnO/Ti膜电极具有较高的催化性能,收率和电流效率分别为16.9%和29.2%.
[1]Schlapbach L,Z¨uttel A.Hydrogen-Storage Materials for Mobile Applications[J].Nature,2001,414:353-358.
[2] Crabtree G W,Dresselhaus M S,Buchanan M V.The Hydrogen Economy[J].Phys Today,2004,12:39-44.
[3] Orimo S,Nakamori Y,Kitahara G,et al.Dehydriding and Rehydriding Reactions of LiBH4[J].J Alloys and Compounds,2005,404/405/406:427-430.
[4]Z¨uttel A,Rentsch S,Fisher P,et al.Hydrogen Storage Properties of LiBH4[J].J Alloys and Compounds,2003,356/357:515-520.
[5] LI Zhou-peng,LIU Bin-hong,Morigasaki N,et al.Preparation of PotassiumBorohydride by a Mechano-Chemical Reaction of Saline Hydrides with Dehydrated Borate through Ball Milling[J].J Alloys Compounds,2003,354(1/2):243-247.
[6] Jeffers P M,Bauer S H.Partial Reduction of Trimehoxybo-Rane:An Old Reaction in a New Reactor[J].Inorg Chem,1981,20(6):1698-1701.
[7] DONG Hua,YANG Han-xi,AI Xin-ping,et al.Hydrogen Production fromCatalytic Hydrolysis of SodiumBorohydride Solution Using Nickel Boride Catalyst[J].International Journal of Hydrogen Energy,2003,28:1098-1100.
[8] Sanli A E,Kayacan L,Uysal B Z,et al.Recovery of Borohydride fromMetaborate Solution Using a Silver Catalyst for Application of Direct Rechargeable Bomhydride/Peroxide Fuel Cells[J].J Power Sources,2010,195(9):2604-2607.
[9] 曹余良,杨汉西,光先勇,等.一种用于电解制备硼氢化物的装置:中国,200410013295[P].2005-02-23.
[10] ZHU Chuan-gao,CHU Dao-bao.Preparation of Nanocrystalline PbTiO3Powder by Lead and TitaniumEthoxide Complexes[J].Journal of Jilin University:Science Edition,2005,43(4):507-512.(朱传高,褚道葆.由铅、钛乙醇盐配合物制备纳米PbTiO3粉体[J].吉林大学学报:理学版,2005,43(4):507-512.)
(责任编辑:单 凝)
Preparation of KBH4by Electrocatalytic Reduction of KBO2at a Nano SnO/Ti Electrode
ZHU Chuan-gao,WANG Feng-wu,XU Mai
(Department of Chemistry,Huainan Normal College,Huainan 232001,Anhui Province,China)
Tin alkoxide complex was prepared by electrochemical dissolution of pure tin in the glycol solution,followed by the direct sol-gel process of electrolyte solution.The SnO sol coated on pure titaniumsubstrate was calcined at 300℃ for 2 h in a muffle furnace.The electro-catalytic reduction performance of nano SnO/Ti electrode was investigated in the 0.3 ~1.2 mol/L KOH+0.2 ~0.8 mol/L KBO2solution.The main factors of electro-catalytic reduction of KBO2such as KBO2and KOH concentrations and so on were studied.The monodisperse structure and the diameter of nano SnO/Ti electrode were observed by XRD and TEM.The results show that the nano SnO uniformly dispersed on the electrode surface.The electro-catalytic reduction performance of nano SnO/Ti electrode is stable.A yield of 16.9%and a current efficiency of 29.2%were respectively obtained.
electrocatalytic reduction;nano SnO/Ti electrode;KBH4;current efficiency
O646
A
1671-5489(2012)05-1037-04
2012-02-20.
朱传高(1969—),男,汉族,硕士,副教授,从事纳米材料合成及电化学的研究,E-mail:zhucg88@126.com.
国家自然科学基金(批准号:21176099)和安徽省教育厅自然科学基金重点项目(批准号:KJ2010A309).

