酸奶中长双歧杆菌PCR计数方法的建立
张红发,任 婧,刘 景,游春苹,顾瑾麟
(1.光明乳业股份有限公司技术中心,乳业生物技术国家重点实验室,上海 200436;2.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122)
酸奶中长双歧杆菌PCR计数方法的建立
张红发1,2,任 婧1,刘 景1,游春苹1,顾瑾麟1
(1.光明乳业股份有限公司技术中心,乳业生物技术国家重点实验室,上海 200436;2.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122)
根据细菌保守序列设计一对通用引物,扩增细菌16S rDNA序列,作为阳性标记;根据长双歧杆菌菌株的16S rRNA和23S rRNA之间的间区基因序列设计定性PCR引物。用BBL琼脂平板对长双歧杆菌混合发酵的酸奶进行培养计数,随机挑选部分长出的菌落,提取DNA做PCR鉴定。将PCR技术与传统平板计数技术结合起来,初步建立酸奶中长双歧杆活菌计数方法。抽提方法操作简便、高效、灵敏,决定着PCR计数方法的准确高效,本研究着重研究了菌体DNA抽提方法的影响因素,以及抽提方法通用性,同时也研究了PCR引物的特异性。将PCR技术与传统平板计数技术结合起来,初步建立酸奶中长双歧杆活菌计数方法。
PCR,计数,长双歧杆菌
双歧杆菌为存在人类肠道中益生菌,近年来国内外含双歧杆菌活菌混和制剂日益增多特别是含双歧杆菌和乳酸菌混合发酵的奶类制品[1]。产品中活菌数决定着产品质量,准确、快速的双歧杆菌活菌计数方法越来越重要。而GB/T4789-34-2008《食品卫生微生物学检验双歧杆菌检验》中对双歧杆菌采用生化反应和酶活测定鉴定,操作复杂,周期长,费用高,实际操作困难。传统的细菌学检验与鉴定的主要依据是形态和生理特征,需要进行细菌培养和一系列生化反应检测,方法复杂费时[2];而PCR技术具有高度的特异性和敏感性[3],打开了细菌快速鉴定的大门[4]。其不仅操作简便、快速可靠并且灵敏、高效,还克服了对培养的依赖性[5]。随着基因技术和网络信息技术的发展,一般细菌的基因序列在网上都可以免费方便地查到;国内微生物基因测序公司也有很多,测序结果也很准确、方便、便宜,设计微生物种、属甚至菌株特异性PCR引物变得容易、经济。但PCR难以区分样品中微生物的死活,计数样品中的活菌需要与传统培养计数方法相结合。为了初步建立酸奶中长双歧杆菌PCR计数方法,研究了菌体DNA抽提方法的影响因素,以及抽提方法通用性。加热煮沸法操作简单,可以破坏G+细胞壁,使基因组DNA释放出来,虽然有部分DNA可能被破坏降解,但仍能够满足PCR要求[6]。培养基也含有污染微生物的核酸[7],若抽提方法过于灵敏,难以排除污染干扰。抽提方法要求操作简便、高效,同时可以克服培养基中污染基因物质干扰。根据长双歧杆菌菌株的16S rRNA和23S rRNA之间的间区基因序列设计定性PCR引物,研究了引物的特异性。结合具体实例,用BBL琼脂平板对长双歧杆菌混合发酵的酸奶进行培养计数,再PCR计数鉴定,最后计算出长双歧杆菌活菌数。
1 材料与方法
1.1 材料与仪器
短双歧杆菌(Bifidobacterium breve)、青春双歧杆菌(Bifidobacterium adolescentis)、动物双歧杆菌(Bifidobacteriumanimalis)、 两 岐 双 岐 杆 菌(Bifidobacterium bifidum)、干酪乳杆菌(Lactobacillus casei)、嗜热链球菌(Streptococcus thermophilus)、保加利亚乳杆菌(Lactobacillus bulgaricus) 丹麦Dansico提供;长双歧杆菌BL-1(Bifidobacterium longum) 光明乳业技术中心筛选并保藏;生鲜乳 采自上海第九牧场;BBL琼脂培养基 上海沪峰生化试剂有限公司;半胱氨酸 分析纯,国药集团化学试剂有限公司;Taq DNA聚合酶、W ide Range DNA Marker TaKaRa公司。
Bugbox厌氧培养箱 英国Ruskinn Technology Limited公司;Veriti Thermal Cycler 96-well PCR仪美国App lied Biosystems公司;Type A2/Class II生物安全柜 美国Labconco公司;5424R小型台式高速冷冻离心机 德国eppendorf公司;Leica DM 4000M显微镜
德国Leica公司。
1.2 实验方法
1.2.1 菌体DNA提取效果检验PCR 选取培养平板上的单菌落,用10μL灭菌枪头吸取菌体1μL,悬浮于20μL提取液(20mmol/L Tris/HCl,pH8.3)中。在研究菌体吸取量对PCR影响时,用去离子水做梯度稀释。抽提方法采取煮沸法,具体操作参考文献[8-9]。煮沸后的混合物直接作为PCR模板,用细菌16S rRNA通用引物:上游引物325F(5’-TCC TAC GGG AGG CAG CA-3’)和下游引物1367R(5’-CGG GCG GTG TGT ACA A-3’),做PCR,检验抽提效果。PCR产物长度为1000bp左右,所采用的PCR扩增条件都为:95℃预热5m in,30个循环(95℃,30s;55℃,30s;72℃,30s),72℃延伸5m in。PCR产物用1%琼脂糖凝胶电泳鉴定。
1.2.2 长双歧杆菌PCR鉴定计数
1.2.2.1 长双歧杆菌平板计数 长双歧杆菌酸奶由灭菌牛奶经嗜热链球菌(Streptococcus thermophilus)、保加利亚乳杆菌(Lactobacillus bulgaricus)和长双歧杆菌(Bifidobacterium longum)混合发酵而成。发酵好的长双歧杆菌酸奶,参照国标GB/T 4789-34-2008《食品卫生微生物学检验双歧杆菌检验》做法,系列稀释,选择合适的稀释倍数,倒BBL琼脂平板,厌氧培养计数。选择平均菌落数在30~300间的平皿和稀释度计数,平均菌落数乘以稀释倍数得到样品菌落总数[10]。
1.2.2.2 长双歧杆菌PCR鉴定 细菌阳性标记PCR引物是16S rRNA的通用引物[11-12]:上游引物16F(5’-AGA GTT TGA TCC TGG CTC AG-3’),下游引物16R(5’-C TGC TGC CTC CCG TAG GAG-3’)。PCR产物长度为300bp左右。
对发酵的长双歧杆菌菌株的16S rRNA和23S rRNA之间的间区基因序列进行测序,具体操作参照文献[10]。NCBI网上比对分析,设计长双歧杆菌定性PCR引物,上游引物B-F(5’-CCA TCA TCC GCT TTC G-3’),下游引物B-R(5’-TGG CAG ACA GGA CCG ATG-3’),PCR产物长度为215bp。
PCR扩增反应液组成(总体积30μL):上游引物(5μmol/L)3μL,下游引物(5μmol/L)3μL,2.5mmol/L dNTP 2.4μL,10×PCR Buffer 3μL,模板DNA 1μL,Taq DNA聚合酶1U,加去离子水至30μL。
所采用的PCR扩增条件都为:95℃预热5m in,30个循环(95℃,30s;55℃,30s;72℃,30s),72℃延伸5min。PCR产物用1%琼脂糖凝胶电泳鉴定。
长双歧杆菌发酵酸奶培养计数后,找出菌落数在30~300之间的平板,挑选一定数量的单菌落,标记编号,用灭菌枪头吸取菌体;在平板空白处吸取培养基作为阴性对照监测PCR污染。提取菌体DNA,做PCR鉴定。根据PCR鉴定为阳性的长双歧杆菌所占的比例,以及平板计数的菌落总数计算出目标细菌的数量。
1.2.3 镜检验证 用10μL灭菌枪头吸取对应编号菌体,悬浮于20μL无菌水,涂片。结晶紫简单染色,镜检观察。
2 结果与分析
2.1 抽提方法
2.1.1 菌体吸取量对PCR的影响 由于平板上长出的菌落大小、位置不定,吸取菌体量有波动,是否对PCR有影响必须研究。吸取长双歧杆菌划线平板单菌落,梯度稀释后加入裂解液(pH8.0)抽提,用细菌16S rRNA通用引物325F和1367R做PCR,电泳结果见图1。吸取的菌体量减少到100倍,PCR条带可以;吸取的菌体量减少到1000倍,仍有PCR条带。正常吸取的菌体量波动在10倍以内,因此菌体吸取量对PCR鉴定无影响。
2.1.2 提取液pH对PCR的影响 吸取长双歧杆菌划线平板上的单菌落菌体,加入不同pH裂解液抽提,用细菌16S rRNA通用引物325F和1367R做PCR,电泳结果见图2所示。pH8.0的效果较差,pH8.3和pH8.6的效果都较好;pH 8.9的没有PCR条带,可能沸水浴时模板DNA降解或者裂解液影响随后PCR体系的pH。考虑到PCR缓冲液的pH8.3,因此,裂解液的最佳pH 8.3。

图2 提取液pH对PCR影响Fig.2 The effectof DNA extraction pH for PCR product
2.1.3 抽提方法通用性 抽提方法通用性决定着实验结果的可靠性。吸取不同益生菌的划线平板单菌落菌体,加入裂解液(pH 8.3),提取菌体DNA,用细菌16S rRNA通用引物325F和1367R做PCR,电泳结果见图3。不同细菌的抽提物都有PCR条带且都较强,说明本研究的菌体DNA抽提方法的通用性好。
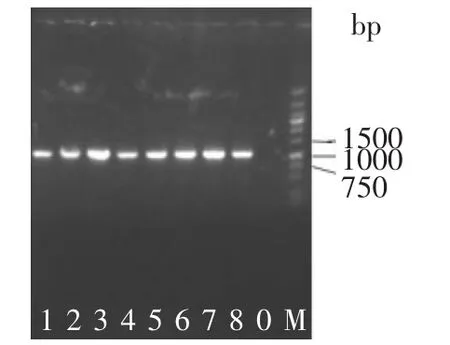
图3 抽提方法通用性Fig.3 Generality of themethod for extracting bacterial genomic DNA
2.2 长双歧杆菌PCR引物特异性验证

图4 长双歧杆菌PCR引物特异性Fig.4 Specificity of the PCR primers for Bifidobacterium longum
对包括长双歧杆菌在内8种的不同益生菌,分别吸取单菌落菌体,加入裂解液(pH 8.3),提取菌体DNA,用长双歧杆菌定性引物和细菌阳性标记引物做PCR,电泳结果见图4。所有细菌的阳性标记PCR都有条带;但长双歧杆菌定性PCR只特异性扩增长双歧杆菌(图4中编号为4、5),而其它细菌,特别与它相近的双歧杆菌(如动物双歧杆菌等)都没有扩增条带。本实验说明长双歧杆菌定性PCR的特异性强,可以作为益生菌混合培养的计数。
2.3 长双歧杆菌PCR计数结果
2.3.1 长双歧杆菌PCR计数 长双歧杆菌酸奶经过平板培养计数,得到长双歧杆菌可疑菌落数总数为6.5×108cfu/g。随机选择20个分散的菌落,编号标记,用灭菌枪头吸取菌体,在平板空白处吸取培养基作为阴性对照监测PCR污染。提取菌体DNA,做PCR鉴定。PCR产物电泳条带分为以下三种情况:
a.只有细菌阳性标志扩增条带(300bp左右)而无长双歧杆菌扩增条带(215bp),则所检测的菌落不是长双歧杆菌,而是其他细菌。
b.细菌阳性标志和长双歧杆菌2条扩增条带都没有,则所检测的菌落基因没有裂解好或没有吸到菌体。
c.有细菌阳性标志和长双歧杆菌2条扩增带,则所检测的菌落为长双歧杆菌。
所选取的20个菌落都有细菌阳性标志PCR条带,其中14个为长双歧杆菌,比率为7∶10;乘上BBL琼脂平板计数结果(6.5×108cfu/g),得到所检测的酸奶中长双歧杆菌的菌落数为4.6×108cfu/g。阴性对照的2对PCR引物都没有条带,说明培养基中含有的核酸物质不能扩增,对PCR鉴定计数没有影响。

图5 长双歧杆菌平板计数PCR扩增结果Fig.5 PCR bands of the colonies by Bifidobacterium longum plate count
2.3.2 镜检验证 对2.3.1所述平板上对应编号的20菌落,全部涂片镜检。结果通过长双歧杆菌PCR鉴定为阳性菌落的菌体形态都如图7相似,为双歧杆菌的典型特征(长而弯曲的杆状[13]);所有阴性菌落显微图片都如图6相似,为球菌;镜检中未发现其它杆菌。镜检结果进一步验证PCR计数方法的特异性和准确性,没有交叉污染。
3 结论
本研究将PCR技术与传统平板计数技术有机地结合起来,初步建立了混合发酵酸奶中长双歧杆活菌计数方法。操作简单,特异性强,抗干扰强,试剂无毒、无害,能够计数样品中活活菌,适合混合细菌样品中的特定益生菌活菌计数研究。通过设计菌株特异性PCR引物可以区分同种不同菌株的细菌,为益生菌的研究和应用打下基础;同时也为其它计数方法提供参考标准。传统的细菌学检验与鉴定需要进行培养和一系列生化反应检测,方法复杂费时,需要至少2~3d时间;而PCR鉴定计数过程可以在1d之内完成,因此本研究计数方法快速、准确。
研究出的抽提方法操作简便、高效、灵敏、通用,同时可以克服培养基中污染基因物质干扰。抽提方法的灵敏性决定着PCR计数方法的灵敏性,正常吸取菌体量稀释100倍仍有PCR扩增条带,充分保证PCR计数方法的可靠性和灵敏性。只要待检测的目标细菌含量可以用常规平板计数方法的,都可以用PCR进行菌落鉴定计数。
总之,本研究为食品中益生菌菌数快速准确的检测;为开发和生产高质量的发酵乳产品提供研究基础。
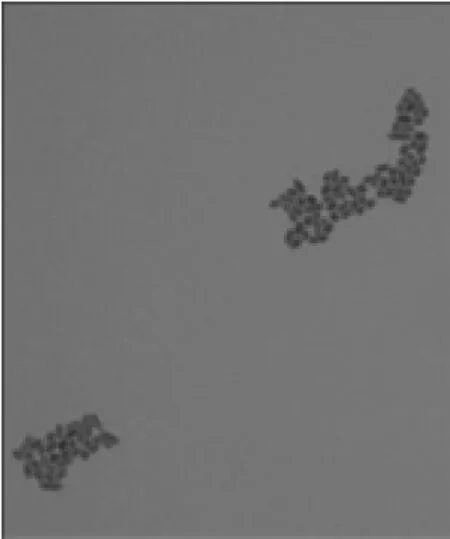
图6 非长双歧杆菌菌落显微图Fig.6 Micrograph of the non-Bifidobacterium longum colony

图7 长双歧杆菌菌落显微图片Fig.7 Micrograph of the Bifidobacterium longum colony
[1]叶倩.PCR技术综述[J].科技创新导报,2009(5):5.
[2]Houpikian P,RaoultD.16S/23SrRNA intergenic spacer regions forphylogenetic analysis,identification,and subtypingofbartonella species[J].JClin Microbiol,2001(8):2768-2778.
[3]李琳,李槿年,余为一.细菌分类鉴定方法的研究概况[J].安徽农业科学,2004(3):550.
[4]王庭柱,高学军,丛玉婷,等.发酵乳球菌菌株的PCR鉴定[J].食品科学,2007(3):206-207.
[5]杨文敏,何敏.PCR扩增16s~23s rRNA区间序列在细菌检测与鉴定领域的应用[J].广西预防医学,2000(6):369-372.
[6]余道军,童文娟,陈岳明,等.临床标本细菌基因组DNA提取方法探讨[J].中国微生态学杂志,2007(6):519-520.
[7]沈青春,覃青松,王琴,等.PCR方法测定猪肺炎支原体培养物菌数[J].中国预防兽医学报,2006(1):55-57.
[8]郑维,权春善,朴永哲,等.一种快速提取细菌总DNA的方法研究[J].中国生物工程杂志,2006(4):75-80.
[9]Palacios L,Vela A I,Molin K,et al.Characterization of some bacterial strains isolated from animal clinical materials and identified as Corynebacterium xerosis by molecular biological techniques[J].JClin Microbiol,2010(9):3138-3145.
[10]张丽宏,王克新,房玉国.食品中菌落总数测定方法探讨[J].中国乳品工业,2005(4):56-57.
[11]刘文强,贾玉萍,赵宏坤.16S rRNA在细菌分类鉴定研究中的应用[J].动物医学进展,2006(11):15-17.
[12]焦振泉,刘秀梅.16s rRNA序列同源性分析与细菌系统分类鉴定[J].国外医学.卫生学分册,1998(1):12-15.
[13]周家春,冯屏.双岐杆菌属的生理特征和鉴别[J].广州食品工业科技,2003(S1):59-62.
Study on a new method for counting Bifidobacterium longum in yogurt by PCR
ZHANG Hong-fa1,2,REN Jing1,LIU Jing1,YOU Chun-ping1,GU Jin-lin1
(1.State Key Laboratory of Dairy Biotechnology,Technology Center Bright Dairy&Food Co.,Ltd.,Shanghai200436,China;2.State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi214122,China)
This study tried to initially estab lish a method for counting Bifidobac terium longum in yogurt by using polymerase chain reaction(PCR)technique and traditionalp late countmethod technique.Based on the conserved sequence of 16S rDNA sequences of bacteria,a pair of universal p rimer were designed as a positive mark. And a pair of special p rimers were also designed and synthesized accord ing to 16S~23S rRNA gene of the Bifidobacterium longum.The random ly selected colonies of the m ixed fermented yogurt culturing on BBL agar p late were abstracted and identified by PCR.PCR technology combines w ith the trad itional p late countmethod technology,estab lished the method for counting the living Bifidobacterium longum in the m ixed fermented yogurt.Operation of extraction method must be sim p le,efficient,responsive and accurate,and it determ ined the efficient of PCR counting method.This study focused on the factors that influencing the bacterial DNA extraction,as well as the versatility of the bacterial DNA extraction,but also the specificity of the PCR p rimers for Bifidobac terium longum.A method for counting Bifidobacterium longum in yogurtwas initially estab lished by using polymerase chain reac tion(PCR)technique and trad itionalp late countmethod technique.
PCR;counting;Bifidobacterium longum
TS252.54
A
1002-0306(2012)14-0188-04
2011-10-28
张红发(1977-),男,本科,中级职称,主要从事乳品微生物方面的研究。
乳业生物技术国家重点实验室筹建项目(10dz2221100);上海乳业生物工程技术研究中心项目(09DZ2251400)。

