不同方法提取沙海蜇皮胶原蛋白的对比分析
陶 宇,李志皓,侯 虎,王珊珊,李八方
(中国海洋大学食品科学与工程学院海洋生物活性物质实验室,山东青岛 266003)
不同方法提取沙海蜇皮胶原蛋白的对比分析
陶 宇,李志皓,侯 虎,王珊珊,李八方*
(中国海洋大学食品科学与工程学院海洋生物活性物质实验室,山东青岛 266003)
以沙海蜇皮为实验原料,分别用胃蛋白酶提取法、热水提取法和酸提取法进行了胶原蛋白的提取,得到酶溶性胶原蛋白(PSC)、热水抽提胶原蛋白(HEG)和酸溶性胶原蛋白(ASC),并分析了三种胶原蛋白的理化性质及功能特性。结果表明:PSC、HEG和ASC中羟脯氨酸含量分别为5.77%,5.53%和9.20%;平均分子量分别为34、52、38ku。紫外图谱扫描和红外扫描光谱表明,三种方法提取的胶原蛋白结构相似,但略有差别。PSC、HEG、ASC乳化指数依次为:5.07、25.90、3.26m2/g;稳定性依次为:24.68、21.89、88.5min。吸湿性和保湿性最好的样品均为PSC。
沙海蜇,胶原蛋白,提取,性质
沙海蜇(Stomolophus meleagris L.Agssiz)属于刺胞动物门、水母亚门、钵水母纲、根口水母目、口冠水母科、口冠水母属。近年来,沙海蜇的资源越来越丰富,但由于沙海蜇收获期短,含水量高,易自溶,加工方法单一,大量的沙海蜇因未及时处理而腐败,造成资源的浪费和环境的污染。因此,沙海蜇产业链加工的多样化以及沙海蜇的高值化利用的研究引起了人们的关注。除水分以外,蛋白质是沙海蜇的主要成分,胶原蛋白作为沙海蜇的主要蛋白成分之一,其功能性质和生物活性的研究成为热点[1-2]。近几年来,国内外对胶原蛋白的提取及纯化进行了大量研究。钱曼[3]等对热力法和酶法提取的鱼鳞胶原蛋白性质进行研究,结果表明:酶解法提取的胶原蛋白吸水性和起泡性大于热力法提取的,但其保水能力、乳化性和乳化稳定性小于热力法提取的。此外,易继兵[4]等人对狮子鱼皮胶原蛋白的提取及理化性质进行了研究;张绵松[5]等对海蜇皮水解条件进行了研究。常见的胶原蛋白的提取工艺主要有热水提取法、酸提取法、碱提取法和酶提取法等,但关于哪种提取方法更适合沙海蜇胶原蛋白的提取,目前的文献鲜有报道。热水提取法是原料经过前处理后,在一定条件下用热水浸提,从而得到水溶性胶原蛋白;酸提取法即是利用特定浓度的酸在一定条件下提取胶原蛋白,常用的酸有盐酸、柠檬酸、乳酸和醋酸等;碱法提取,一般是将样品匀浆后,用一定浓度的NaOH溶液提取;酶法提取,即利用某种蛋白酶在一定条件下提取胶原蛋白,通常使用的酶有中性蛋白酶、木瓜蛋白酶、胰蛋白酶和胃蛋白酶等。原料经过不同的前处理后,加入不同的酶提取得到酶溶性胶原蛋白[6]。以相同原料制备的胶原蛋白可能由于不同的制备方法而具有不同的分子量和理化性质,因而适用于不同的应用领域[7]。本研究探求酶法,酸法,热水法三种不同的方法对沙海蜇皮胶原蛋白进行提取,并对三种胶原蛋白的性质进行比较分析,以对其在不同领域的高值化利用提供理论依据。
1 材料与方法
1.1 材料与仪器
盐渍沙海蜇皮(沙海蜇伞部) 青岛利群超市;溴化钾 光谱纯,天津博天胜达科技有限公司;牛血清蛋白、VB12、谷胱甘肽 色谱纯,Sigma公司;冰醋酸、氢氧化钠、氯胺T、SDS、高氯酸 分析纯,天津市博迪化工有限公司。
BR4i型冷冻离心机 Jouna公司出品;DS-1型高速组织捣碎机 上海标本模型厂生产;Aglient 1100型高效液相色谱 美国安捷伦科技有限公司出品;UV-2102PC型紫外可见分光光度计 尤尼柯上海仪器有限公司出品;Nicolet nexos型傅立叶变换红外光谱仪 美国Nicolet公司出品。
1.2 实验方法
1.2.2 酶法提取胶原蛋白[8]将预处理的沙海蜇加入0.5mol/L醋酸匀浆,然后加入海蜇质量5‰的胃蛋白酶搅拌均匀,于4℃下搅拌2d,9000r/min离心后取上清液,加入NaCl至浓度为0.9mol/L,静置过夜后8000r/min离心。弃上清液,将沉淀用少量0.5mol/L醋酸复溶后移入透析袋,用0.02mol/L磷酸氢二钠透析2d。将透析后的液体8000r/min离心,沉淀用0.5mol/L的醋酸复溶后,用蒸馏水透析3d。收集透析液体冻干得酶溶性胶原蛋白PSC。
1.2.3 热水法提取胶原蛋白[8]将预处理的沙海蜇匀浆后,于70℃热水提取4h。冷却后,8000r/min离心15min,取上清液,冻干得热水抽提胶原蛋白HEG。
1.2.4 酸法提取胶原蛋白[8]将预处理的沙海蜇加入0.5mol/L醋酸匀浆,料液比(W∶V)为1∶4,于4℃下搅拌2d。9000r/min离心后取上清液,用蒸馏水透析3d,每8h更换一次蒸馏水。将透析后液体收集,冻干得酸溶性胶原蛋白ASC。
1.2.5 羟脯氨酸含量测定[9]
1.2.5.1 标准曲线的制作 配制10μg/mL的羟脯氨酸溶液。取0、0.4、0.8、1.2、1.6、2mL标准溶液于各试管中,用蒸馏水补足到2mL。各试管加入1mL氯胺T,室温下放置20min。再加入1mL发色剂充分混合后,将试管置于60℃水浴15min。在流动自来水下冷却试管3min。测定560nm处吸光值。
1.2.5.2 样品测定 取适量样品放入安培瓶中,加入3mL 6mol/L HCl,酒精喷灯封口后于130℃下水解4h。调节pH后用蒸馏水定容至100mL。取其中的2mL,此后操作同标准曲线的制作方法。
1.2.6 分子量分布测定 取牛血清蛋白、VB12、谷胱甘肽及胶原蛋白样品各1mg,分别溶于1mL的纯水中,用0.45nm微孔滤膜过滤后进样。色谱条件:色谱柱:TSK GEL G3000PWXL;流动相:乙腈与0.2%TFA混合溶液,体积比1∶ 1;流速:0.5mL/min;紫外检测波长:225nm。
水产科技系建立并利用微信、微博、QQ、pu平台,设立“水产青年”公众号、“水产党员教师”微信群等,及时向师生推送党章、党史、国家大政方针、习总书记系列讲话、先进事迹和行业产业的各类咨询等。传播正能量,其中水产青年公众号推送700篇,累计访问阅读量近10万次。
1.2.7 紫外全光谱扫描 取冻干后样品各5mg,溶于5mL 0.5mol/L醋酸中,在200~400nm进行紫外全光谱扫描。
1.2.8 傅立叶变换红外光谱(FTIR)分析 在红外灯的照射下,将适量的样品和KBr混合均匀,研磨成粉末状。取出样品压成片,将样品放进样品室。用傅立叶变换红外光谱仪(FTIR)在4000~400cm-1区间范围内扫描,分辨率设为2cm-1。
1.2.9 乳化性和乳化稳定性[10]浓度10mg/mL的胶原蛋白溶液22.5mL与7.5mL的大豆色拉油混合,然后用高速组织分散机以22000r/min乳化1min,用微量进样器迅速从底部取50μL乳化液与5mL的0.1%SDS混合均匀,在500nm处测定其吸光值,用0.1%的SDS做空白对照。样品的乳化性(Emulsifying Activity Index,EAI)与乳化稳定性(Emulsifying Stability Index,ESI)计算公式如下:
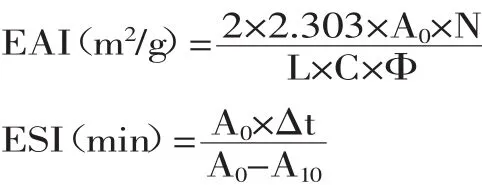
式中:A0为0min的吸光值;A10为乳化液10min后测定的吸光值;L为比色皿光径0.01m;N为稀释倍数 100;C为乳化液形成前蛋白质水溶液中蛋白质浓度单位g/m3;Φ是乳化液中油的体积分数为0. 25;△t为10min。
1.2.10 吸湿性和保湿性[11]
1.2.10.1 吸湿性测定 在相同大小的称量瓶中,精确称取0.5g样品,以甘油作为对照,置于盛有饱和(NH4)2SO4(相对湿度81%)的密闭干燥器中。每隔一定时间取出称重,记录其重量的变化并计算吸湿率。
吸湿率(%)=(吸湿后的重量-吸湿前重量)/吸湿前重量×100
1.2.10.2 保湿性测定 在相同大小的称量瓶中精确称取0.5g样品,以甘油作为对照,同时在称量瓶加入样品质量的10%的蒸馏水,分别置于盛有无水硅胶的密闭干燥器中,每隔一定时间取出称重,记录其重量的变化并计算水分残留率。
水分残留率(%)=(样品初始含水量-放置后样品含水量)/样品初始含水质量×100
2 结果与讨论
2.1 羟脯氨酸含量和平均分子量的比较
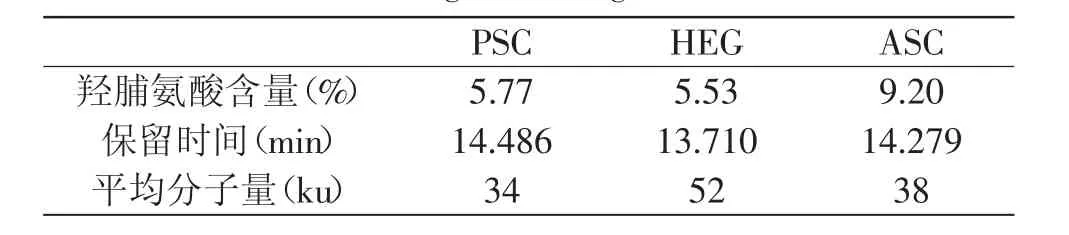
表1 胶原蛋白羟脯氨酸含量和平均分子量比较Table 1 The hydroxyproline content and the average molecular weight of collagen
羟脯氨酸是胶原蛋白的特征氨基酸,故一般通过测定羟脯氨酸含量来确定胶原蛋白的含量[12]。从表1中可以看出,PSC和HEG中羟脯氨酸含量较ASC低,因此酸法提取能得到较高纯度的胶原蛋白。这可能是由于海蜇皮中含有较多的肌原纤维蛋白和肌浆蛋白,而大多数肌原纤维蛋白和肌浆蛋白为碱溶性蛋白,在酸性条件下不容易溶出所致。所以,酸法提取的胶原蛋白能得到较高的纯度,而酶法和热水提取由于破坏了胶原蛋白的空间结构,提高了胶原蛋白的得率的同时造成了肌原纤维蛋白和肌浆蛋白的溶出,影响了所提取胶原蛋白的纯度。
HEG同ASC和PSC相比,平均分子量较大。这可能是由于蛋白酶和酸溶液的影响,在酶法提取和酸法提取过程中造成了胶原蛋白分子在一定程度上发生降解。
2.2 紫外全光谱扫描
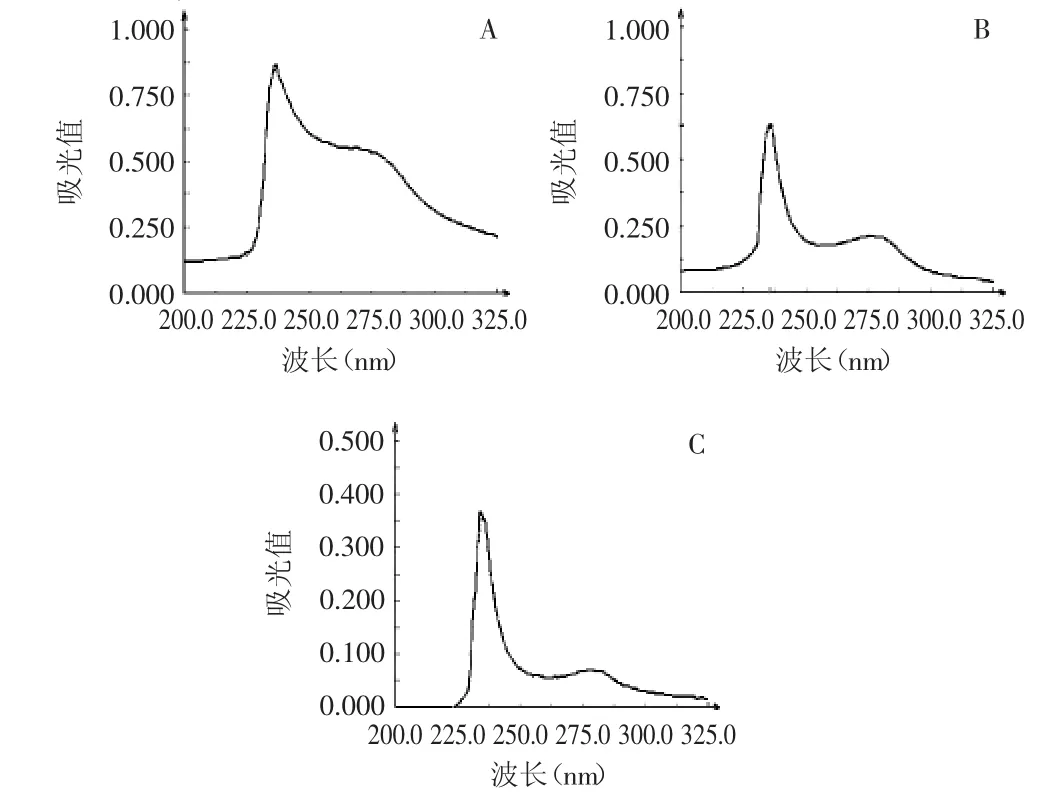
图1 紫外全光谱扫描Fig.1 The ultraviolet absorption spectra of collagens from jellyfish
由于胶原蛋白不含色氨酸和苯丙氨酸等芳香族氨基酸,因此在280nm处无明显吸收峰。而由于胶原蛋白含有脯氨酸和羟脯氨酸,其吸收峰在230nm左右[13]。从图1可以看出,PSC的最大吸收峰为236.2nm;HEG的最大吸收峰为235.8nm;ASC的最大吸收峰为233.9nm。这符合胶原蛋白的特征吸收,其中PSC、HEG同ASC相比,在240nm到280nm有比较明显的吸收,这可能是由于PSC中含有其他蛋白杂质所致。
2.3 三种提取胶原蛋白方法的红外光谱扫描
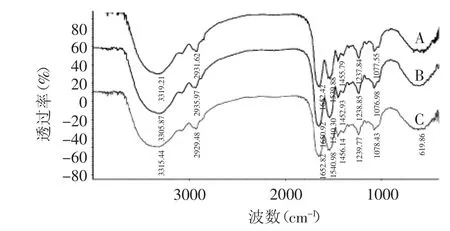
图2 胶原蛋白红外扫描图Fig.2 FTIR spectrogram of collagen from jellyfish
图2为胶原蛋白的红外光谱扫描图。从图2可知,三种方法提取的胶原蛋白红外图谱基本一致。其中N-H伸缩振动产生的酰胺A的吸收通常在3400~3440cm-1,当含有N-H基团的分子肽段参与氢键的形成时,N-H的伸缩振动会向低频率移动,通常在3300cm-1左右。PSC,HEG和ASC的酰胺A吸收峰分别为3319、3306和3315cm-1,符合酰胺A的特征吸收,表明所提取的三种胶原蛋白分子中存在氢键。三种胶原蛋白的酰胺B吸收分别在2932、2936和2929cm-1。酰胺Ⅰ带的特征吸收波数通常在1625~1690cm-1,是由蛋白质多肽骨架的C=O伸缩振动产生,为蛋白质二级结构变化的敏感区,常被用于蛋白质的二级结构分析。三种方法提取的胶原蛋白最强吸收峰在1652cm-1左右,符合酰胺Ⅰ带的出峰位置。胶原蛋白酰胺Ⅱ带的吸收在1500~1600cm-1,而三种样品酰胺Ⅱ带的吸收频率为1540cm-1左右。酶法提取胶原蛋白酰胺Ⅲ带的吸收峰为1238cm-1,而热水提取和酸法提取所得胶原蛋白的酰胺Ⅲ带吸收峰分别为1239cm-1和1240cm-1。
2.4 乳化性和乳化稳定性
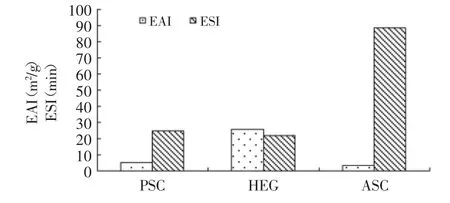
图3 胶原蛋白乳化指数和乳化稳定性的比较Fig.3 Comparison of emulsifying activity index and emulsion stability index of collagens
经测定PSC、HEG、ASC的EAI分别为5.07、25.90、3.26m2/g;ESI分别为24.68、21.89、88.5min。从图3可以看出,HEG乳化性明显高于ASC和PSC。这可能是由于HEG的分子量高于PSC和ASC所致。乳化稳定性大小依次为:ASC>PSC>HEG。
2.5 吸湿性曲线
从图4能够看出,三种方法提取的胶原蛋白的吸湿率随时间变化曲线类似。胶原蛋白的吸湿效果明显小于甘油的吸湿效果。由于制备方法的差异,PSC、HEG和ASC暴露的亲水集团存在差异,造成了胶原蛋白的吸湿性PSC>HEG>ASC。
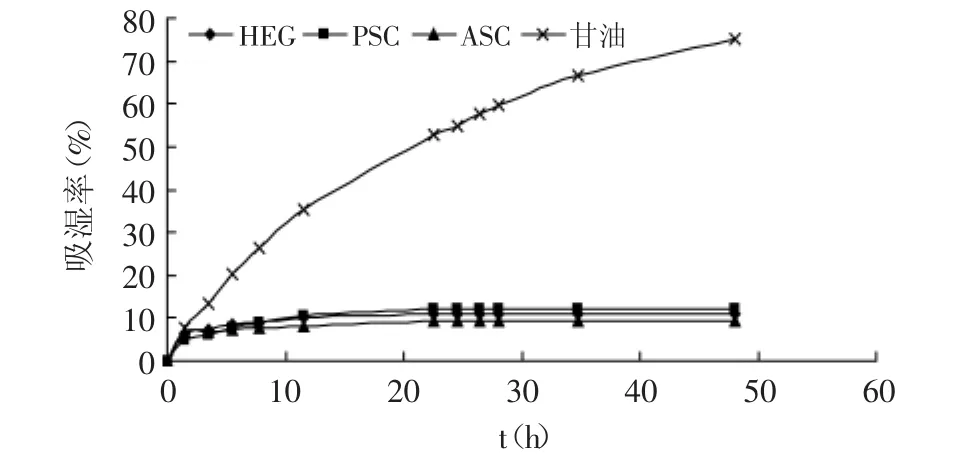
图4吸湿曲线Fig.4 Moisture-absorption curve注:相对湿度81%。
样品的保湿性也与样品的结构和暴露的亲水基团有关。从图5中看出甘油的保湿效果最好,PSC保湿效果相对优于ASC和HEG。
3 结论
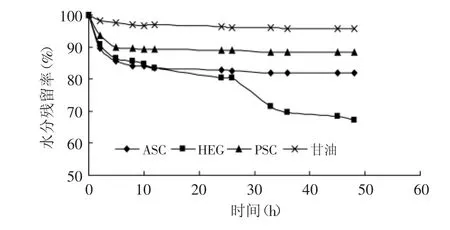
图5 水分残留率曲线Fig.5 Moisture retention rate curve注:相对湿度0%。
本研究以沙海蜇为原料,讨论了提取胶原蛋白常用的三种方法(酶法提取、热水提取和酸法提取)所得胶原蛋白的理化性质。结果表明三种方法得到的胶原蛋白结构相似。酸法提取可以得到纯度较高的胶原蛋白,其羟脯氨酸含量高于PSC和HEG,并且ASC具有良好的乳化稳定性。HEG分子量相对较大,且具有良好的乳化性。其吸湿性由强到弱依次为PSC>HEG>ASC,保湿性最好的样品为PSC。实验结果提示,采用酶法提取、热水提取和酶法提取的海蜇胶原蛋白由于具备不同的理化性质而分别适用于不同的应用领域。
[1]江静渡,陈俊民,陈作如,等.无脊椎动物学[M].第二版.北京:高等教育出社,1982:97.
[2]Y-H P Hsieh,F M Leong,J Rudloe.Jellyfish as food[J]. Hydrobiologia,2001,451:11-17.
[3]钱曼,武贤壮,邱承光,等.热力法和酶解法提取鱼鳞胶原蛋白的工艺及性质研究[J].食品工业科技,2007(10):70-72.
[4]易继兵,李八方,赵雪,等.狮子鱼皮胶原蛋白的提取及理化性质研究[J].食品工业科技,2010(4):65-67.
[5]张绵松,袁文鹏,王小军,等.海蜇皮水解条件的研究[J].食品工业科技,2010(2):258-260.
[6]涂灿时,李正军.鱼鳞胶原蛋白的提取技术[J].西部皮革,2010,32(19):27-29.
[7]李国英,张忠楷,雷苏,等.胶原、明胶和水解胶原蛋白的性能差异[J].四川大学学报工程版,2005,37(4):54-58.
[8]庄永亮.海蜇胶原蛋白的理化性质及其胶原肽的护肤活性研究[D].北京:食品科学与工程学院,2008.
[9]关静,叶萍.胶原海绵的羟脯氨酸含量测定[J].氨基酸和生物资源,2000(1):52-54.
[10]K N Pearce,J E Kinsella.Emulsifying properties of proteins:evaluation of a turbidimetric technique[J].J Agri Food Chem,1978,26:716-723.
[11]施昌松,崔凤玲,张洪广,等.化妆品常用保湿剂保湿吸湿性能研究[J].日用化学品科学,2007,30:25-30.
[12]蒋挺大.胶原与胶原蛋白[M].北京:化学工业出版社,2006.
[13]赵苍碧,黄玉东,李艳辉.从牛腱中提取胶原蛋白的研究[J].哈尔滨工业大学学报,2004,36(4):516-519.
Comparative analysis of collagen prepared from jellyfish by different extraction methods
TAO Yu,LI Zhi-hao,HOU Hu,WANG Shan-shan,LI Ba-fang*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
Jellyfish was used as the raw materials in this study.The hot water extraction gelatin(HEG),pepsinsolubilized collagen(PSC)and acid-soluble collagen(ASC)was isolated from jellyfish by hot water,enzyme hydrolysis extraction methods and acid extraction methods.Physic-chemical and functional properties were investigated and compared.Results showed that the contents of hydroxyproline content of PSC,HEG and ASC were 5.77%,5.53%and 9.2%,respectively.The average molecular weights were 34,52 and 38ku.The ultraviolet absorption spectra and FTIR spectrogram showed that PSC,HEG and PSC had similar structures.The sequence of emulsifying properties of PSC、HEG、ASC were 5.07,25.90,3.26m2/g.The sequence of emulsify stability of PSC、HEG、ASC were 24.68、21.89、88.5min,PSC had better hygroscopicity and moisture retention property.
jellyfish;collagen;extraction;property
TS254.4
B
1002-0306(2012)14-0310-04
2011-12-13 *通讯联系人
陶宇(1988-),女,硕士研究生,研究方向:沙海蜇胶原蛋白护肤活性。
海洋公益专项(201105029)。

