响应面分析法优化酶提取甜茶茶多酚工艺
程雅芳,杨 洋,温富雄,袁经权,缪剑华,*
(1.广西大学生命科学与技术学院,广西 南宁 530004;2.广西药用植物园,广西 南宁 530023)
响应面分析法优化酶提取甜茶茶多酚工艺
程雅芳1,杨 洋1,温富雄1,袁经权2,缪剑华2,*
(1.广西大学生命科学与技术学院,广西 南宁 530004;2.广西药用植物园,广西 南宁 530023)
利用响应面分析法对复合酶辅助提取甜茶中的茶多酚的工艺进行优化。在单因素试验基础上选取因素与水平,根据中心组合的试验设计原理和响应面分析法,分析各个因素的显著性和交互作用,结果确定甜茶中的茶多酚的提取最佳工艺条件为:复合酶是由纤维素酶和果胶酶以3:4的比例混合而成;在45℃的水浴条件下,加酶量为0.6%(m/m)、pH4.95、酶解时间47.76min、料液比1:23.58(g/mL),酶解后的原料用体积分数40%的乙醇溶液、料液比1:28(g/mL)、温度70℃回流提取70min的条件下,茶多酚提取量可达133.2mg/g。
甜茶;茶多酚;酶;响应面分析
广西大瑶山甜茶属蔷薇科甜茶(Rubus suavissimusS.Lee,Sweet tea),又名甜叶悬钩子,为悬沟子属多年生有刺灌木。性凉,味甘、平,有清热、润肺利咽、祛痰止咳之功效。分布于我国南方地区,主产广西。甜茶的主要成分有甜茶素、黄酮、茶多酚等,具有消除自由基、抗氧化等生物活性,在抑菌、抗病毒、抑制肿瘤、防治心血管疾病等方面具有良好功效[1-4]。目前国内对甜茶茶多酚的提取常用的方法有水提法、水提碱转法[5-6],本实验采用复合酶(纤维素酶+果胶酶)辅助乙醇提取法提取茶多酚,以响应面分析法优化甜茶茶多酚的提取工艺。
1 材料与方法
1.1 材料与仪器
甜茶叶采自于广西金秀县,烘干粉碎备用。
纤维素酶(1000U/g)、果胶酶(10000U/g)、木瓜蛋白酶(295900U/g) 南宁市基亚实验用品公司;没食子酸标准品(>98%)、福林酚试剂 南宁恒因生物科技有限公司;乙醇、碳酸氢钠等均为分析纯。
UV-1240型紫外-可见分光光度计 日本岛津公司;H H-4型数显恒温水浴锅 国华电器有限公司;D8023CTL-K4型格兰仕微波炉 佛山市格兰仕微波炉电器有限公司;VCX130型超声波仪 美国Sonics & Materials公司;电热恒温干燥箱 上海跃进医疗器械厂。
1.2 方法
1.2.1 茶多酚含量的测定
准确称取没食子酸标准品100mg,置100mL容量瓶中,以去离子水溶解,定容后得到没食子酸标准溶液。准确吸取没食子酸溶液0.0、1.0、2.0、3.0、4.0、5.0mL分别置100mL容量瓶中,分别以水定容至刻度,摇匀,使其质量浓度分别为0、10、20、30、40、50μg/mL的没食子酸;分别取6种没食子酸各1mL移到试管,分别加入5mL的福林酚试剂,摇匀,反应3~8min,加入4.0mL质量分数75g/L的碳酸钠溶液,摇匀,室温静置60min;在波长765nm处测定吸光度[7]。以没食子酸含量(y)和吸光度进行线性回归,得标准曲线方程:
y=0.0737x-0.0008,R2=0.9995
1.2.2 甜茶茶多酚提取工艺
工艺流程:干燥的甜茶叶→粉碎过筛→分别考察4种提取方法→定容→按照标准曲线的测定方法,测定样品中茶多酚的含量。

分别用乙醇回流提取法、超声波辅助乙醇提取法、微波辅助乙醇提取法、酶辅助乙醇提取法[8-16]比较4种方法的提取量,筛选出最优的提取方法。
1.2.3 响应面分析法优化酶辅助乙醇提取甜茶茶多酚工艺
考察复合酶辅助乙醇提取方法,采用单因素分析方法对酶的种类、复合酶的用量、乙醇回流时间、酶解时间、酶解温度、酶解pH值、酶解时液料比等影响因素进行分析,确定单个因素的最优提取条件。利用单因素显著性分析,确定单因素影响因子较高的4个单因素,进一步设计中心组合CCD实验。即考察复合酶(纤维素酶+果胶酶)用量、酶解pH值、酶解时间和料液比4因素,每个因素取3个水平见表1,以提取量为考察指标,每次作3个平行实验,优选出最佳提取条件。

表1 酶辅助乙醇提取甜茶茶多酚工艺响应面分析试验设计表Table 1 Factors and levels of RSM design for optimizing enzymeassisted ethanol extraction of polyphenols
2 结果与分析
2.1 4种提取工艺对甜茶多酚提取的影响
按照1.2.2节的工艺流程,通过单因素和正交试验,考察乙醇回流法、超声波辅助乙醇提取法、微波辅助乙醇提取法和酶辅助乙醇回流提取法对茶多酚提取量的影响,提取量结果见表2。

表2 4种提取方法对茶多酚提取量的比较Table 2 Comparison of four methods on the extraction rate of polyphenols
表2表明,复合酶辅助提取法对甜茶茶多酚的提取量最高。
2.2 复合酶的筛选
分别考察纤维素酶(Type 1)、纤维素酶与果胶酶合成复合酶(Type 2)、纤维素酶与果胶酶及木瓜蛋白酶的复合酶(Type 3)、果胶酶(Type 4)、木瓜蛋白酶(Type 5)这5种不同组成的酶解体系对茶多酚提取量的影响。结果如图1所示,茶多酚提取量最高的为Type 2,即纤维素酶与果胶酶结合。
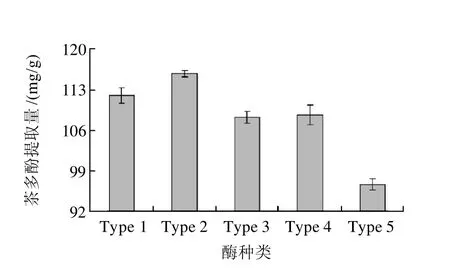
图1 酶种类的变化对茶多酚提取量的影响Fig.1 Effect of enzyme on the extraction rate of polyphenols
2.3 纤维素酶用量对茶多酚提取量的影响
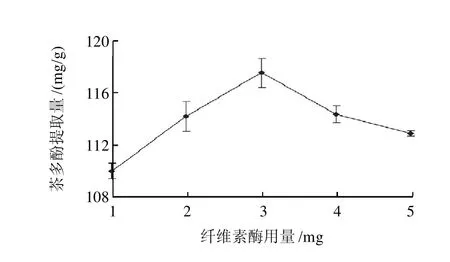
图2 纤维素酶用量对茶多酚提取量的影响Fig.2 Effect of cellulase content on the extraction rate of polyphenols
按照1.2.2节工艺流程,分别在0.5g甜茶干粉中加入1、2、3、4、5mg的纤维素酶,即酶与甜茶干粉的质量比为2、4、6、8、10mg/g,结果如图2所示,在一定量的范围内,随着纤维素酶的用量的增大,酶与底物作用的机会逐渐增多,酶的催化效率亦逐渐升高,茶多酚提取量逐步提高,当纤维素酶用量增大到3mg时提取量达到最大值;之后再增大酶用量,提取量反而下降。可能的原因是酶量过高,底物浓度不能对酶达到饱和,致使酶的作用受到抑制。
2.4 复合酶中果胶酶用量对茶多酚提取量的影响
固定每组先加入0.6%纤维素酶后,依次加入1、2、3、4、5mg果胶酶,即酶与甜茶干粉的质量比为2、4、6、8、10mg/g,按照1.2.2节工艺流程,考察复合酶中果胶酶用量对茶多酚提取量的影响。由图3可知,在一定量的范围内,复合酶中随着果胶酶的用量的增大,酶与底物作用的机会逐渐增多,酶的催化效率亦逐渐升高,茶多酚提取量逐步提高,当果胶酶用量增大到4mg时提取量达到最大值;之后再增大酶用量,提取量反而下降。可能的原因是果胶酶量过高,底物浓度不能对酶达到饱和,致使酶的作用受到抑制,而且茶多酚是蛋白质的天然吸附剂,两者结合会形成聚合沉淀物,从而降低产物得量。
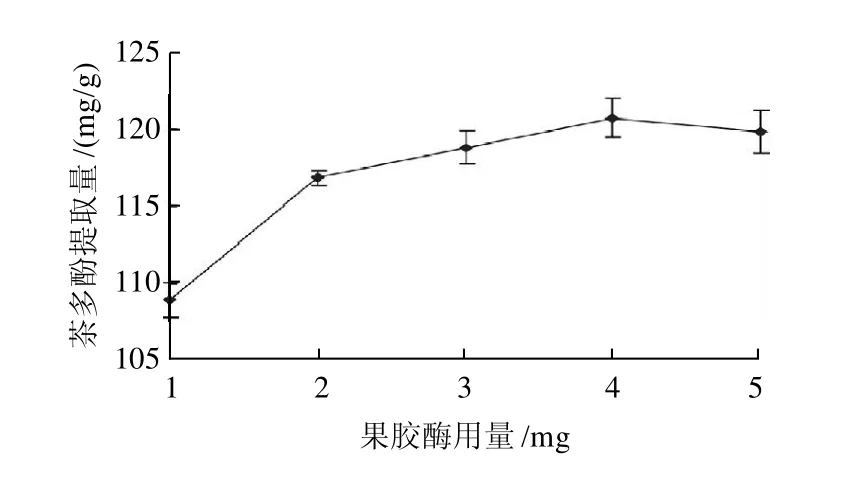
图3 复合酶中果胶酶用量对茶多酚提取量的影响Fig.3 Effect of pectinase content on the extraction rate of polyphenols
2.5 酶解后回流提取时间对茶多酚提取量的影响
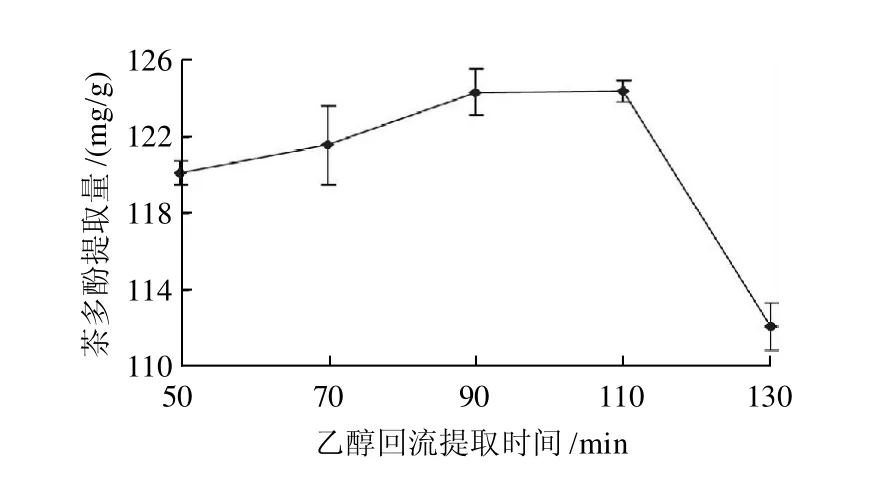
图4 酶解后回流时间对茶多酚提取量的影响Fig.4 Effect of refluxing time after hydrolysis on the extraction rate of polyphenols
酶解条件保持不变,只改变酶解后乙醇回流提取时间,考察酶解后回流提取时间对茶多酚提取量的影响,结果如图4所示,随着酶解后回流时间的增大,茶多酚提取量增高,继续延长回流时间,茶多酚的提取量反而减少,这是因为茶多酚在高温条件下不稳定,主要是发生聚合和氧化反应,形成复杂聚合物,会引起茶多酚结构变化,导致茶多酚提取量降低。因此最佳的酶解后回流时间为90min。
2.6 酶解时间对茶多酚提取量的影响
考察酶解时间(15、30、45、60、75min)在其他酶解因素保持不变的情况下对茶多酚提取量的影响。由图5得知,随着酶解时间的延长茶多酚提取量增高,当酶解时间为45min时,茶多酚提取量达到最高值。延长酶解时间对茶多酚提取量的提高意义不大,因此,选择最佳的酶解时间为45min。
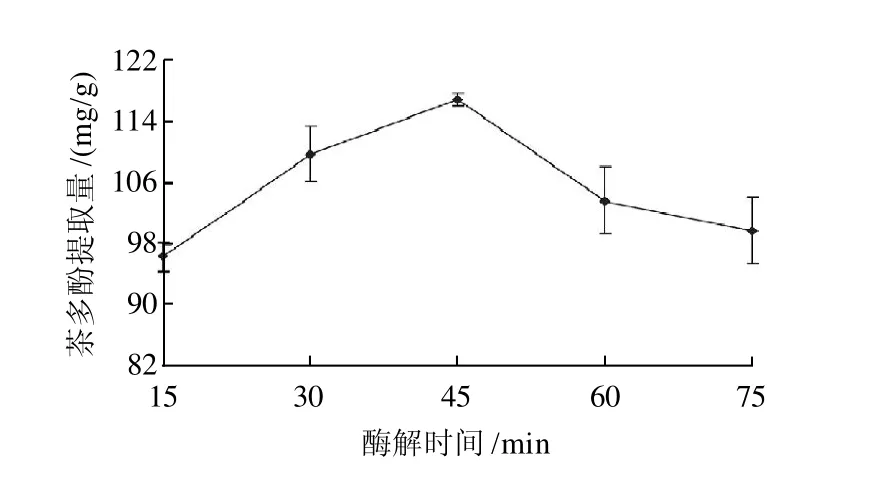
图5 酶解时间对茶多酚提取量的影响Fig.5 Effect of hydrolysis time on the extraction rate of polyphenols
2.7 pH值对茶多酚提取量的影响
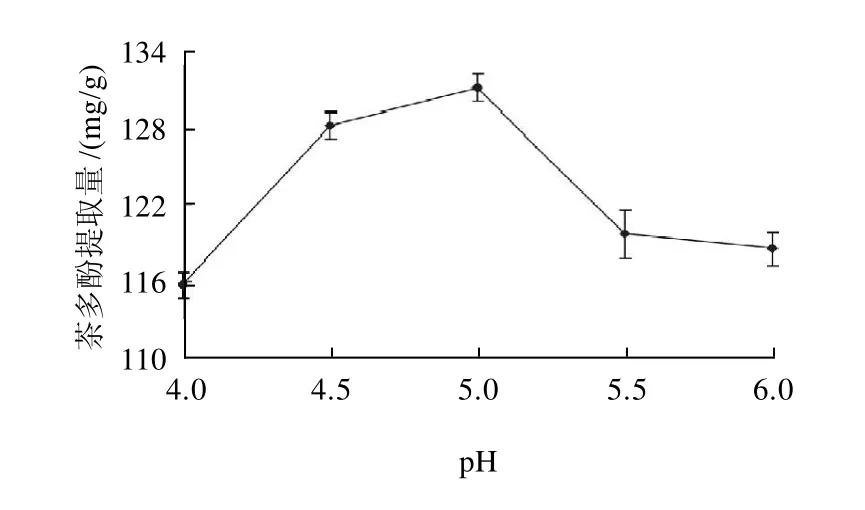
图6 pH值对茶多酚提取量的影响Fig.6 Effect of pH on the extraction rate of polyphenols
考察酶解时pH值(4、4.5、5、5.5、6)在其他酶解条件保持不变的情况下,对茶多酚提取量的影响。因为每种酶都有最适的pH值,对最适pH值的小范围偏离,虽然酶没有变性,但会导致酶活性部位的基团粒子发生改变,从而降低酶的活力;对最适合pH值偏离较大时,会导致酶自身的变性。由图6可知,pH5.0有利于复合酶发挥最大活力,破坏细胞壁,降低传质阻力,从而有利于茶多酚的提取;pH值过高或过低都不利于酶解作用,说明微酸性环境有利于酶的作用。故将最佳提取pH确定为5.0。
2.8 酶解温度对茶多酚提取量的影响
在保持其他酶解条件不变的前提下,考察酶解温度(40、45、50、55、60℃)对茶多酚提取量的影响。结果由图7可知,温度升高,茶多酚提取量随之升高,45℃时复合酶发挥最大活性和稳定性,最大程度地使细胞壁裂解,此温度下的茶多酚提取量最高;继续升高温度,酶蛋白质变性,酶活力减弱,因而得量下降。因此,选取酶解的最适温度为45℃。
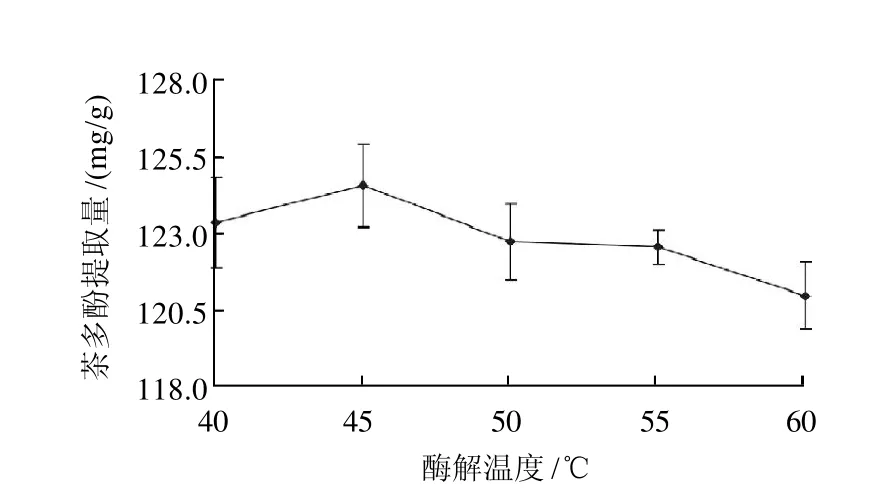
图7 酶解温度对茶多酚提取量的影响Fig.7 Effect of hydrolysis temperature on the extraction rate of polyphenols
2.9 酶解时的液料比对茶多酚提取量的影响
在保持其他酶解条件不变的前提下,考察酶解时料液比[(1:10、1:20、1:30、1:40、1:50(g/mL)]对茶多酚提取量的影响。由图8可知,随着提取溶剂量的增大,与有效成分的接触机会增多,茶多酚提取量增高,当料液比为1:20g/mL时,茶多酚提取量达至最大,从降低能耗的角度考虑,增大提取溶剂的量对茶多酚提取的意义不大,因此,本试验选用1:20(g/mL)为最佳料液比。
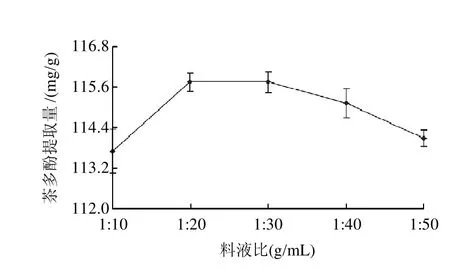
图8 酶解时的料液比对茶多酚提取量的影响Fig.8 Effect of material-liquid ratio on the extraction rate of polyphenols
2.10 响应面分析法优化甜茶茶多酚酶解工艺条件
利用软件Design Expert 7.0.0采用中心组合设计方法(CCD)对酶水解过程进行条件优化,结果见表3。
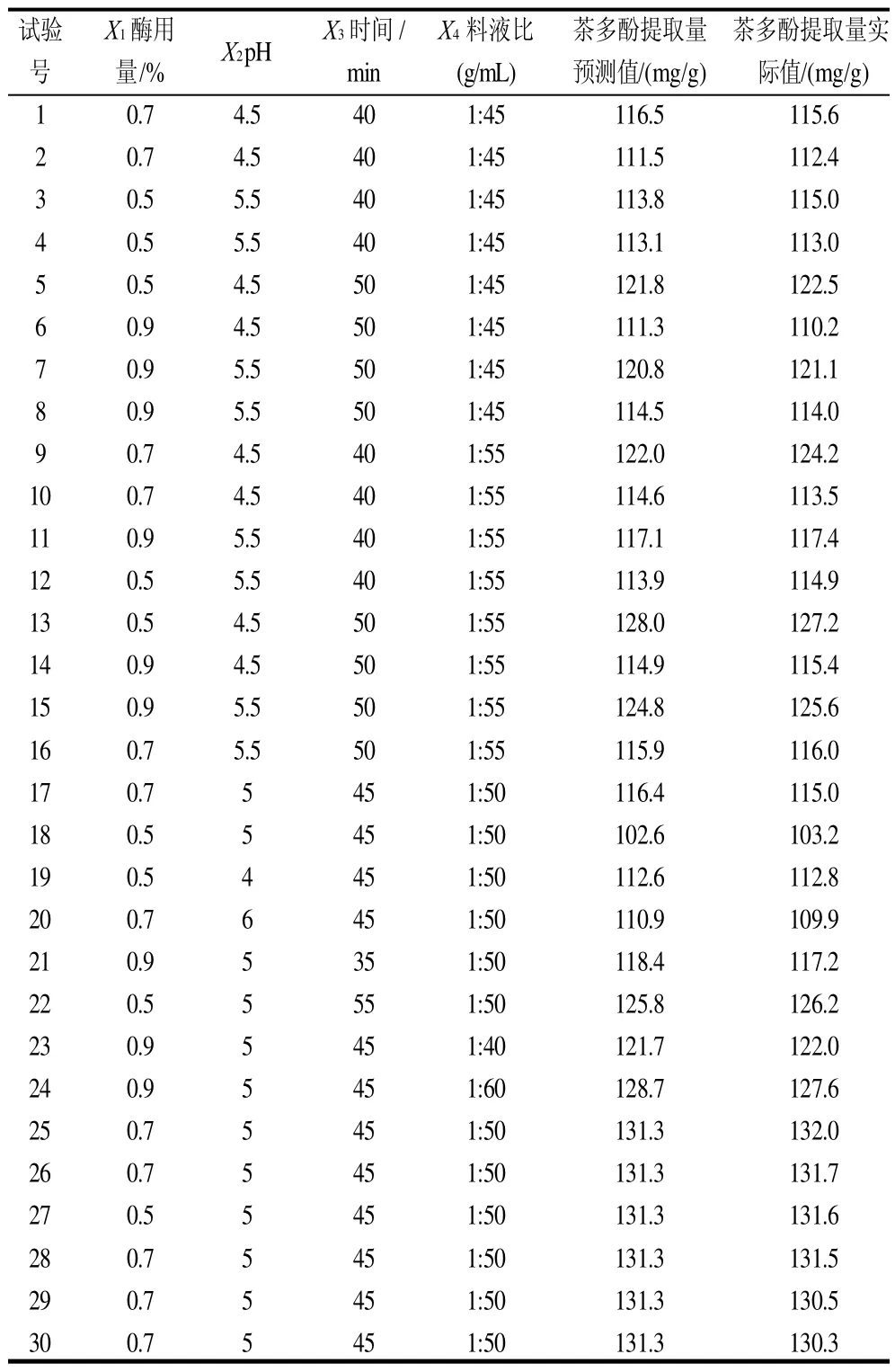
表3 CCD试验设计及结果Table 3 Design and results of CCD tests
通过表3对模型进行多元回归拟合,获得甜茶茶多酚得率对编码自变量——酶用量、pH值、酶解时间、酶解温度的二次多项回归方程:
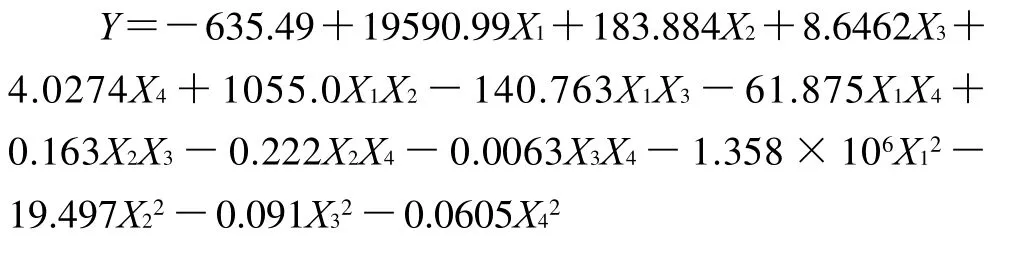
从该模型的方差分析可见,本试验所选用的二次多项模型具有高度的显著性(P模型<0.0001),失拟项在α=0.05水平上不显著(P=0.0661>0.05),其校正决定系数(RAdj2)为0.9766,表明此模型拟合度好,仅有约2.3%的茶多酚得量总变异不能由此模型进行解释。
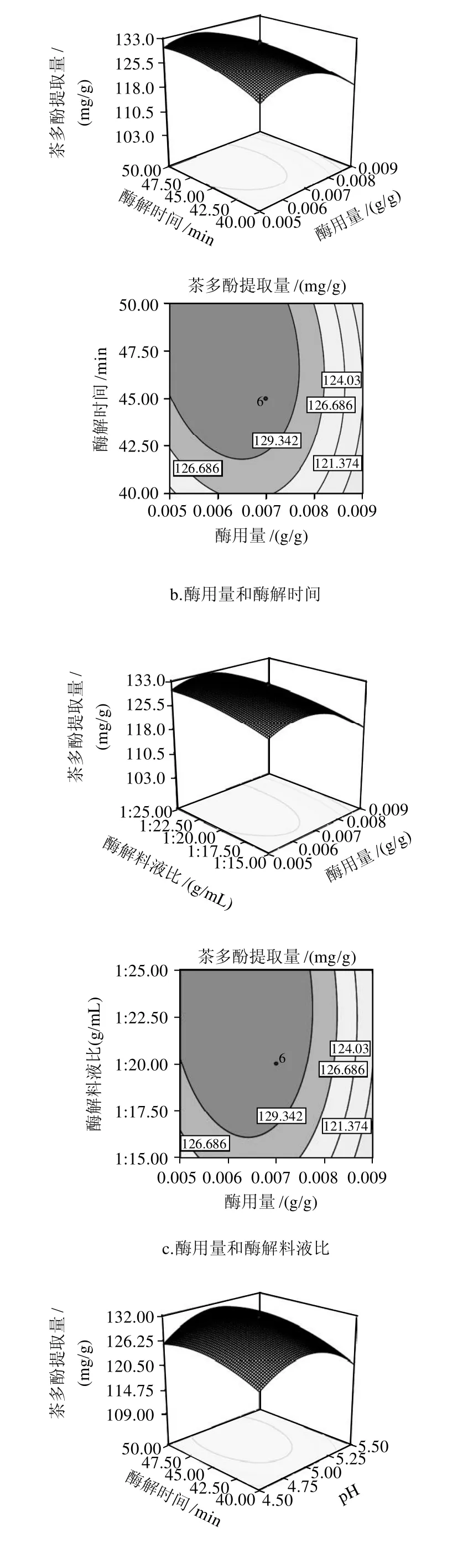
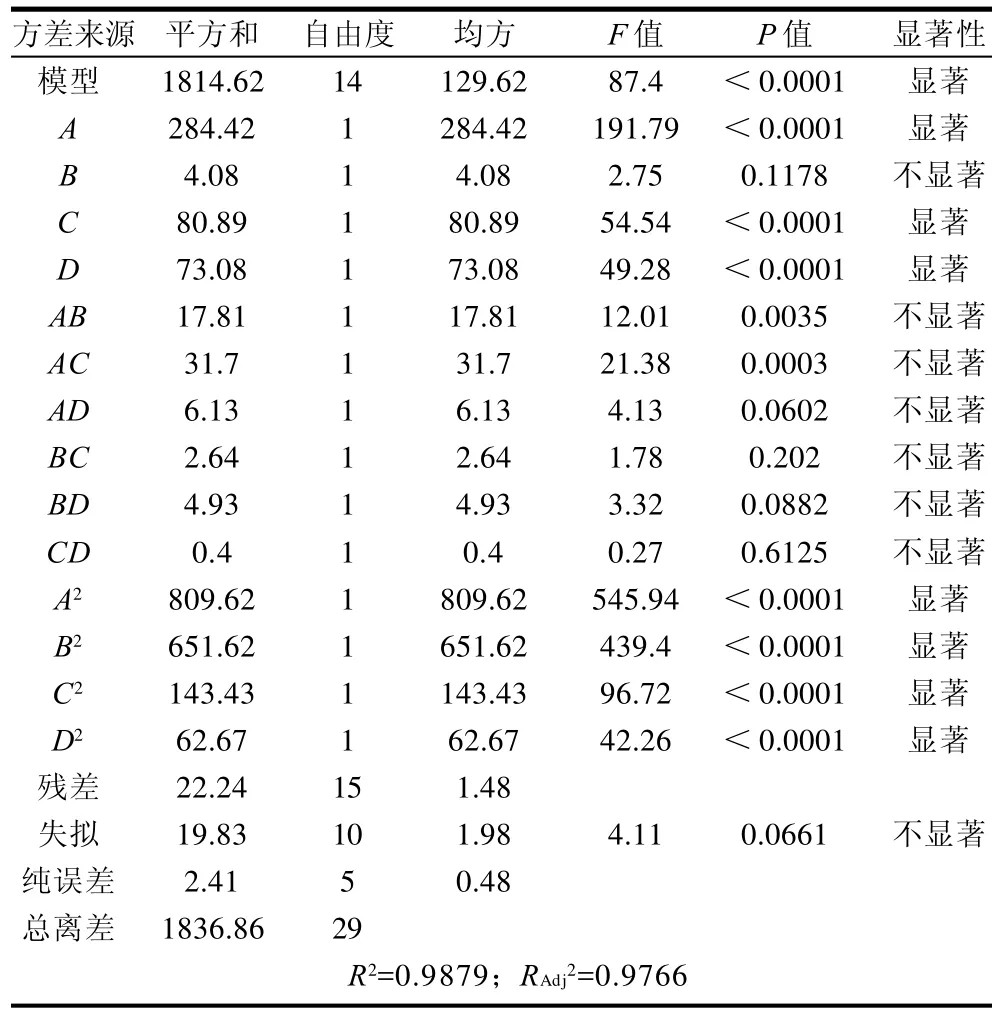
表4 回归方程模型的方差分析Table 4 Analysis of variance for regression equation model
上述方程的回归系数显著性检验表明:在本试验设计范围内,酶用量、酶解时间和酶解料液比3个因素对茶多酚得率的线性效应显著;而酶用量和酶解时间两因素的曲面效应显著,因此酶用量和酶解时间有明显交互作用。
2.11 最佳酶解工艺条件的优化模型及其检验
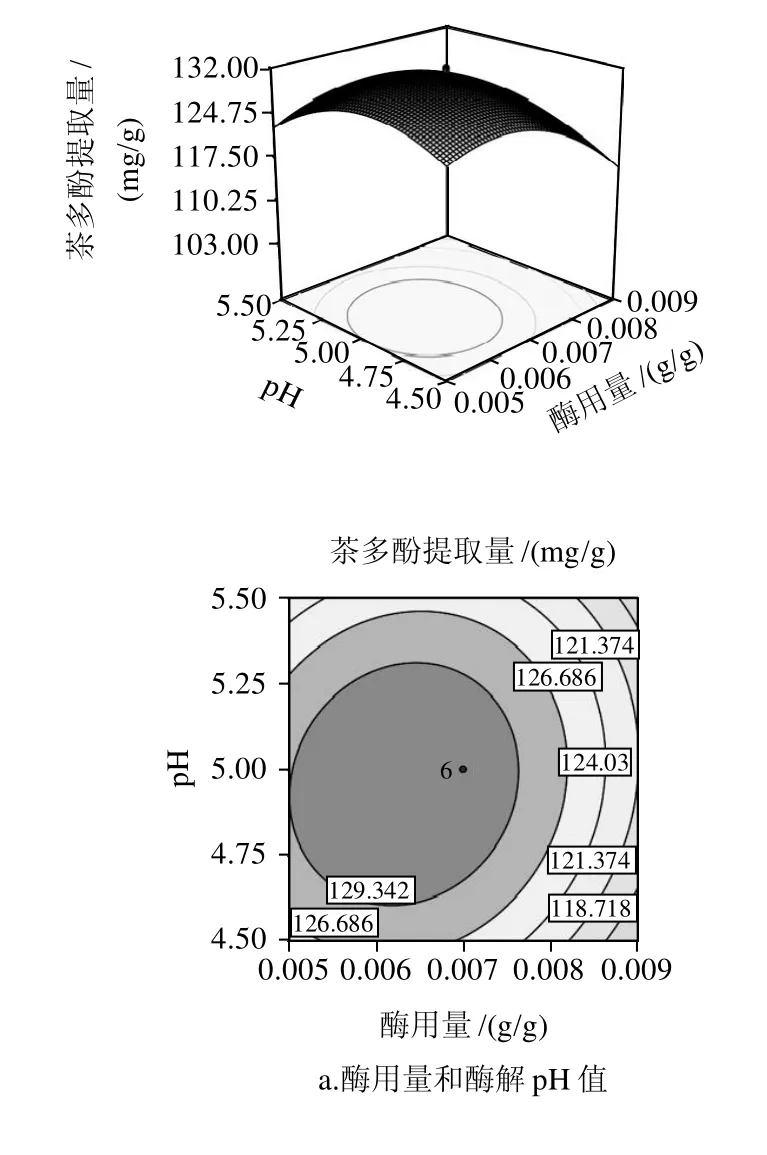
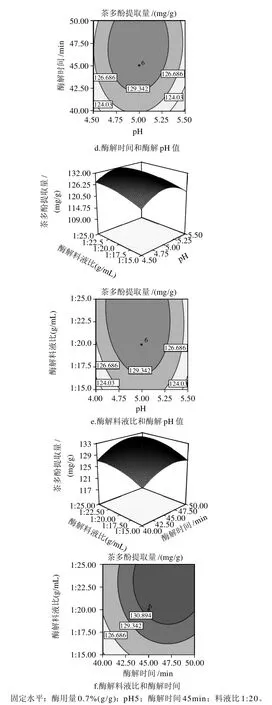
图9 各两因素交互影响甜茶茶多酚提取量的响应面及等高线图Fig.9 Response surface and contour plots for effect of cross-interaction among two factors on the extraction rate of polyphenols
由图9可知,随着酶用量和酶解时间的增大,甜茶多酚的提取量先快速提高后缓慢降低,适当的增大酶浓度,增加酶解时间,可以一定程度提高茶多酚提取量。酶用量、酶解时间是主要的影响甜茶多酚提取量的因素。
由回归模型来预测茶多酚得率最高时的酶解条件为酶用量0.6%、pH4.95、时间47.76min、料液比1:23.58(g/mL),按照该条件进行酶解验证实验,黄酮提取量预测值133.18mg/g。6次平行实验所得黄酮提取量实测值平均为133.05mg/g。实测值与预测值基本一致,证明应用响应曲面法优化的酶解辅助乙醇回流提取甜茶茶多酚工艺是稳定且可行的。
3 结 论
采用中心组合设计及响应面分析,建立复合酶辅助乙醇回流提取甜茶茶多酚提取的二次多项式数学模型。经检验证明该模型是合理可靠的,能够较好地预测甜茶茶多酚的提取量。利用模型的响应面及其等高线,对影响茶多酚提取量的关键因素及其相互作用进行探讨。复合酶辅助乙醇回流提取工艺的最佳条件为复合酶中纤维素酶和果胶酶的比例为3:4、加酶量0.6%(g/g)、pH4.95、酶解时间47.76min、料液比1:23.58(g/mL),在45℃的水浴条件下处理,再用体积分数40%的乙醇,1:28(g/mL)的料液比条件下,70℃回流提取70min,茶多酚提取量可达133.2(mg/g)。
[1] 王立波, 毕彩虹. 甜茶活性成分最新研究进展[J]. 粮食与油脂, 2007(2): 47-49.
[2] 张井坤. 茶多酚的提取及在医药方面应用[J]. 医药化工, 2006(8): 7-l0.
[3] 刘本英, 王平盛. 茶多酚生物学活性的研究进展[J]. 热带农业科技,2006, 29(2): 28-33.
[4] 丰杰, 辛宁. 瑶山甜茶和百色甜茶化学成分及药理研究进展[J]. 时珍国医国药, 2007, 18(5): 1089-1090.
[5] 高程海, 滕建文. 广西甜茶多酚提取工艺研究[J]. 食品工业科技,2006, 27(4): 133-138.
[6] 林继元, 方北曙. 从广西甜茶素粗提物脱苦残渣中提取甜茶茶多酚的研究[J]. 安徽农业科学, 2007, 35(20): 6157-6159.
[7] GB/T 8313—2008 茶叶中茶多酚和儿茶素类含量的检测方法[S].
[8] XIA Tao, SHI Siquan, WAN Xiaochun. Impact of ultrasonic-assisted extraction on the chemical and sensory quality of tea infusion[J]. Journal of Food Engineering, 2006, 74(4): 557-560.
[9] PAN Xuejun, NIU Guoguang, LIU Huizhou. Microwave-assisted extraction of tea polyphenols and tea caffeine from green tea leaves[J]. Chemical Engineering and Processing, 2003, 42(2): 129-133.
[10] OHTANI K, AIKAWA Y, KASAI R, et al. Minor diterpene glycosides from sweet leaves ofRubus suavissimus[J]. Phytochemistry, 1992, 31(5): 1553-1559.
[11] 张卫红, 张效林. 复合酶解法提取茶叶中有效成分的过程研究[D]. 西安: 西北大学, 2005.
[12] 范凤玲, 薛毅, 张金泽. 纤维素酶处理菠萝果渣提高粗多酚溶出率的研究[J]. 食品与发酵工业, 2007, 33(8): 72-77.
[13] 徐怀德, 闫宁环, 陈伟, 等. 黑莓原花青素超声波辅助提取优化及抗氧化性研究[J]. 农业工程学报, 2008, 24(2): 264-269.
[14] 韩爱霞, 任彦蓉. 果胶酶对枸杞中总黄酮的提取效果研究[J]. 食品科技, 2009, 34(8): 138-141.
[15] 王敏, 陆兆新, 吕凤霞, 等. 响应曲面法优化酶法提取银杏叶总黄酮[J]. 食品科学, 2007, 28(3): 117-121.
[16] 肖卫华, 韩鲁佳, 杨增玲, 等. 响应面法优化黄芪黄酮提取工艺的研究[J]. 中国农业大学学报, 2007, 12(5): 52-56.
Optimization of Enzymatic Extraction for Tea Polyphenols from Sweet Tea by Response Surface Methodology
CHENG Ya-fang1,YANG Yang1,WEN Fu-xiong1,YUAN Jing-quan2,MIAO Jian-hua2,*
(1. College of Life Science and Technology, Guangxi University, Nanning 530004, China;2. Guangxi Medicinal Herb Garden, Nanning 530023, China)
The extraction process of polyphenols from sweet tea was explored using compound enzyme-assisted extraction.The compound enzymes were composed of cellulose and pectinase at a mixture ratio of 3:4. Based on response surface methodology,the optimal extraction conditions of enzyme-assisted were enzyme dosage of 0.6%, hydrolysis temperature of 45 ℃, extraction pH of 4.95, extraction time of 47.76 min, and solid-liquid ratio of 1:23.58. The ethanol extraction conditions were ethanol concentration of 40% (V/V), extraction time of 70 min, extraction temperature of 70 ℃ and solid-liquid radio of 1:28. Under the optimal extraction conditions, the yield of tea polyphenols was 133.2 mg/g.
sweet tea;tea polyphenols;enzyme;response surface methodology
TS272
A
1002-6630(2012)10-0010-06
2011-03-27
广西科技厅科技攻关项目(桂科攻07180063)
程雅芳(1984—),女,硕士研究生,研究方向为生物制药。E-mail:avon31@163.com
*通信作者:缪剑华(1961—),男,研究员,博士,研究方向为药用植物鉴定。E-mail:mjh1962@vip.163.com

