响应面法优化软枣猕猴桃蛋白水解及多肽的抗氧化研究
刘长江,贾莎莎,许金光
(沈阳农业大学食品学院,辽宁 沈阳 110866)
响应面法优化软枣猕猴桃蛋白水解及多肽的抗氧化研究
刘长江,贾莎莎,许金光
(沈阳农业大学食品学院,辽宁 沈阳 110866)
以酶解产物清除羟基自由基能力为指标,选用碱性蛋白酶为水解酶,利用响应曲面法优化软枣猕猴桃蛋白最佳酶解工艺条件并制取抗氧化肽。考察其水解度和清除率的相关性。结果表明:碱性蛋白酶最佳酶解工艺为温度50℃、pH9、加酶量4000U/g、酶解时间3h,此时水解度达到最大值为25.08%。在此条件下将软枣猕猴桃蛋白分别水解1、2、3、4、5h得到肽混合物进行抗氧化活性分析,得到其对羟自由基清除率分别为18.69%、24.67%、28.04%、25.82%、26.65%。当酶解时间为3h时,此时抗氧化肽的羟自由基清除率最高。
软枣猕猴桃;抗氧化肽;水解度;清除率
软枣称猴桃(Actinidia argutaSieb.et Zucc.),别名软枣子,主要分布在东北、华北、山东、西北及长江流域,其中,东北南部山区较多见[1]。是大藤木,皮淡灰褐色,片裂,叶互生,稍厚革质或纸质,卵圆形,其果实无污染、口感好,为营养丰富的保健食品和老弱病人的疗效食品,是具有开发前景的第3代水果之一[2]。枣猕猴桃中含有蛋白质、糖类、黄酮类、维生素、氨基酸、矿质元素等多种功能活性成分[3],对软枣猕猴桃的研究报道也越来越多[4-6]。多肽是涉及生物体内各种细胞功能的生物活性物质, 很早以前就有报道称肽可被完整吸收进入血液,对机体的功能和状态起到积极作用,有利于机体健康[7-8]。近年来,通过酶法水解来提高蛋白食品的加工性能、营养性以及释放出生理保健功能的多肽已经受到广泛重视。人们发现小肽在人体吸收代谢过程中具有重要生理功能,如参与机体免疫调节、降血压、促进矿物质吸收及抗血栓等[9-10]。蛋白质酶解可以生成小分子质量的肽类,不但提高了原蛋白的营养价值,而且具有抗氧化、降血压、抗菌等多种活性,其中抗氧化性更是科研工作者研究的热点[11]。刘立芳等[12]利用中性蛋白酶酶解小麦蛋白,得到了具有较强的抗氧化活性的多肽。目前食品工业中使用的抗氧化剂多数为人工合成,随着人们对食品添加剂安全性的关注不断提高,筛选具有抗氧化活性的天然资源已成为食品科学研究的新趋势[13]。因此,开发软枣猕猴桃蛋白多肽及其研究制取工艺具有一定的临床意义和经济价值。
本实验根据酶水解原理和响应曲面统计法(response surface methodology,RSM)对制取软枣猕猴桃蛋白多肽的工艺进行研究[14]。以水解度(degree of hydrolysis,DH)为衡量指标,并以酶浓度、酶解时间、酶解温度和pH值为4因素进行优化设计,同时对酶解产物清除羟基自由基的能力进行分析。为软枣猕猴桃蛋白的优化水解提供一定的基础,也为研究一定功能的活性肽和功能食品基料提供一定理论依据。
1 材料与方法
1.1 材料与试剂
软枣猕猴桃粗蛋白(自制,粗蛋白含量23.35%);碱性蛋白酶、2-脱氧-D-核糖 美国Sigma公司;甘氨酸、茚三酮、三氯乙酸、硫代巴比妥酸等 国药集团化学试剂有限公司。
1.2 仪器与设备
PB-10 pH酸度计 德国Sartorius 公司;HH-4数显恒温水浴锅 常州国华电器有限公司;HD-5电脑紫外检测仪 上海沪西分析仪器厂;高速冷冻离心机。
1.3 方法
1.3.1 软枣猕猴桃蛋白的提取工艺
工艺流程:软枣猕猴桃鲜果→匀浆→加水、调pH8,45℃水浴2h→离心(6000r/min、15min)→取上清液→调pH值,静置→离心取沉淀,水洗至中性→冷冻干燥得软枣猕猴桃粗蛋白。
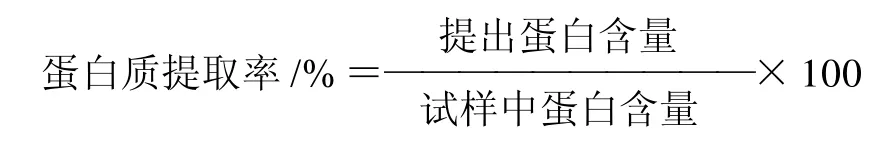
1.3.2 软枣猕猴桃蛋白多肽的制备工艺流程
自制软枣猕猴桃粗蛋白→加水→加热处理(30min、70℃)→冷却→调pH值,加酶液→恒温水解(50℃)→冷却至室温→灭酶(70℃、5min)→离心(4000r/min)→软枣猕猴桃蛋白水解液(软枣猕猴桃蛋白多肽)
1.3.3 氨基酸态氮测定
采用茚三酮显色法[15]。
1.3.4 水解度的计算[16]
取样品溶液1mL,加入pH5.4的醋酸缓冲溶液和茚三酮显示液各1mL混匀后,在100℃沸水水浴15min后,自来水冷却。放置5min后,加入3mL 60%乙醇溶液稀释,摇匀后在570nm处测吸光度。将
吸光度与甘氨酸标准曲线对照,得出氨基酸态氮含量。
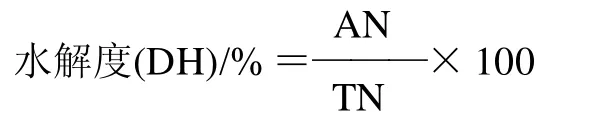
式中:AN为水解液中氨基酸态氮的含量/%;TN为原料中粗蛋白总氮的含量/%。
1.3.5 单因素试验
蛋白酶解一般受到加酶量、酶解温度、pH值、酶解时间等影响。本试验将软枣猕猴桃蛋白与蒸馏水按一定比例溶解,初始提取条件为加酶量4000U/g、pH9、酶解温度50℃、酶解时间3h,在此基础上测定不同单因素条件下,软枣猕猴桃蛋白酶解水解度的变化。
单因素水平:加酶量2000、3000、4000、5000、6000U/g;酶解温度30、40、50、60、70℃;pH7、8、9、1 0、1 1;酶解时间1、2、3、4、5 h。
1.3.6 碱性蛋白酶酶解软枣猕猴桃蛋白的响应曲面优化设计
根据单因素试验,选取影响酶解效果的酶解时间、温度、pH值、加酶量4个因素。利用Minitab 15软件,采用Box-Behnken中心组合试验设计,以蛋白质的水解率为评价指标,确定碱性蛋白酶提取软枣猕猴桃蛋白多肽的最优条件,试验因素水平编码见表1。
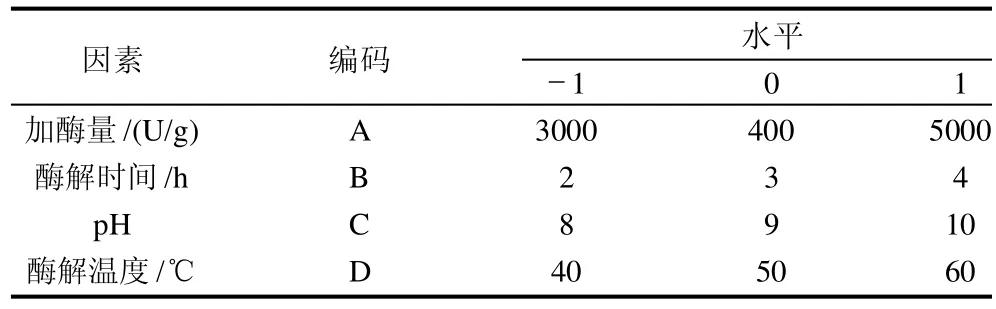
表1 碱性蛋白酶酶解软枣猕猴桃蛋白的响应面试验因素水平表Table 1 Factors and levels of response surface design
1.3.7 软枣猕猴桃蛋白多肽清除羟自由基的测定[17-20]
为测定软枣猕猴桃蛋白多肽清除羟自由基的能力,利用Feton体系产生的羟自由基,通过分析自由基对2-脱氧-D-核糖分子的氧化、破坏情况来确定样品的存在是否对羟基自由基具有清除作用,保护2-脱氧-D-核糖分子不被羟自由基氧化、破坏。具体测定方法:取0.2mL FeSO4-EDTA混合液(10mmol/L)于试管中,加入0.05mL 2-脱氧-D-核糖溶液(10mmol/L),然后加适量软枣猕猴桃蛋白多肽,用0.1mol/L磷酸缓冲液(pH7.4)定容至1.8mL,再加入0.2mL H2O2(10mmol/L),混合后置于37℃恒温水浴中反应1h,然后加入质量分数2.8%的三氯乙酸(TCA)溶液1.0mL,质量分数1.0%的硫代巴比妥酸(TBA)溶液1.0mL,混匀,置沸水浴反应15min,冷却后用在波长532nm处测吸光度。对照管除不加酶解液外,其余相同,所测吸光度(A0),空白管以磷酸缓冲液调零,用清除率表示清除能力。式中:A0为不加酶液测的空白值;A为样品的吸光度。
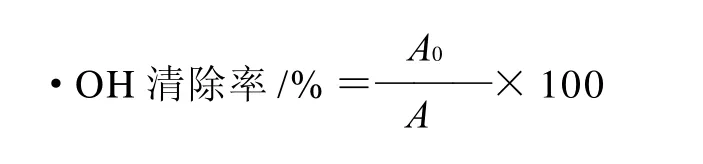
2 结果与分析
2.1 碱性蛋白酶提取软枣猕猴桃蛋白抗氧化肽的单因素试验
2.1.1 加酶量对水解度的影响
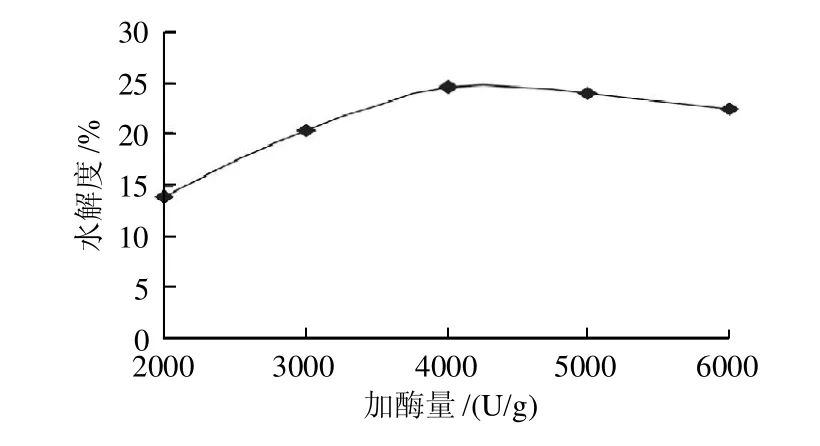
图1 加酶量对水解度的影响Fig.1 Effect of enzyme dosage on the degree of hydrolysis
由图1可知,随着加酶量的增加,软枣猕猴桃蛋白水解度逐渐升高。当加酶量达到一定程度时,大部分蛋白酶解,此后随着加酶量的增大,水解度无显著提高。碱性蛋白酶在水解软枣猕猴桃蛋白时,在加酶量4000U/g时,软枣猕猴桃蛋白多肽水解度的上升趋势趋于平缓,则确定碱性蛋白酶水解软枣猕猴桃蛋白的最适加酶量为4000U/g。
2.1.2 pH值对水解度的影响
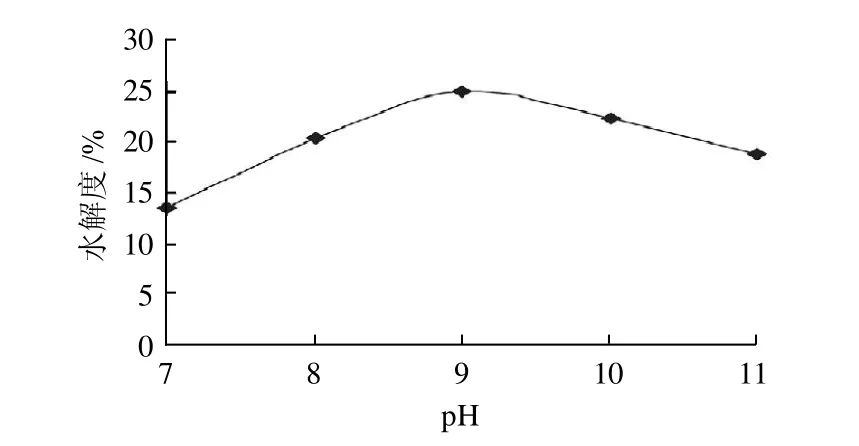
图2 pH值对水解度的影响Fig.2 Effect of pH on the degree of hydrolysis
由图2可知,pH值对水解效果的影响显著。碱性蛋白酶酶解软枣猕猴桃蛋白时,pH值从7增加到9时,蛋白水解度逐渐增大;而当pH值从9增加到11时,软枣猕猴桃蛋白的水解度逐渐减小,pH值为9时水解度达到最高。因此,确定碱性蛋白酶水解软枣猕猴桃蛋白的最适pH值为9。
2.1.3 温度对水解度的影响
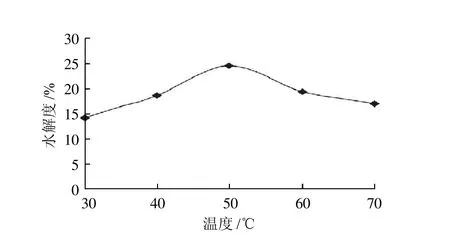
图3 酶解温度对水解度的影响Fig.3 Effect of hydrolysis temperature on the degree of hydrolysis
从图3可知,酶解温度对水解效果的影响显著。碱性蛋白酶在水解软枣猕猴桃蛋白时,温度从30℃增加到50℃,软枣猕猴桃蛋白水解度升高显著,且升趋势明显;而当温度继续升高,则蛋白提取率逐渐下降,温度50℃时酶解得到的软枣猕猴桃蛋白水解度达到最高。因此,确定碱性蛋白酶水解软枣猕猴桃蛋白的最适温度为50℃。
2.1.4 酶解时间对水解度的影响
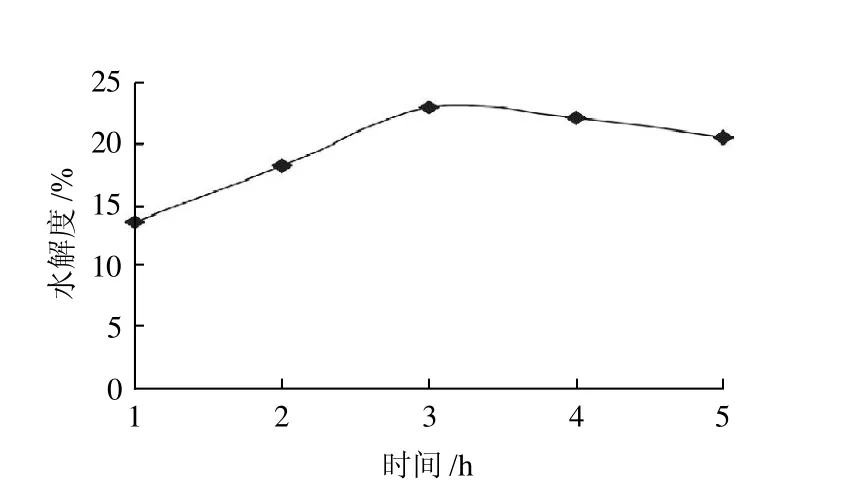
图4 酶解时间对水解度的影响Fig.4 Effect of hydrolysis time on the degree of hydrolysis
从图4可以看出,酶解时间对水解度有一定影响。酶解软枣猕猴桃蛋白时,随时间的延长,软枣猕猴桃多肽的水解度逐渐增多,当达到一定时间后,软枣猕猴桃多肽的水解度随时间的延长而趋于平缓。这是因为随着酶解的进行,软枣猕猴桃蛋白含量逐渐减少。碱性蛋白酶水解软枣猕猴桃蛋白时,3h以后,水解度变化逐渐趋于平缓,因此,选择碱性蛋白酶水解软枣猕猴桃蛋白的最适时间是3h。
2.2 酶解软枣猕猴桃蛋白的响应面试验数据分析
2.2.1 正交试验设计及结果
在单因素试验基础上进行响应面试验,根据Box-Behnken中心组合设计原理,以相关性密切的4个因素
酶解温度、加酶量、pH值和酶解时间为自变量,水解度为响应值对工艺参数进行优化,设计方案及结果分析表见表2。
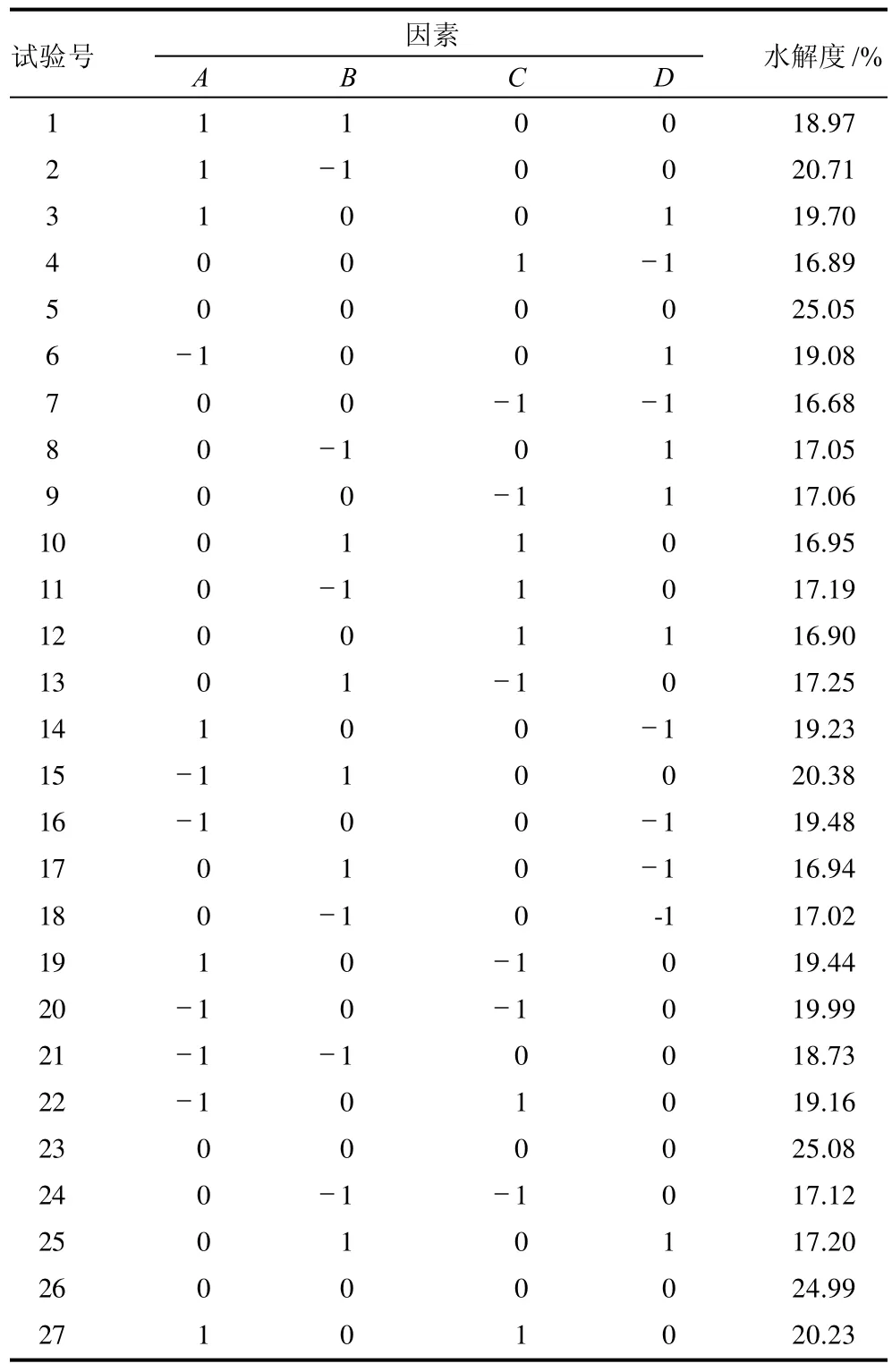
表2 软枣猕猴桃蛋白酶解工艺优化响应面试验设计及结果Table 2 Design and results of response surface tests
根据表2结果,利用Minitab 15软件分析得到软枣猕猴桃蛋白的水解度对编码自变量的二次多项式回归模型为:Y=25.05-0.41A-0.47B-0.337C+0.37D-0.52AB+0.29AC+0.69AD+0.89BC-0.08BD-0.12CD-1.26A2-2.12B2-3.28C2-5.53D2。
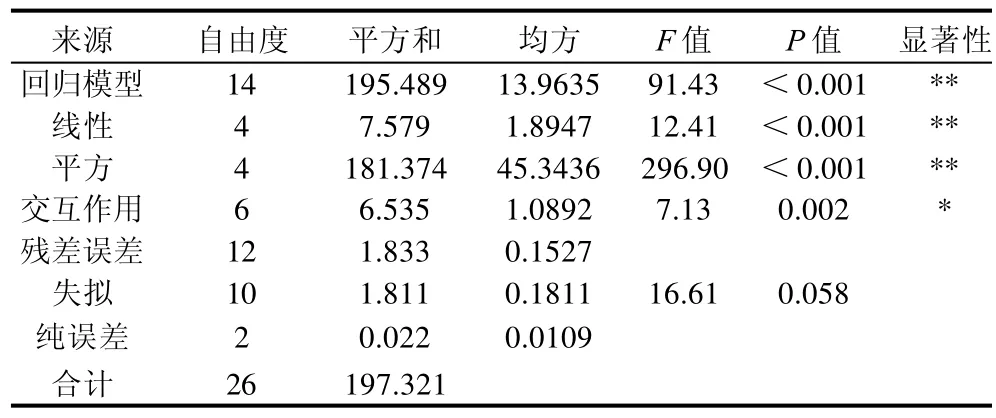
表3 回归模型方差分析Table 3 Analysis of variances for the developed regression model
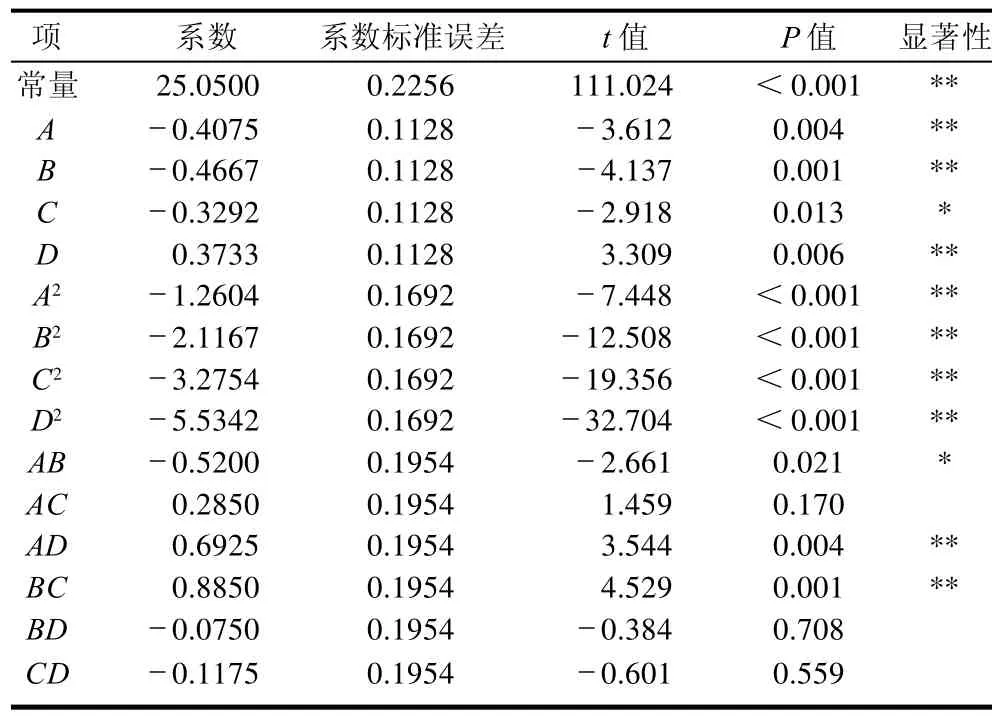
表4 回归模型系数显著性检验Table 4 Significance test for each item in the regression model
由表3、4可知,该模型的预测系数为R2(预测决定系数)=0.9469,相对于校正决定系数R2Adj=0.9799拟合度好,决定系数为R2=0.9907,说明该模型的拟合性非常好,可以用于模型分析。
从表4可知,A、B、D、A D、B C、A2、B2、C2、D2差异极显著;C、AB为显著项;BD、CD为不显著项。失拟项的P=0.058,说明失拟项不显著,模型的拟合性好。因此可利用该回归模型对试验结果进行优化分析,确定软枣猕猴桃蛋白水解的最佳工艺条件。2.2.2 响应面分析及优化
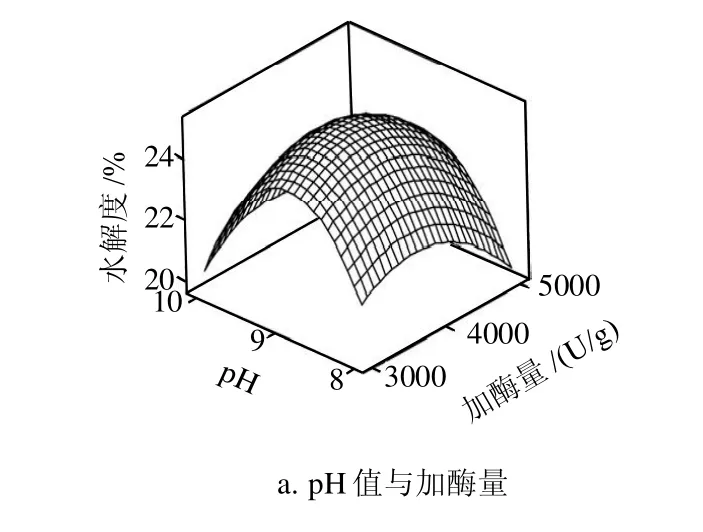
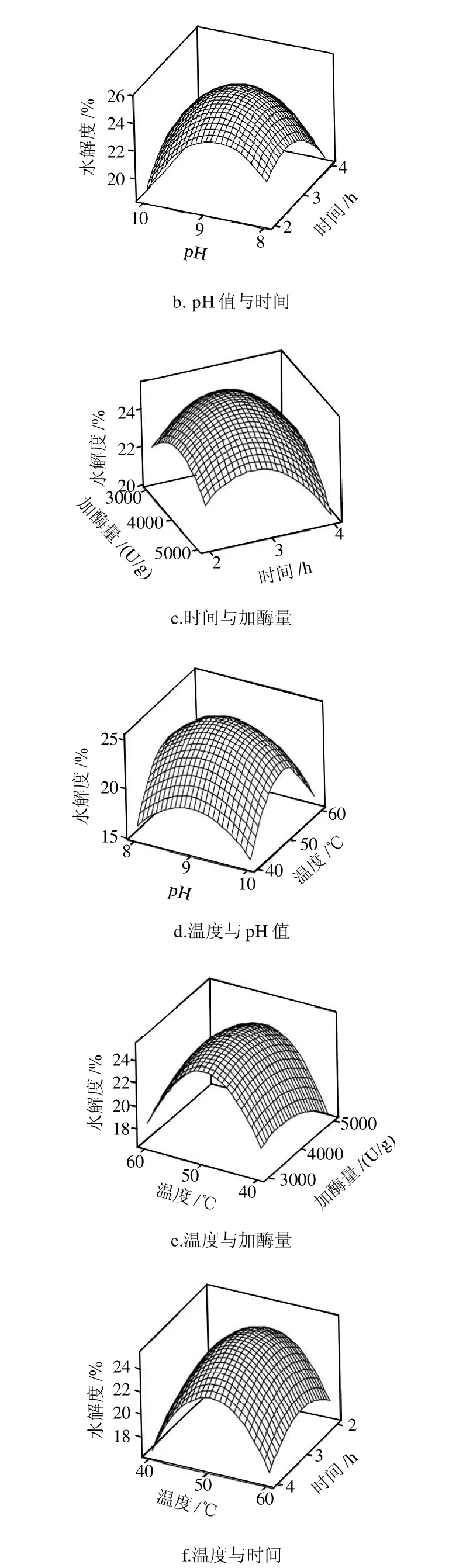
图5 各两因素交互作用对水解度影响的响应面图Fig.5 Response surface plots for the effects of the cross-interaction among factors on the degree of hydrolysis
由图5可知,响应面分析方法的图形是特定的响应面对应的因素加酶量、时间、pH值、温度构成三维空间。响应面分析图上可以看出4因素值选择合理,验证了实验的正确性。运用 Minitab 软件的响应优化器对试验结果进行优化,由二次多项回归方程来预测碱性蛋白酶酶解软枣猕猴桃蛋白多肽水解度最高的提取条件。经过软件分析得出最优条件为pH8.9、加酶量3868.7U/g、酶解温度50.3℃、酶解时间2.9h,该条件下软枣猕猴桃蛋白多肽的水解度的预测值为该条件下软枣猕猴桃蛋白多肽的水解度的预测值为25.12%。根据实际生产操作将预测条件优化为pH9、加酶量4000U/g、酶解温度50℃和酶解时间3h。
2.3 软枣猕猴桃蛋白多肽羟自由基清除能力
以羟自由基清除率为衡量指标,采用酶解的最优条件为加酶量4000U/g、pH9、酶解温度50℃,分别测定酶解1、2、3、4、5h时,软枣猕猴桃蛋白多肽的羟自由基清除率,结果见表5。
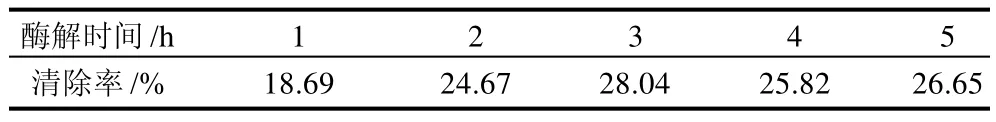
表5 羟自由基清除率Table 5 Hydroxyl radical-scavenging rates
由表5可见,羟自由基清除率随着酶解时间的增加而增大,当水解3h时清除率达到最高值,而继续酶解后清除率并没有依次增高,这种现象可能是因为具有较高的肽在接下来的反应中被水解。综合反应来看,随着水解时间的延长,羟自由基的清除率有所上升,这是由于具有抗氧化活性的肽分子质量一般较小[21]。在一定范围内水解时间越长,肽平均的分子质量就会越小,可能具有抗氧化活性的肽就越多,因此在实验中水解4、5h时出现了较高的清除率。但实验中发现酶解3h时得到软枣猕猴桃蛋白多肽的羟自由基清除率为28.04%,抑制率最高,同时水解度也达到了最高值25.08%。因此采用酶解3h作为制备抗氧化肽的最佳水解时间。
3 结 论
在水解软枣猕猴桃蛋白制备抗氧化肽的工艺中,pH值、加酶量、酶解温度、酶解时间对水解度均有一定影响。通过单因素试验及响应曲面分析方法,以水解度为衡量指标,确定了最优提取工艺参数pH9、酶解温度50℃、酶解时间3h、加酶量4000U/g,在此条件下将软枣猕猴桃蛋白分别水解1、2、3、4、5h得到肽混合物进行抗氧化活性分析,得到其对羟自由基的清除率分别为18.69%、24.67%、28.04%、25.82%、26.65%。因此选择3h作为水解制备抗氧化肽的时间,此时抗氧化肽的羟自由基清除率最高。
[1] 林志坚, 阮立为, 郭旭. 软枣称猴桃的化学成份及其综合利用[J]. 中国林副特产, 1995(2): 25-126.
[2] 王晓东, 段全猛. 软枣猕猴桃的利用与栽培[J]. 特种经济动植物, 2006(2): 50-56.
[3] 张兰杰, 辛广, 于连等. 软枣猕猴桃果中类SOD的提取与研究[J]. 食品科技, 2010, 35(6): 204-209.
[4] 黄岳, 朴一龙, 王琳. 长白山区野生软枣猕猴桃种质RAPD分析[J].延边大学农学学报, 2009, 31(2): 119-123.
[5] 王菲, 许金光, 刘长江. 软枣猕猴桃中的功能保健成分及其在食品加工中的应用[J]. 食品工业科技, 2010, 31(8): 421-423.
[6] 辛广, 张博, 冯帆, 等. 软枣猕猴桃果实香气成分分析[J]. 食品科学,2009, 30(4): 230-232.
[7] KITTS D D, WEILER K. Applications of bioprocesses used in isolation an recovery[J]. Current Pharmaceutical Design, 2003, 9(16): 1309-1323.
[8] RAO A, SHALLO H E, RERIESONAND A, et al. Characterization of soy protein concentrate produced by membrane ultrafiltration[J]. Journal of Food Science, 2002, 67(4):1412-1418.
[9] SYLVIC F G, YVES P, DIANC S. Immunomodulatory peptides obtained by the enzymatic hydrolysis of whey protein[J]. International Dairy Journal, 2006, 16(11): 1315-1323.
[10] ESTHER M, AMPARO A, REYES B, et a1. Casein phosphope tides released by simulated gastrvintestinal digestion of infant formulas and their potential role in mineral binding[J]. International Dairy Journal,2006, 16(9): 992-1000.
[11] 李珂, 杨秀华, 扈麟, 等. 响应曲面法骨胶原蛋白酶解条件的优化[J].食品科学, 2009, 30(7): 135-136.
[12] 刘立芳, 徐怀德. 中性蛋白酶酶解谷朊粉制备抗氧化多肽研究[J]. 西北农业学报, 2008, 17(6): 281-285.
[13] 宋晓燕, 高彦祥, 袁芳. 响应面法优化羊胎粉中抗氧化多肽制备工艺的研究[J]. 食品科技, 2008, 33(11): 237-238.
[14] 汪志慧, 孙智达, 谢笔钧. 响应曲面法优化双酶法提取莲房原花青素[J]. 食品科学, 2011, 32(4): 65-67.
[15] 茚三酮显色法测定氨基酸含量[EB/OL]. (2010-7-10) [2011-04-15].http://www.docin.com/p-63536472.htmL.
[16] 赵新淮, 冯志彪. 蛋白质水解物水解度测定的研究[J]. 食品科学,1994, 15(11): 65-67.
[17] 刘长江, 曹向宇, 刘剑利. 麦麸多肽的酶法制备及其特性研究[J]. 食品工业, 2009(1): 34-36.
[18] 杜国荣. 猕猴桃(Actinidia)、柿(Diospyros kakiL.)和苹果(Malus domesticaBorkh.)果实的抗氧化能力及其抗氧化活性成分的分析[D].杨凌: 西北农林科技大学, 2009.
[19] 陈美珍, 余杰, 郭慧敏. 大豆分离蛋白酶解物清除羟自由基作用的研究[J]. 食品科学, 2002, 23(1): 43-46.
[20] HALLIWELL B, GUTTERIDGE J M, ARUOMA O I. The deoxyribose method: a simple of “test-tube” assay for determination of rate constants for reaetions hydroxyl radieals[J]. Anal Biochem, 1987, 165(1): 215-219.
[21] 黄艳春, 刘张虎, 熊善柏. 酶解鲢肉制取 ACE 抑制肽工艺条件的优化[J]. 食品科学, 2007, 28(2): 181-184.
Optimization of Enzymatic Hydrolysis for Protein fromActinidia argutaSieb. et Zucc by Response Surface Methodology and Antioxidant Activity of Polypeptides
LIU Chang-jiang*,JIA Sha-sha,XU Jin-guang
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Taking hydroxyl radical-scavenging capacity of hydrolysates as the index, the optimal hydrolysis process for the protein fromActinidia argutaSieb. et Zucc by alkaline protease was explored by response surface methodology (RSM) to prepare antioxidant polypeptides. Meanwhile, the correlation between the degree of hydrolysis (DH) and the hydroxyl radical-scavenging capacity of polypeptides was examined. The results showed that the optimal hydrolysis parameters of alkaline protease enzyme were hydrolysis temperature of 50 ℃, hydrolysis pH of 9, enzyme addition amount of 4000 U/g, and hydrolysis time of 3 h. Under the optimal hydrolysis condition, the DH was up to 25.08%. In addition, the hydroxyl radical-scavenging rates of the hydrolysis products from the protein ofActinidia argutasubjected to hydrolysis for 1, 2, 3, 4 h and 5 h at the optimal hydrolysis conditions were 8.69%, 24.67%, 28.04%, 25.82% and 26.65%. The product achieved at 3 h hydrolysis revealed the strongest hydroxyl radical-scavenging rate.
Actinidia argutaSieb. et Zucc;anti-oxidant peptides;hydrolysis degree;clearance rate
TS255.36
A
1002-6630(2012)10-0033-06
2011-05-17
国家公益性行业(农业)科研专项(200903013)
刘长江(1955—),男,教授,博士,研究方向为食品生物技术。E-mail:liucj597@sohu.com

