茶叶籽中总黄酮的提取及结构的初步鉴定
王华清,李起弘,郑铁松
(南京师范大学金陵女子学院食品科学与营养系,江苏南京210097)
茶叶籽中总黄酮的提取及结构的初步鉴定
王华清,李起弘,郑铁松*
(南京师范大学金陵女子学院食品科学与营养系,江苏南京210097)
研究茶叶籽中总黄酮的提取工艺,在单因素实验基础上,选取液料比、提取温度和乙醇体积分数3个影响因素,以总黄酮含量为评价指标,通过Box-Benhnken的中心组合设计原理和响应面分析法优化提取工艺,确定最佳提取条件为:液料比26∶1(mL∶g),乙醇体积分数58%,提取温度82℃,提取时间2h,茶叶籽中总黄酮含量为11.174mg/g。通过颜色反应和紫外光谱特征,初步鉴定茶叶籽黄酮为二氢黄酮类化合物。
茶叶籽,总黄酮,提取,鉴定
1 材料与方法
1.1 材料与仪器
茶叶籽 储叶种,购于溧水县健茗茶厂;芦丁标准品 上海源叶生物科技有限公司;亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、三氯化铝、醋酸镁、四氢硼钠、甲醇等 均为分析纯。
微型旋涡混合仪AM3250B 上海沪西分析仪器有限公司;数显恒温水浴锅HH-6 金坛市富华仪器有限公司;可见分光光度计722 上海精密科学仪器有限公司;低速离心机LD5-10 北京医用离心机厂;紫外/可见/近红外分光光度计Cary5000型 美国Varian公司。
1.2 实验方法
1.2.1 总黄酮含量测定 总黄酮含量测定采用硝酸铝络合分光光度法[17]。标准曲线的制作以芦丁为标准品,测定波长为510nm,以60%的乙醇溶液作为空白,以芦丁浓度(mg/mL)为横坐标,相应的吸光度值为纵坐标制作标准曲线,得线性回归方程:y=11.3171x-0.0059,R2=0.9995,结果表明线性关系良好。
茶叶籽提取液中总黄酮含量的操作同标准曲线的制作,测定其吸光值并将结果带入上述回归方程,计算出提取液中总黄酮含量。
茶叶籽中总黄酮含量(mg/g)=(提取液的总黄酮浓度×提取液稀释倍数×定容体积)/茶叶籽质量
1.2.2 单因素实验 将茶叶籽剥去青苞、外壳,经烘干粉碎后过40目筛得茶叶籽粉,取2.0000g茶叶籽粉置于250mL圆底烧瓶中,在水浴锅中以乙醇回流浸提,提取物过滤,取上清液测定总黄酮含量。选取乙醇体积分数、提取时间、提取温度、液料比4个因素,进行单因素实验。
1.2.2.1 乙醇体积分数对茶叶籽总黄酮提取的影响 在温度70℃,提取时间1.5h,液料比20∶1(mL∶g)的条件下,按50%、60%、70%、80%、90%、100%的乙醇体积分数进行实验。
1.2.2.2 提取时间对茶叶籽总黄酮提取的影响 在温度70℃,乙醇体积分数60%,液料比20∶1(mL∶g)的条件下,以0.5、1、1.5、2、2.5、3、3.5、4h的提取时间进行实验。
1.2.2.3 液料比对茶叶籽总黄酮提取的影响 在温度70℃,乙醇体积分数60%,提取时间1.5h的条件下,以5∶1、10∶1、15∶1、20∶1、25∶1、30∶1、35∶1的液料比(mL∶g)进行实验。
1.2.2.4 提取温度对茶叶籽总黄酮提取的影响 在乙醇体积分数60%,提取时间1.5h,液料比20∶1(mL∶g)的条件下,以50、60、70、80、90℃的温度进行实验。
1.2.3 响应面实验设计 根据Box-Benhnken的中心组合实验设计原理,综合单因素实验结果,选取液料比、乙醇体积分数、提取温度3个因素,在单因素实验的基础上采用三因素三水平的响应面分析方法进行实验设计,各实验组的编码与取值见表1。
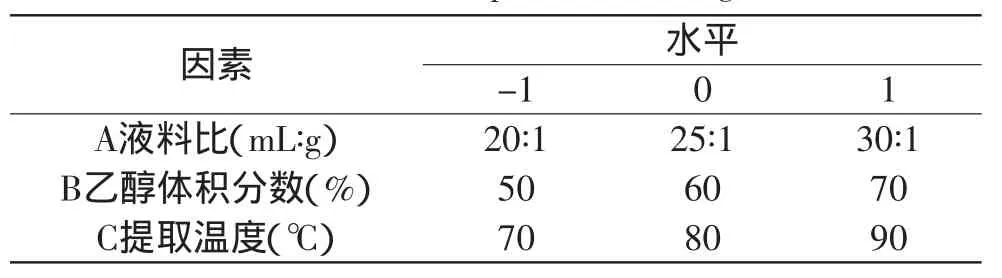
表1 因素水平编码表Table 1 Variables and levels in the three-factor,three-level Box-Behnken experimental design
1.2.4 结构鉴定
1.2.4.1 颜色反应 盐酸-镁粉/锌粉反应:取提取液的乙醇溶液1mL,分别加入少量镁粉和锌粉,然后加浓盐酸4~5滴,观察颜色变化。三氯化铝反应:取提取液的乙醇溶液5mL,加入5mL1%的三氯化铝溶液,观察颜色变化。四氢硼钠反应:取提取液的乙醇溶液2mL,加入等量2%的NaBH4的甲醇液,1min后加浓硫酸数滴观察颜色变化。氢氧化钠反应:取提取液的乙醇溶液5mL,加入1mol/L的氢氧化钠5mL,观察颜色变化。醋酸镁反应:用毛细管在滤纸上点2~3滴提取液,喷以1%的醋酸镁甲醇溶液,加热干燥,在紫外灯下观察。浓硫酸反应:取提取液的乙醇溶液5mL,加入5滴浓硫酸,观察颜色变化。
1.2.4.2 紫外光谱鉴定 取2~3mL提取液溶于甲醇中,以甲醇作参比,在波长200~500nm范围内扫描,保存图谱,加6滴三氯化铝试液,混匀后立即在相同波长范围内扫描,保存图谱。试液中再加入3滴盐酸,并立即在相同波长范围内扫描,保存图谱。
2 结果与讨论
2.1 单因素实验结果
2.1.1 乙醇体积分数对茶叶籽总黄酮提取的影响 由图1可知,在乙醇体积分数增大到60%时,提取液中茶叶籽总黄酮含量最大,当乙醇体积分数超过60%以后,总黄酮含量则逐渐减小,可能是因为黄酮类化合物溶出量减少,同时脂溶性杂质也大量增加,导致黄酮类物质含量降低[18],所以乙醇体积分数以60%为宜。
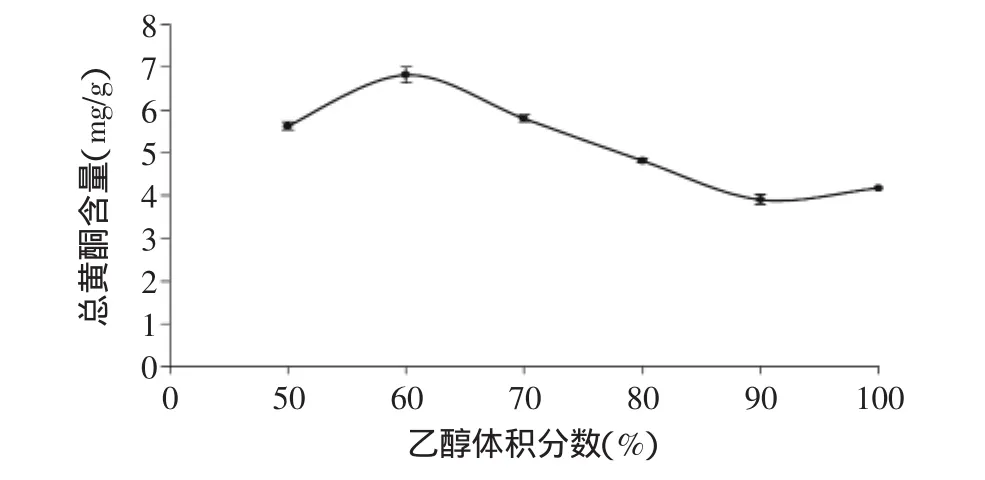
图1 乙醇体积分数对总黄酮提取的影响(n=6)Fig.1 Effect of ethanol concentration on the extraction of total flavonoids(n=6)
2.1.2 提取时间对茶叶籽总黄酮提取的影响 由图2可知,随着提取时间延长,提取液中总黄酮含量逐渐增加,直至一定时间(2h)后,总黄酮含量达到最大,2h以后黄酮含量基本保持平衡,表明黄酮类物质在2h时已大部分溶出,提取基本完成,而3.5h后总黄酮含量大幅下降可能是由于部分黄酮类化合物受热时间过长被氧化[19],而且提取时间越长,能耗越大,所以选取最佳提取时间为2h。
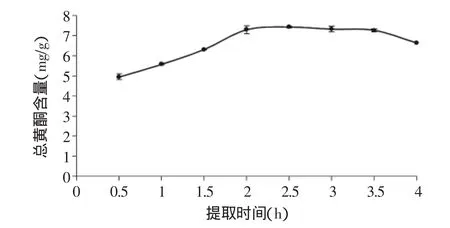
图2 提取时间对总黄酮提取的影响(n=6)Fig.2 Effect of extraction time on the extraction of total flavonoids(n=6)
2.1.3 液料比对茶叶籽总黄酮提取的影响 由图3可知,随着液料比的增大,提取液中总黄酮含量也逐渐增大,但液料比达到25∶1后总黄酮含量逐渐下降。这是由于液料比的增加,加速了溶剂的传质过程,有助于黄酮类物质的溶出[20],但当液料比增大到一定程度时,溶剂对黄酮的浸出达到平衡状态,再增加液料比会使杂质大量溶出而不利于黄酮的提取[21]。综合考虑,液料比以控制在25∶1(mL∶g)为宜。
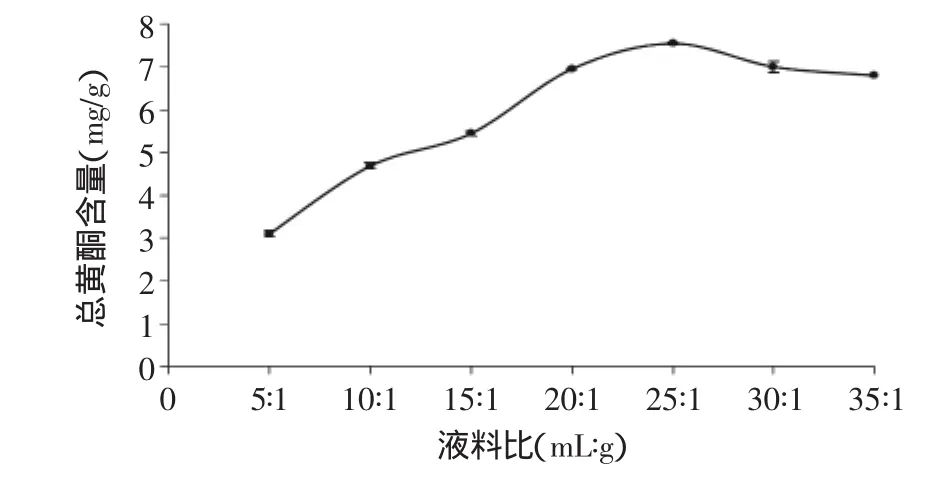
图3 液料比对总黄酮提取的影响(n=6)Fig.3 Effect of liquid/solid ratio on the extraction of total flavonoids(n=6)
2.1.4 提取温度对茶叶籽总黄酮提取的影响 由图4可知,随温度的逐渐升高,提取液中总黄酮含量不断增加,在80℃前增加较为明显,这是由于温度升高,分子运动速度加快,渗透、扩散、溶解速度加快,使黄酮类化合物更易从茶叶籽转移到溶剂中,因此,总黄酮含量随提取温度的升高而增大。当温度高于80℃时,总黄酮含量呈减小趋势,这可能由于部分黄酮类物质被氧化破坏或者分解[22],同时造成乙醇的大量挥发,影响提取效果。所以综合考虑,提取温度在80℃为宜。
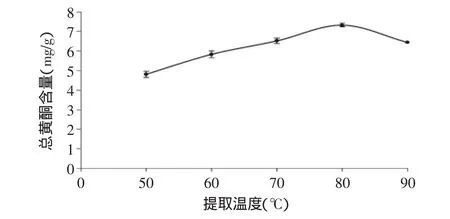
图4 提取温度对总黄酮提取的影响(n=6)Fig.4 Effect of extraction temperature on the extraction of total flavonoids(n=6)
2.2 响应面法提取条件的优化
2.2.1 响应面实验设计及结果 实验设计及结果见表2。使用Design Expert7.1.3软件,以液料比、乙醇体积分数、提取温度为响应变量,以总黄酮含量为响应值(指标值)对表2的数据进行处理,得到表3回归方程方差分析表,利用软件进行非线性回归的二次多项式拟合,得到预测模型如下:
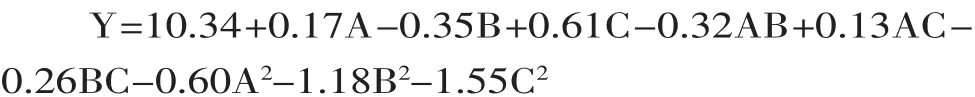
由表3可以看出,该模型效应达到极显著水平(P<0.0001),说明该模型是可靠的;该回归模型的总决定系数R2=0.9895,说明该模型能解释98.95%响应值的变化;调整决定系数R2Adj=0.9796,说明可信度较好;失拟项为0.7991,不显著,说明该模型的拟合程度较好,实验误差小,可以用此模型对茶叶籽总黄酮的提取进行分析预测。
各个因素对总黄酮提取的影响程度大小的次序为提取温度>乙醇体积分数>液料比,其中提取温度对总黄酮提取影响达到极显著水平(P<0.0001)。同时,由表3可以看出,方程二次项影响是最为显著的,一次项影响较为显著,交互项影响相对不显著,说明响应值的变化相对复杂。
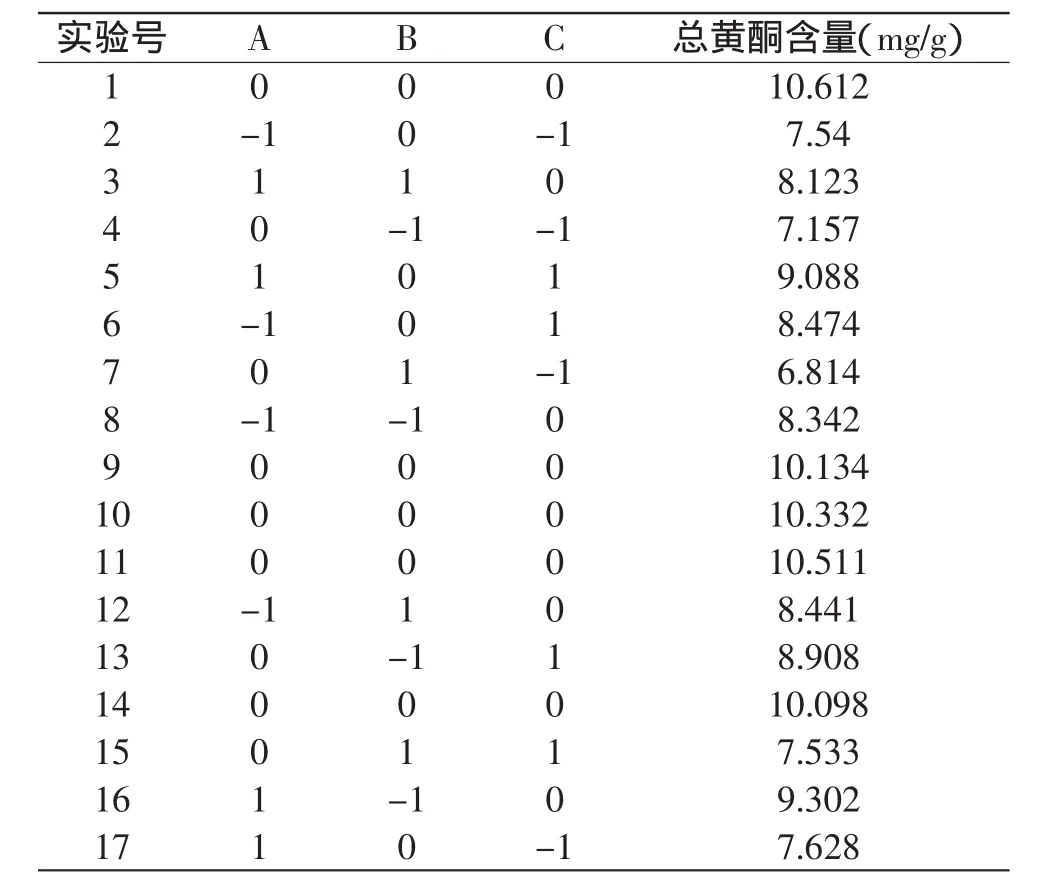
表2 Box-Behnken实验设计及结果(n=6)Table 2 Arrangement and results of the three-factor,threelevel Box-Behnken experimental design(n=6)
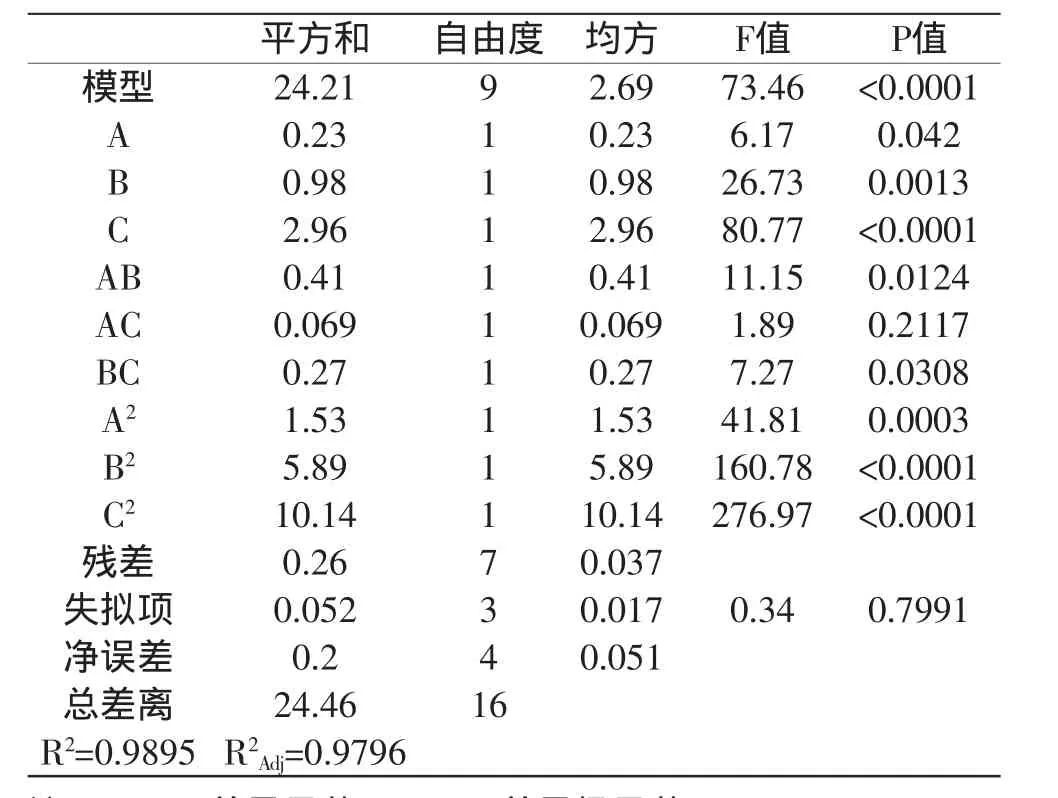
表3 回归方程方差分析表Table 3 Analysis of variance for the regression equation
根据回归方程,可以做出响应面分析图(图5~图7),通过该组图可以直观地看出三个因素之间交互作用对总黄酮提取的影响,并从中确定最佳因素水平范围。由图中等高线可以看出,液料比和乙醇体积分数交互作用最为显著,表现为等高线呈椭圆形,而乙醇体积分数和温度的交互作用次之,液料比和提取温度的交互作用较小,这与方差分析的结果相一致。另外,由图可知该模型在实验范围内存在稳定点,且稳定点是最大值[24]。
2.2.2 最佳工艺参数的验证 根据Box-Behnken实验所得的结果和二次多项回归方程,利用Design Expert7.1.3软件获得了提取的最佳条件为:液料比26.08∶1(mL∶g),乙醇体积分数57.98%,提取温度82.22℃,在此条件下总黄酮提取2h的理论值为10.458mg/g。为检验响应面分析法所得结果的可靠性,在上述条件下进行验证实验,考虑实际情况选取液料比26∶1(mL∶g)、乙醇体积分数58%、提取温度82℃,提取时间2h,测得的总黄酮平均含量为11.174mg/g,与理论预测值较为一致,证明该模型预测可靠。
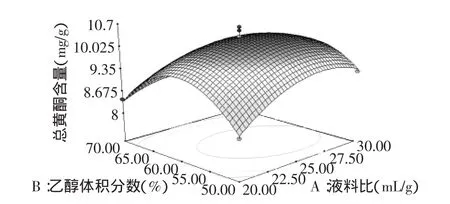
图5 液料比和乙醇体积分数对总黄酮提取的响应面图Fig.5 Response surface plot for effects of liquid/solid ratio and ethanol concentration on the extraction of total flavonoids
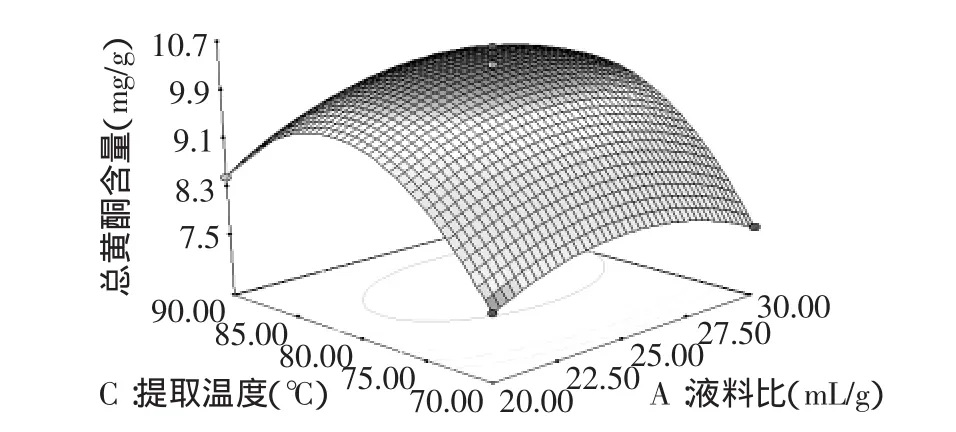
图6 液料比和温度对总黄酮提取的响应面图Fig.6 Response surface plot and for effects of liquid/solid ratio and extraction temperature on the extraction of total flavonoids
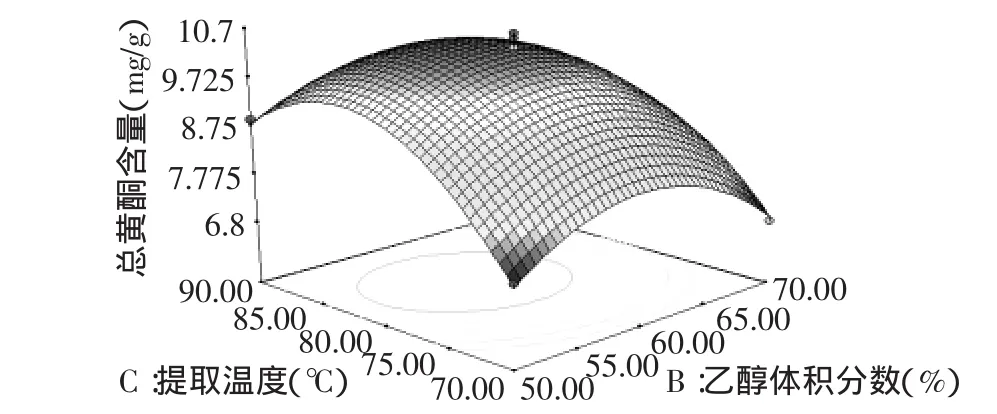
图7 乙醇体积分数和温度对总黄酮提取的响应面图Fig.7 Response surface plot for effects of ethanol concentration and extraction temperature on the extraction of total flavonoids
2.3 提取物中主要成分的结构鉴定
2.3.1 颜色反应 从表4可以看出,镁粉反应显紫色,锌粉反应显紫红色,表明提取物中可能含黄酮醇或者二氢黄酮类化合物;三氯化铝反应由浅黄色变为亮黄色,表明提取物中有黄酮类化合物;NaBH4是对二氢黄酮类化合物专属性较高的一种诊断剂,与二氢黄酮类化合物产生红-紫色,其他黄酮类均不显色[25],提取物与NaBH4反应显紫色,表明提取物中含有二氢黄酮类化合物;氢氧化钠反应显橙黄色,表明提取物中有黄酮类化合物;二氢黄酮、二氢黄酮醇类与醋酸镁反应显天蓝色荧光,而黄酮、黄酮醇及异黄酮类则显黄-橙黄-褐色[26],提取物与醋酸镁反应后在紫外灯下显蓝色荧光,表明提取物中含有二氢黄酮(醇)类化合物。
通过以上颜色反应,可以初步推断茶叶籽黄酮为二氢黄酮(醇)类化合物。
2.3.2 紫外光谱鉴定 从茶叶籽黄酮的紫外光谱图(图8)中可以看出,茶叶籽黄酮在甲醇中的吸收峰带Ⅱ在281nm处,带Ⅰ很弱,在328nm处,与黄酮类化合物甲醇溶液的UV光谱对照,确定茶叶籽黄酮为二氢黄酮(醇)类,与颜色反应结果一致。诊断剂AlCl3使带Ⅱ红移23nm,表明茶叶籽黄酮为含有5-OH的二氢黄酮(醇)类[25],而带Ⅰ红移50nm,表明茶叶籽黄酮分子结构中只有5-OH,无3-OH[26],故可将二氢黄酮醇类排除。诊断剂AlCl3/HCl谱图与AlCl3谱图基本相同,表明茶叶籽黄酮分子中无邻二酚羟基结构。
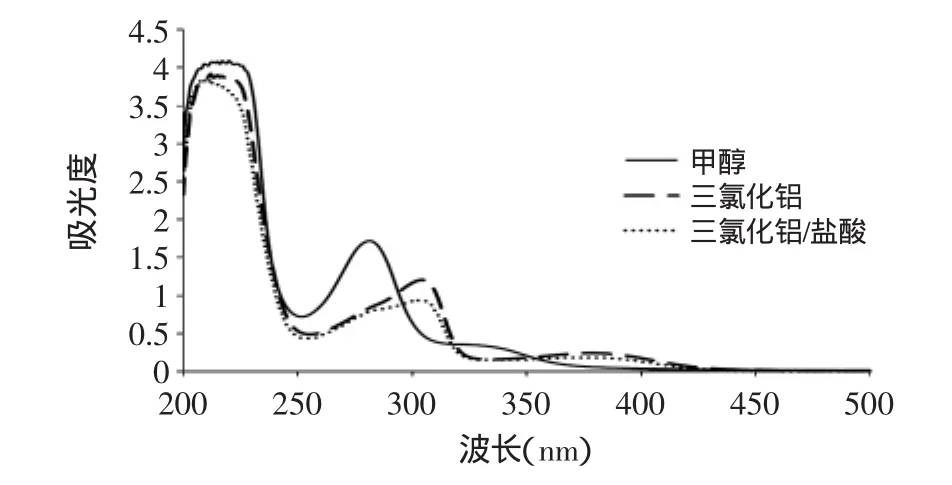
图8 茶叶籽黄酮的紫外光谱特征图Fig.8 Ultra-Violet spectrometry of flavonoids in tea seed
综合紫外光谱鉴定和颜色反应的结果,可初步鉴定茶叶籽中黄酮为含有5-OH的二氢黄酮类化合物,且其分子中无邻二酚羟基结构。
3 结论
对茶叶籽中的黄酮类化合物进行提取,在单因素实验的基础上,通过Box-Behnken的中心组合设计原理以及响应面分析法对提取工艺进行优化,拟合了液料比、乙醇体积分数、提取温度这3个因素对总黄酮提取的回归模型,经检验证明该模型合理可靠,能较好地预测茶叶籽中黄酮类化合物的提取。由该模型确定的最优工艺条件为:液料比26∶1(mL∶g)、乙醇体积分数58%、提取温度82℃,提取时间2h,测得的总黄酮平均含量为11.174mg/g。通过颜色反应和紫外光谱特征,初步鉴定茶叶籽黄酮为含有5-OH的二氢黄酮类化合物,且其分子中无邻二酚羟基结构。

表4 颜色反应结果Table 4 Results of color reaction
[1]曹国锋,邬冰,钟守贤.茶叶籽油、油茶籽油与茶树油的区别[J].中国油脂,2008,33(8):17-20.
[2]恽卓婷,廖鲜艳,翁新楚.茶叶籽油与油茶籽油理化性质及脂肪酸组成比较[J].食品工业科技,2011,32(6):136-138.
[3]马跃青,张正竹.茶叶籽综合利用研究进展[J].中国油脂,2010,35(9):66-68.
[4]郭艳红.从茶籽中提取茶籽油、茶皂素和茶籽多糖研究[D].上海:上海师范大学,2009.
[5]Toshio Morikawa,Ning Li,Akifumi Nagatomo,et al.Triterpene Saponins with Gastroprotective effects from tea seed(the seeds of Camellia sinensis)[J].Journal of Natural Products,2006,69(2):185-190.
[6]喻祖文.茶多酚几种不同提取方式的比较[J].中医药导报,2010,16(12):94-95.
[7]Jun Seong Park,Ho Sik Rho,Duck Hee Kim,et al.Enzymatic preparation of kaempferol from green tea seed and its antioxidant activity[J].Journal of Agricultural and Food Chemistry,2006,54:2951-2956.
[8]孟维,李湘洲,吴志平,等.茶籽油提取工艺的实验研究[J].食品科技,2010,35(4):153-155.
[9]郭华,周建平,何伟,等.茶籽油精炼过程中理化指标的变化及精炼条件选择[J].食品工业科技,2009,30(6):221-225.
[10]余江林,陈玉琼,陈永波,等.茶籽中茶皂素的提取工艺研究[J].食品工业科技,2007,28(1):171-172.
[11]江和源,柯昌强,王川丕,等.茶籽饼粕中黄酮苷的HPLC分析、制备与MS鉴定[J].茶叶科学,2005,25(4):289-294.
[12]张培成.黄酮化学[M].北京:化学工业出版社,2008:1.
[13]杨瑞云,管海波,张革,等.当归藤中总黄酮提取工艺研究[J].食品工业科技,2011,32(4):217-219.
[14]唐浩国.黄酮类化合物研究[M].北京:科学出版社,2009:1.
[15]Zhong Kui,Wang Qiang.Optimization of ultrasonic extraction of polysaccharides from dried longan pulp using response surface methodology[J].Carbohydrate Polymers,2010,80(1):19-25.
[16]王明艳,张小杰,王涛,等.响应面法优化香椿叶多糖的提取条件[J].食品科学,2010,31(4):106-110.
[17]李敏,杨建华,李渊,等.酒花黄酮提取工艺和含量测定[J].食品科学,2011,32(6):16-19.
[18]刘飞,王鸿飞,林燕,等.费菜总黄酮提取工艺的研究[J].食品工业科技,2011,32(4):252-257.
[19]吕丽爽.何首乌中二苯乙烯苷的制备及抗氧化机理研究[D].无锡:江南大学,2006.
[20]谢捷,李红娟,朱兴一,等.响应面法优化闪式提取牛蒡苷的工艺优化[J].食品科学,2010,31(24):33-36.
[21]赵佳,霍俊伟.蓝果忍冬总黄酮提取工艺研究[J].食品工业科技,2010,31(11):242-244.
[22]王倩,常丽新,贾长虹,等.狗枣猕猴桃叶黄酮提取工艺的研究[J].食品工业科技,2011,32(5):235-237.
[24]C F Jeff Wu,Michael Hamada.张润楚,郑海涛,兰燕,等译.实验设计与分析及参数优化[M].北京:中国统计出版社,2000:341-382.
[25]中科院上海药物研究所.黄酮体化合物鉴定手册[M].北京:科学出版社,1981:391-523.
[26]吴立军.天然药物化学[M].北京:人民卫生出版社,2003:182-194.
Study on extraction conditions and structure identification of total flavonoids in tea(Camellia Sinensis)seed
WANG Hua-qing,LI Qi-hong,ZHENG Tie-song*
(Department of Food Science and Nutrition,Ginling College,Nanjing Normal University,Nanjing 210097,China)
Extraction conditions of total flavonoids in tea seed were researched.Based on the results of single factor experiments,the effect of liquid/material ratio,ethanol concentration,extraction temperature on the extraction yield of total flavonoids was explored to optimize the extraction conditions through central composite design and response surface methodology(RSM).The optimum extraction conditions were determined as follows:liquid/material ratio 26∶1(mL∶g),ethanol concentration 58%,extraction temperature 82℃and extraction duration of 2h.Under the optimized conditions,the extraction yield of total flavonoids in tea seed was 11.174mg/g.The structure of flavonoids in tea seed which was determined by means of color reaction and UV spectrum was flavanones.
tea seed;total flavonoids;extraction;identification
TS201.1
B
1002-0306(2012)07-0282-05
茶叶籽是山茶属植物茶(Camellia sinensis(L.)O. Kuntze,Theaceae)即茶树的果实,为茶叶生产的副产物[1-2]。我国是茶叶之乡,茶叶籽资源十分丰富,年产量约80余万吨[3]。茶叶籽中富含茶多糖[4]、茶皂素[5]、茶多酚[6]、黄酮类等化合物[7],有巨大的开发潜力。但是长期以来,除少量用来提取茶叶籽油外,大部分茶叶籽都被废弃。目前,国内外对茶叶籽的研究主要集中在茶叶籽油的提取精炼[8-9]及茶皂素的提取上[10],而对黄酮类化合物的研究较少[11]。黄酮类化合物是在植物中广泛分布的一类重要的多酚类天然产物[12],具有抗心脑血管病、抗氧化、抗病毒、抗菌、抗肿瘤、降血脂等功效[13-14]。响应面法(response surface methodology,RSM)是利用合理的实验设计方案,采用多元二次回归方程拟合各因素与响应值之间的函数关系,通过对回归方程的分析来优化工艺参数,解决多变量问题的一种统计方法[15-16]。本研究拟在单因素研究的基础上,通过Box-Behnken的中心组合设计原理和响应面分析法对茶叶籽中的总黄酮提取进行参数优化,以确定最佳提取工艺,并对茶叶籽中总黄酮的结构进行初步鉴定,为进一步开发利用茶叶籽提供理论依据。
2011-07-22 *通讯联系人
王华清(1986-),男,硕士,主要从事食品生物化学研究。

