2,4-D和6-BA对高羊茅愈伤组织诱导的影响
,
(湖南农业大学农学院,长沙 410128)
2012-10-16
武羿君(1988—),女,内蒙古呼和浩特人。*通讯作者,Email:huxu0309@yahoo.com.cn。
湖南农业大学大学生研究性学习和创新性实验计划项目(XCX1019);中国科学院植物种质创新与特色农业重点实验室开放课题(Y052811t04);湖南省教育厅项目(KC2011B023)。
2,4-D和6-BA对高羊茅愈伤组织诱导的影响
武羿君,徐庆国*
(湖南农业大学农学院,长沙 410128)
以高羊茅成熟种子为外植体,采用MS 基本培养基,研究了不同浓度的2,4-D和6-BA对其愈伤组织诱导的影响。结果表明:不同浓度2,4-D对高羊茅愈伤组织诱导率差异显著,以9 mg/ L效果最好,浓度过高,愈伤组织诱导率下降;在0~0.8 mg/ L范围内,高羊茅愈伤组织诱导率随6-BA 浓度的增加而增大,当浓度为0.6 mg/L时诱导效果最好。
高羊茅;组织培养;愈伤组织;2,4-二氯苯氧乙酸;6-苄氨基嘌呤
高羊茅又称苇状羊茅,禾本科羊茅属,原产欧洲西部,具有较高的营养价值,是温带地区建立人工草地和补播天然草场的重要草种[1]。高羊茅属多年生冷季型草种,具有抗干旱、耐瘠薄、抗病性强、耐粗放管理、适应性广及绿期长、观赏性高等特点,因此,广泛应用于世界各国的绿地建设和水土保持等各类草坪中[2]。高羊茅作为一种重要草种,不仅广泛应用于内蒙古、新疆、甘肃、黑龙江等我国北方省市的牧场草地和绿化草坪建植中,在我国南方草坪过渡性地带的常绿草坪建植中也发挥着重大作用,是我国目前较为常用的冷季型草坪草种之一[3~5]。
国外发达国家对草坪草育种的研究历史较长,早已开展了对高羊茅的转基因研究,并获得了转基因工程植株,实现了对高羊茅性状的定向改良[6]。国内对草坪草植株再生体系的研究开展较晚,直到20世纪90年代随着草坪业的快速发展才得以起步研究。与其他重要的禾本科作物相比,国内关于高羊茅的组织培养研究远远落后,而成功建立高羊茅再生植株的报道更为少见[7]。国内虽然也对高羊茅的组织培养和转基因进行了一些研究,但其研究深度和广度还远远不够。一般认为愈伤组织是转基因的理想受体,要对草坪草进行遗传转化,首先要建立其愈伤组织再生体系,而愈伤组织的诱导是建立再生体系的前提和基础[8~10]。国内对高羊茅愈伤组织的诱导曾有不少研究,认为不同浓度的2,4-D和6-BA对高羊茅愈伤组织诱导有重要影响,对高羊茅再生体系的建立和转基因育种具有十分重要的意义。本研究选取不同品种高羊茅成熟种子为外植体,研究不同浓度的2,4-D和6-BA对高羊茅愈伤组织诱导的影响,试图找到能产生高羊茅愈伤组织高出愈率的2,4-D和6-BA最佳浓度,建立适宜的高羊茅再生体系,为高羊茅的转基因育种建立基础和提供理论依据。
1 材料与方法
1.1 供试高羊茅品种
北京百绿(天津)国际草业有限公提供的3个高羊茅(Festucaarundinacea)品种:交战Ⅱ(Crossfire Ⅱ)、贝克(Baker)、猎狗(Hound)。
1.2 外植体处理方法
分别取各供试高羊茅品种成熟种子,在50 %的硫酸中浸泡30 min,脱去颖壳后用清水洗净,去掉杂质,再用清水浸泡12 h,清水冲洗后置于4℃环境下备用。
1.3 试验方法
按MS配方配置MS培养基作为本研究的基本培养基。在MS基本培养基中分别加入不同浓度的6-BA和2,4-D,各种处理培养基pH值均调至5.8,分别设置如下2种不同激素浓度的单因素试验。
(1)在MS培养基中分别加入不同浓度的2,4-D,作为高羊茅愈伤组织的诱导培养基。2,4-D 浓度分别为0、3、6、9和12 mg/L,以未加2,4-D的MS培养基为对照。每种处理分别接种30粒不同高羊茅品种种子,每个培养基组合设置3个重复,共计5组,每组9个处理。
(2)在MS培养基中分别加入不同浓度的6-BA,作为3个高羊茅品种愈伤组织的诱导培养基。6-BA浓度分别为0、0.2、0.4、0.6和0.8 mg/L,以未加6-BA的MS培养基为对照。每种处理分别接种30粒不同高羊茅品种种子,每个培养基组合设置3个重复,共计5组,每组9个处理。
1.4 接种
在超净工作台上,将已经过处理的高羊茅种子分别用70%的酒精消毒30~40 s, 用无菌水冲洗3~5次,再用0.1%升汞(氯化汞)溶液处理3~4 min后用无菌水冲洗4~5次。将经过消毒处理的3个不同高羊茅品种的种子接种到不同培养基组合,置于25~26℃,暗培养条件下进行愈伤组织诱导培养。
1.5 愈伤组织观察及记录
不同品种的高羊茅种子接种7 d后开始统计不同处理组合的发芽率、出愈率,每隔5 d统计1次。按如下公式统计各处理的发芽率、出愈率:
发芽率(%)=发芽种子数/接种数×100
出愈率(%)=不再变化后愈伤数/接种数×100
1.6 数据统计与分析
本研究所有统计分析工作采用Excel统计分析软件进行。
2 结果与分析
2.1 不同2,4-D浓度对高羊茅愈伤组织诱导的影响
由表1可知,不同浓度的2,4-D对高羊茅的发芽率影响不显著,且高羊茅的发芽率对其愈伤组织的出愈率影响也不明显。最终发芽率的统计结果表明,不同高羊茅品种的发芽率与2,4-D的浓度不存在显著相关,与其出愈率的相关也未达显著水平。
不同2,4-D浓度培养基接种的高羊茅种子在暗培养7 d后,大部分种子在芽鞘和种子连接处产生了白色水浸状、柔软松散的物质;在连续培养20 d后,愈伤组织的颜色由白色透明转变为半透明淡黄色。40 d后统计不同处理的愈伤组织诱导结果,表明不同浓度的2,4-D对高羊茅愈伤组织的诱导率影响不同。在5种2,4-D处理浓度中,处理浓度为9 mg/L的出愈率为43%,极显著高于其他处理浓度的出愈率;2,4-D浓度为6 mg/L的出愈率极显著高于浓度为3 mg/L和12 mg/L的出愈率(表1)。由此可知,在一定的浓度范围内,2,4-D能够提高高羊茅愈伤组织的出愈率,但浓度过高反而会降低高羊茅愈伤组织的出愈率,其中以添加2,4-D 9 mg/L的MS培养基对高羊茅成熟种子的愈伤组织诱导效果最好。

表1 不同2,4-D浓度处理的高羊茅种子发芽率与出愈率
注:表中同列数据不同小写字母表示α= 0. 05 水平上差异显著,不同大写字母表示α= 0. 01 水平上差异极显著。下同。
2.2 不同6-BA浓度对高羊茅愈伤组织诱导的影响
经过消毒处理的高羊茅种子在配有不同浓度6-BA的培养基上暗培养7 d后,开始发芽。由表2可以看出,不同浓度的6-BA对高羊茅的发芽率影响不明显,并且高羊茅的发芽率对其愈伤组织诱导的影响差异也未达显著水平。最终统计结果表明,高羊茅的发芽率与6-BA的浓度和出愈率均未达显著水平的相关。
不同6-BA浓度培养基接种的高羊茅外植体暗培养7 d后,大部分高羊茅种子在芽鞘和种子连接处产生了白色水浸状、柔软松散的物质;20 d后开始出现淡黄色的愈伤组织。40 d后统计不同处理的愈伤组织诱导结果,不同浓度的6-BA处理,其高羊茅愈伤组织的诱导率不同。在5种6-BA处理浓度中,浓度0.8 mg/L的出愈率为23.3%,极显著高于其他处理浓度的出愈率;浓度为0.6 mg/L的出愈率极显著高于浓度为0.2 mg/L和0.4 mg/L的出愈率(表2)。由此说明,当6-BA在一定范围浓度内,随着6-BA浓度的增加,高羊茅愈伤组织的诱导率也随之增加。

表2 不同6-BA浓度的高羊茅种子发芽率与出愈率
3.3 不同高羊茅品种对愈伤组织诱导的影响
从表3和表4可知,不同高羊茅品种在不同2,4-D浓度和不同6-BA培养基接种后的发芽率差异均未达显著水平。以猎狗5号的发芽率最高,但其出愈率却不是最高的,由此表明高羊茅品种的发芽率与其出愈率不存在显著相关,但是,不同高羊茅品种对其愈伤组织的诱导率存在明显基因型差异。由表3可知,不同高羊茅品种种子在2,4-D培养基中的愈伤组织的诱导率不同,交战Ⅱ的出愈率为28.4%,极显著高于其他2个高羊茅品种;而猎狗5号和贝克的出愈率差异未达显著水平。

表3 不同高羊茅品种在2,4-D培养基中的平均发芽率与出愈率
从表4可以看出,不同高羊茅品种种子在6-BA培养基中的愈伤组织的诱导率不同,猎狗5号的愈伤组织出愈率为16%,极显著高于其他2个高羊茅品种。同一高羊茅品种种子在不同激素作用下的出愈率不同。如贝克在不同浓度2,4-D和不同浓度6-BA培养基接种后的发芽率几乎没有变化,但其平均出愈率却相差12.5个百分点。
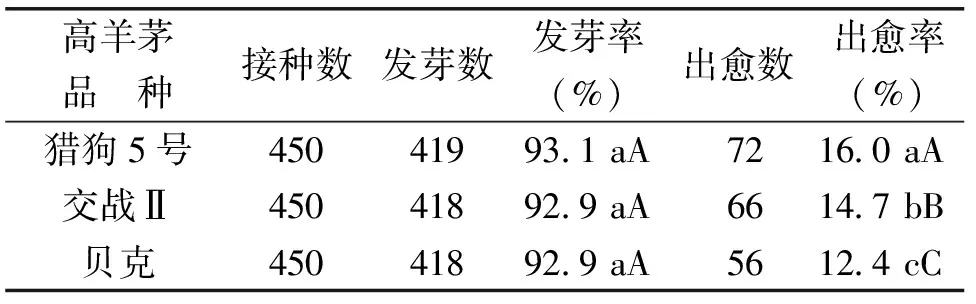
表4 不同高羊茅品种在6-BA培养基中的平均发芽率与出愈率
3 讨论
3.1 不同2,4-D和6-BA浓度对高羊茅愈伤组织诱导的影响
本研究采用猎狗、交战Ⅱ和贝克等3个高羊茅品种的成熟种子为外植体,进行了不同浓度2,4-D和不同浓度6-BA培养基的高羊茅愈伤组织诱导研究。结果表明,植物生长素2,4-D对该3个高羊茅品种愈伤组织的诱导有明显的促进作用。当2,4-D浓度在0~9 mg/L范围内,随着2,4-D浓度的增加,其愈伤组织的诱导率升高;但当2,4-D浓度增高到一定程度(9 mg/L)后,其诱导率呈下降趋势。郎春秀等[3]研究发现,2,4-D对高羊茅愈伤组织诱导的最佳浓度为8 mg/L,而高丽美等[11]试验结果显示,2,4-D诱导高羊茅成熟种子的最佳浓度是9 mg/L,这与本试验研究的结果基本吻合。
本研究表明,当6-BA浓度在0~0.8 mg/L范围内,随着6-BA浓度的增加,高羊茅愈伤组织的诱导率也随之有升高的趋势;当6-BA浓度增加到0.8 mg/L时,虽然高羊茅的愈伤组织诱导率升高,但其长势却变差,愈伤组织不透明、硬实,生长缓慢,最后转变为暗黄色,利用价值低。本研究只研究了一定浓度6-BA对不同高羊茅品种愈伤组织诱导率的影响,今后还可以在此基础上继续研究不同浓度6-BA对高羊茅愈伤组织分化的影响,进而获得最佳的促进高羊茅愈伤组织诱导的6-BA浓度。
本研究采用了3个不同高羊茅品种的成熟种子为外植体,结果发现,在MS培养基上添加6~9 mg/L 2,4-D和0.4~0.6 mg/L 6-BA对高羊茅愈伤组织的诱导都有较大的促进作用。而此前刘卫东等的研究认为,不同种类的基本培养基对愈伤组织诱导没有显著差异。易自力等[13]通过比较NB、MS和CC 3种植物组织培养常用的基本培养基,认为进行高羊茅成熟种子愈伤组织诱导宜采用CC培养基。何阳鹏等[14]通过试验发现BA对愈伤组织的诱导存在一定浓度的负效应,在培养基中添加的BA浓度越高,愈伤诱导率越受抑制。为了进一步提高高羊茅种子愈伤组织的诱导率,今后可选用多种植物生长素和植物细胞分裂素浓度配比及其添加其他生物活性物质进行试验,从而获得最佳植物激素组合的培养基。
3.2 不同基因型对高羊茅愈伤组织诱导的影响
本研究采用了湖南等我国草坪过渡带地区常用的3个高羊茅品种进行不同浓度的2,4-D和不同浓度6-BA培养基的愈伤组织诱导研究,结果表明,3个供试高羊茅品种成熟种子愈伤组织诱导率存在一定的基因型差异。如在不同2,4-D浓度培养基诱导高羊茅愈伤组织的试验中,3个高羊茅品种的发芽率相似,但平均出愈率却相差甚大,其中,交战Ⅱ的平均出愈率为28.4%,极显著高于其他2个高羊茅品种的出愈率。高羊茅组织培养的基因型差异在以往已有相关报道。如:Bai和Qu[15]的研究表明,在25个供试品种中,愈伤组织诱导率相差达数倍甚至10倍以上。郎春秀等[3]在研究中发现,当2,4-D浓度为8 mg/L、ABA浓度为2 mg/L时,高羊茅可奇思的愈伤组织诱导率高出猎狗5号13.4个百分点。吴关庭等[16]通过试验发现,在BAP与KT配比、NAA浓度和琼脂浓度试验中,各自适宜浓度条件下,高羊茅猎狗5号的总愈伤组织再生率比美洲虎3号高23.8~29.3个百分点。余桂红等[5]以5个高羊茅品种成熟种子为外植体,研究表明,不同高羊茅品种成熟种子在相同培养基上的出芽率和出愈率差异很大。这些结果表明,在今后有关高羊茅愈伤组织培养的研究中,应针对不同高羊茅品种选择相适宜的激素浓度,以达到最佳诱导效果。并且在此基础上,进一步研究不同激素种类及浓度对高羊茅愈伤组织诱导的影响,最终实现湖南本地高羊茅草种的抗热性改良,实现高羊茅在湖南等草坪草过渡性地带的四季常绿。
[1] 陈宝书.牧草饲料作物栽培学[M].北京:中国农业出版社,2001.329-330.
[2] 葛荣朝,赵宝存,秘彩莉.高羊茅的组织培养和愈伤组织诱变[J].河北师范大学学报(自然科学版),2007,20(4):5-11.
[3] 郎春秀,吴关庭,胡张华.高羊茅成熟种子组织培养的影响因素研究 I.多种因素对愈伤组织诱导的影响[J].浙江农业学报,2005,11(4):55-59.
[4] 胡繁荣,夏英武.辐照对高羊茅愈伤组织诱导及农杆菌介导转化的影响[J].上海交通大学学报(农业科学版),2005,31(2):12-17.
[5] 余桂红,马鸿翔,佘建明.草坪型高羊茅成熟种子胚性愈伤组织诱导及植株再生[J].江苏农业学报,2004,5(1):14-20.
[6] 江巨鳌,赵运林,陈智勇.高羊茅愈伤组织再生系统的建立[J].湖南农业大学学报(自然科学版),2003,18(5):45-49.
[7] 杨 扬,何胜江,吴 凯,等.高羊茅再生体系及其遗传转化研究进展[J].现代农业科技,2009,(1):42-44.
[8] 韩春梅,张新全,彭 燕,等.高羊茅草坪的坪用价值比较[J].安徽农业科学,2007,35(5):1339-1341.
[9] 何 勇,田志宏,郑川琏.高羊茅成熟胚离体培养及高频植株再生[J].草业科学,2005,22(6):23-28.
[10]李志亮,叶 嘉,杨 杰,等.高羊茅组培再生体系建立的研究[J].邯郸学院学报,2006,16(3):60-63.
[11]高丽美,徐子勤,张永彦,等.高羊茅组织培养再生体系及GUS基因瞬间表达研究[J]. 西北植物学报,2004,25(1):40-45.
[12]王 健,徐子勤,张永彦,等.高羊茅高频再生体系的建立[J].西北大学学报(自然科学版),2007,37(2):257-260.
[13]易自力,陈志勇,蒋建雄,等.三种冷季型草坪草愈伤组织再生体系的建立[J].中南林学院学报,2005,25(1):25-28.
[14]何阳鹏,于海涛.不同种胚及激素处理对高羊茅愈伤组织诱导的影响[J].安徽农业科学,2003,31(3):371-374.
[15]Bai Y,Qu R.An evaluation of callus induction and plant regeneration in twenty-five turf-type tall fescue (FestucaarundinaceaSchreb.) cultivars[J]. Grass and Farage Sci,2000,55(4):326-330.
[16]吴关庭,胡张华,陈笑芸,等.高羊茅成熟种子组织培养的影响因素研究 Ⅱ.多种因素对胚性愈伤组织分化的影响[J].浙江农业学报,2006,18(6):412-416.
S543+.901
A
1001-5280(2012)07-0021-04
10.3969/j.issn.1001-5280.2012.07.06

