双特异性单抗对胃肠癌的体内杀伤作用
刘洪一,李 荣,刘巨超,李 力,梁文涛,钟 苑,徐迎新
(中国人民解放军总医院,1.肿瘤外科;2.普通外科研究所,北京,100853)
对于胃肠癌的治疗,除手术、化疗及放疗等治疗之外,生物治疗尤其是应用CIK细胞进行肿瘤的过继免疫治疗是近年来研究较多的一种治疗手段[1],并已广泛应用于临床。但CIK细胞对于肿瘤的治疗缺乏靶向性,CIK细胞很难在肿瘤周围得到很好的浓聚。而目前有许多双特异性抗体在体外实验取得了良好的结果,并且部分双特异性抗体的研究已进入临床实验阶段[2],抗CD3抗CEA的双特异性抗体就是其中研究较多的抗体之一[3],它一方面可以激活细胞毒T淋巴细胞,另一方面可以使免疫细胞在肿瘤局部聚集,更好地杀伤肿瘤细胞。本研究在前人研究的基础上,进一步探讨了抗CD3抗CEA双特异性单链抗体介导的CIK细胞对胃肠癌的体内杀伤作用,现报道如下。
1 材料与方法
1.1 材料
抗CD3抗CEA双特异性单链抗体(BsAb)购自北京安渡符基因工程技术有限公司;人胃低分化腺癌BGC823细胞、人结肠中分化腺癌SW1116细胞,由本院普通外科研究所提供。健康人外周血由本院输血科提供,近期无感染病史及疫苗接种病史,乙肝、丙肝、梅毒、AIDS检测阴性。裸小鼠50只,购自本院实验动物中心,均为雌性,鼠龄6周,体质量17~20 g。于本院实验动物中心SPF级无菌饲养。其他常规试剂均为进口或国产分析纯化。
1.2 CIK细胞的制备与鉴定
取人外周血25 mL与生理盐水等体积混匀,然后缓慢的铺在等体积的分离液上,以2000 r/min离心,20 min;收集白膜层,用生理盐水洗涤1~2次,2500 r/min离心,10 min;3 h后收集未贴壁PBMC细胞,用KBM-551培养基10 mL重悬,移至75 cm2T型培养瓶中;0时刻加入rh-IFN-r 1000 U/mL终浓度;37℃,5%CO2,饱和湿度培养过夜;加入 CD3McAb 2 μg/mL终浓度,IL-2500 U/mL终浓度;隔日加入新鲜培养基、IL-2;培养过程中经常观察细胞状态以备后续实验用。在CIK细胞培养成熟后,应用流式细胞仪进行CD3、CD4、CD8和CD56表达的鉴定。
1.3 动物模型的建立
利用T细胞免疫缺陷裸鼠,分别以人胃低分化腺癌BGC823细胞及人结肠中分化腺癌SW1116细胞制备小鼠皮下荷瘤模型。分别取对数生长期上述细胞,0.25%胰酶消化后制成单细胞悬液,胎盘蓝实验证实细胞活力≥95%;用6号针头注射器抽取0.2 mL瘤细胞悬液(含活细胞5×106个)接种于裸鼠左腋下皮下,无菌环境下饲养;致瘤2周后,肿瘤生长约6 mm,剔除肿瘤过大、过小或棘突明显的裸鼠。
1.4 体内抑瘤试验
胃癌及结肠癌组分别随机分成3组。对照组(n=5),尾静脉注射生理盐水0.2 mL/只,1次/3 d;CIK组(n=5),尾静脉注射单纯人CIK细胞0.2 mL/只(培养14 d左右,含活细胞 1×107个),1次/3 d;CIK+双抗组(n=5),尾静脉注射人CIK细胞和抗CEA抗CD3双特异性单链抗体(1×107个CIK 细胞与10 μg抗体预混合30 min后洗脱),1次/3 d;连续治疗 6次;每 3 d以游标卡尺测量肿瘤最大径(a)和最小径(b),按公式计算肿瘤体积:V=ab2/2;治疗6次后,观察3 d处死裸鼠,取出肿瘤组织称重。计算公式抑瘤率:抑瘤率=(对照组瘤重-实验组瘤重)/对照组瘤重×100%。
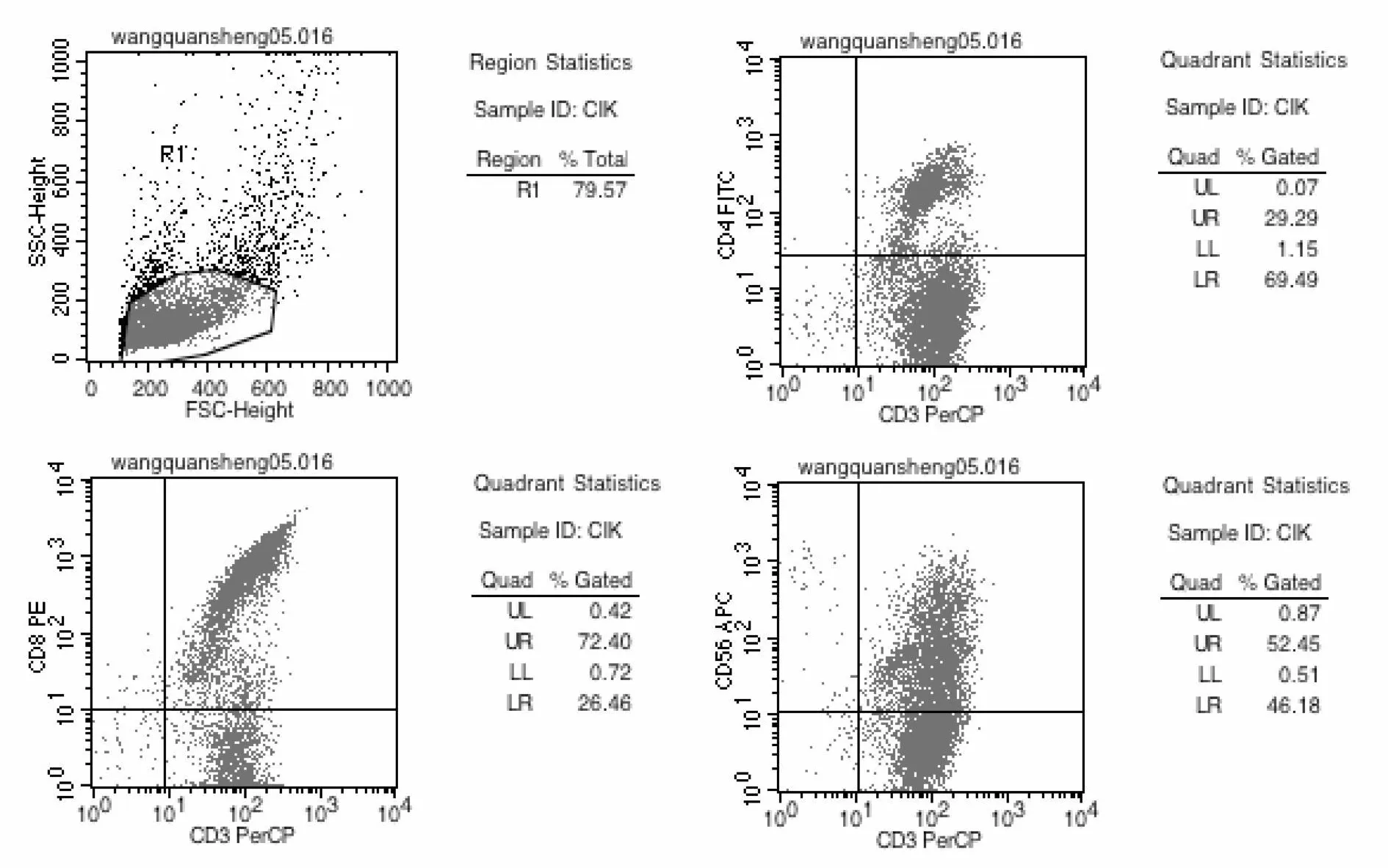
图1 流式细胞结果
2 结 果
2.1 流式细胞仪检测结果
FMC结果显示:PBMC细胞经过10 d左右的培养后,CD3、CD4、CD8和 CD56的表达率分别为95.78%、29.36%、72.82%和53.32%,确定为CIK细胞[4],见图1。
2.2 裸鼠动物模型
利用T细胞免疫缺陷裸鼠,以人胃低分化腺癌BGC823细胞及人结肠中分化腺癌SW1116细胞分别制备裸鼠皮下荷瘤模型。肿瘤悬液注射于裸鼠左侧腋下2周后,可观察到肿瘤生长,游标卡尺测量最大直径为0.5~0.6 cm,成瘤率100%。
2.3 抑瘤实验
胃癌及结肠癌的对照组肿瘤体积均持续增大,CIK组肿瘤体积均增长缓慢,2组间差异有统计学意义(P<0.05或P<0.01);CIK+双抗组肿瘤生长均明显受到抑制,与对照组及CIK组之间差异均有统计学意义(P<0.05或P<0.01),见图2、图3。治疗后3 d将裸鼠颈椎脱臼处死,剥离肿瘤块、称重,计算肿瘤抑瘤率,见表 1、表2;CIK组和CIK+双抗组均可抑制肿瘤生长,胃癌的抑瘤率分别为29.90%和44.33%,瘤体积和瘤重和对照组比较差异均有统计学意义(P<0.05或P<0.01);结肠癌的抑瘤率分别为14.93%和38.81%,瘤体积和瘤重和对照组比较差异均有统计学意义(P<0.01)。CIK组和CIK+双抗组比较,胃癌及结肠癌的瘤体积、瘤重间的差异均有统计学意义(P<0.05)。表明CIK细胞本身可以抑制肿瘤细胞的生长,在加入抗CD3抗CEA双特异性单链抗体后抑瘤作用明显增强。
表1 胃癌治疗18 d后3组小鼠抑肿率比较()
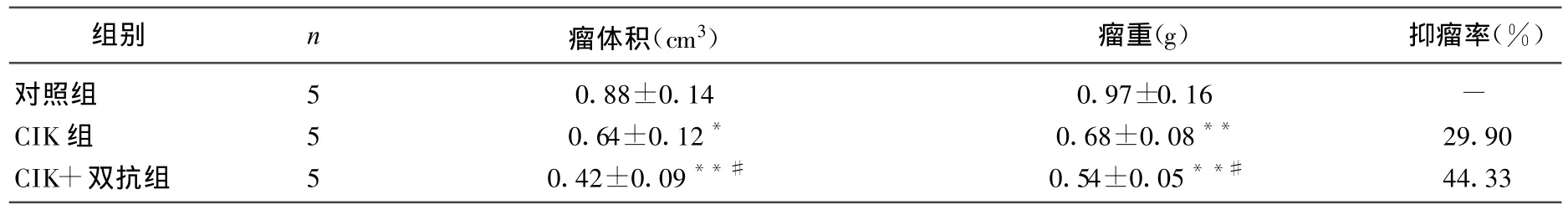
表1 胃癌治疗18 d后3组小鼠抑肿率比较()
与对照组比较,*P<0.05,**P<0.01;与CIK组比较,#P<0.05
组别 n 瘤体积(cm3) 瘤重(g) 抑瘤率(%)对照组 5 0.88±0.14 0.97±0.16 -CIK组 5 0.64±0.12* 0.68±0.08** 29.90 CIK+双抗组 5 0.42±0.09**# 0.54±0.05**# 44.33
表2 结肠癌治疗18 d后3组小鼠抑肿率比较()

表2 结肠癌治疗18 d后3组小鼠抑肿率比较()
与对照组比较,**P<0.01;与CIK组比较,#P<0.05,##P<0.01
组别 n 瘤体积(cm3) 瘤重(g) 抑瘤率(%)对照组 5 0.74±0.09 0.67±0.15 -CIK组 5 0.56±0.07** 0.57±0.09 14.93 CIK+双抗组 5 0.39±0.06**## 0.41±0.08**# 38.81
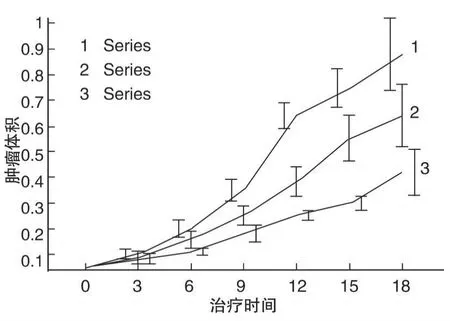
图2 胃癌肿瘤生长曲线
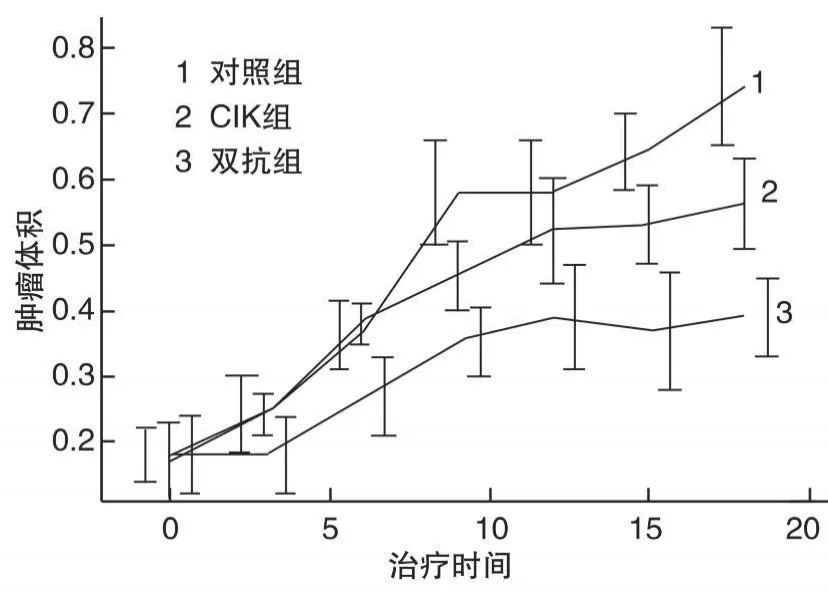
图3 结肠癌肿瘤生长曲线
3 讨 论
据2002年世界卫生组织统计,中国人胃癌的总人数占全世界的40%以上,而且胃癌相关死亡率处于第2位,仅次于肺癌[5]。2007年,全球结直肠癌新病例接近120万,死亡63万[6],据我国统计资料估计,我国2005年结直肠癌发病数和死亡数分别达17.2万和9.9万,已超过美国[7]。对于胃肠癌经传统的手术、化疗及放疗等治疗后,5年生存率仍不理想。因此,探索新的、有效的胃癌治疗方法势在必行。过继性细胞免疫治疗(ACI)是通过输注免疫活性细胞增强肿瘤患者的免疫功能达到抗肿瘤的效果。其中以细胞因子诱导的杀伤细胞(CIK细胞)目前应用较为广泛[8]。CIK细胞作为肿瘤过继免疫治疗的一个新型免疫活性细胞,是近年来研究较多的一种生物治疗手段。但是,研究同时发现CIK细胞在体外实验中表现出的杀伤肿瘤细胞的活性,应用于体内效果却往往差强人意。因此,如何使CIK细胞在体内识别并到达靶细胞,从而发挥杀伤作用,是迫切需要解决的问题,也是提高肿瘤生物治疗疗效的关键。
目前恶性肿瘤的靶向治疗备受瞩目,已有大量的靶向药物应用于临床。而目前的靶向药物大都以肿瘤细胞特异性抗原为靶抗原,直接作用于靶点,抑制肿瘤的生长或者阻断细胞信号传导通路[9]。因此要求靶抗原除了具有肿瘤组织特异性之外,还要求靶抗原在肿瘤的生长环节中具有重要地位。而已知的大多数肿瘤特异性抗原均不具有这样的组织特异性,因此靶向药物的研制也受到巨大的阻碍[10]。可激活细胞毒T淋巴细胞并使其在肿瘤局部聚集的抗CD3抗肿瘤特异性抗原的双特异性抗体备受研究者瞩目。
为了观察双特异性单链抗体介导的CIK细胞对胃癌的体内杀伤作用,本研究制备人源胃癌及结肠癌的荷瘤裸鼠模型。本研究结果显示,对照组肿瘤体积持续增大,CIK组肿瘤体积增长缓慢,CIK+双抗组肿瘤生长明显受到抑制。CIK细胞本身可以抑制肿瘤细胞的生长,在加入抗CD3抗CEA双特异性单链抗体后抑瘤作用明显增强。其原因可能是CIK细胞结合了双特异性抗体后,具有更好的肿瘤靶向作用。同时,双特异性抗体除了可以结合CIK细胞外,还可以结合任何表达CD3的免疫细胞,因此在具有正常免疫系统的体内试验时,可能会收到意想不到的良好效果,但结果有待于进一步研究。
[1]Baeuerle P A,Reinhardt C.Bispecific T-cell engaging antibodies for cancer therapy[J].Cancer Res,2009,69(12):4941.
[2]Compte M,Blanco B,Serrano F,et al.Inhibition of tumor growth in vivo by in situ secretion of bispecific anti-CEA x anti-CD3diabodies from lentivirally transduced human lymphocytes[J].Cancer Gene Ther,2007,14(4):380.
[3]Brown D M,Kamperschroer C,Dilzer AM,et al.IL-2 and antigen dose differentially regulate perforin-and FasL-mediated cytolytic activity in antigen specific CD4+Tcells[J].Cell Immunol,2009,257(1-2):69.
[4]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74.
[5]McMichael A J.Food,nutrition,physical activity and cancer prevention.Authoritative report from World Cancer Research Fund provides global update[J].Public Health Nutr,2008,11(7):762.
[6]Searle B,Chan D.American Society of Clinical Oncology--42nd annual meeting.Ovarian cancer,solid tumors,neuroendocrine tumors and lymphoma.2-6 June 2006,Atlanta,GA,USA[J].IDrugs.2006,9(8):529.
[7]杨 玲,李连弟,陈育德,等.中国2000年及2005年恶性肿瘤发病死亡的估计与预测[J].中国卫生统计,2005,22:218.
[8]Weng D S,Zhou J,Zhou Q M,et al.Minimally invasive treatment combined with cytokine-induced killer cells therapy lower the short-term recurrence rates of hepatocellular carcinomas[J].Immunother,2008,31:63.
[9]黄宇贤,郭坤元.肿瘤生物治疗的新模式:分子靶向-过继性细胞免疫治疗[J].中国肿瘤生物治疗杂志,2010,17(3):243.
[10]马 全,武正炎,查小明,等.Mage-A3抗原肽负载DC过继免疫治疗乳腺癌的实验研究[J].实用临床医药杂志,2006,10(3):2.

