框镜鲤维氏气单胞菌CY0806株鞭毛flaA基因的克隆与生物信息学分析
单晓枫,吴同垒,孟庆峰,王伟利,钱爱东
(1 吉林农业大学动物科学技术学院,吉林长春 130118;2 吉林出入境检验检疫局,吉林长春 130062)
维氏气单胞菌(Aeromonas veronii,AV)隶属于弧菌科气单胞菌属,是一种人-兽-鱼共患病原菌.其不仅在人抵抗力下降时,感染机体引发人的坏死性脑炎、败血症、腹泻等疾病[1-3];而且也可引发水生动物的疾病,给水产养殖业造成巨大损失[4-6].AV 有多种毒力因子,主要包括外毒素、蛋白酶、鞭毛、外膜蛋白等,其中,鞭毛作为大多数细菌的主要运动器官,在细菌致病性方面,起着举足轻重的作用.目前,国内AV的研究正处于起步阶段,本研究以框镜鲤Cyprinus carpio AV CY0806为研究对象,克隆其鞭毛flaA基因,并对其编码蛋白质进行了生物信息学分析,以期为框镜鲤AV的发病机理、基因工程疫苗等研究奠定基础.
1 材料与方法
1.1 菌株和载体
框镜鲤AV CY0806株分离自患病框镜鲤,为吉林农业大学预防兽医学研究室保存;大肠埃希菌Escherichia coli DH5α为吉林农业大学动物科学技术学院生物技术研究室保存;pMD18-T vector为宝生物工程(大连)有限公司产品.
1.2 主要试剂
Taq DNA聚合酶、dNTP均为宝生物工程(大连)有限公司产品;DNA凝胶回收试剂盒为爱思进生物技术有限公司产品;质粒小量抽提试剂盒为北京索莱宝科技有限公司产品;气单胞菌培养基RS为北京陆桥技术有限责任公司产品;其他试剂均为进口或国产分析纯.
1.3 引物设计与合成
根据GenBank上发表的AV鞭毛flaA基因序列,应用Primer Premer 5.0和Oligo 6.0软件设计1对引物:上游引物 P1:5'-GCGGAATTCATGGGCCTTTATATCA-3',下游引物 P2:5'-ACGAAGCTTTTAGCCTTGCCAACAGA-3',预计扩增片段长 915 bp,该引物由宝生物工程(大连)有限公司合成.
1.4 鞭毛flaA基因的PCR扩增
将低温保存的AV CY0806划线接种于RS培养基上,30℃培养24 h,挑取特征菌落接种于普通LB液体培养基中,30℃培养18 h,取1 mL菌液,提取细菌基因组DNA,具体操作参照细菌基因组DNA提取手册.以菌株CY0806基因组DNA为模板,P1、P2为引物,采用50 μL反应体系进行PCR扩增flaA基因,反应条件:94℃预变性5 min,94℃ 1 min、58℃1 min、72℃ 1 min、循环32次,最后72℃延伸10 min,PCR产物于4℃保存.
1.5 鞭毛flaA基因的克隆及鉴定
将PCR扩增产物用0.01 kg/L琼脂糖凝胶电泳鉴定,用DNA凝胶回收试剂盒回收目的片段,并与pMD18-T verctor连接,转化至 DH5α 感受态细菌.将转化产物涂布于含氨苄青霉素LB固体培养基上,37℃培养12~16 h,挑取单个菌落、增菌,用小量质粒抽提试剂盒提取质粒并进行PCR验证,筛选出阳性重组质粒送至宝生物工程(大连)有限公司进行序列测定.
1.6 鞭毛flaA基因的序列分析及系统进化树构建
将所测flaA基因序列用Blastn进行比对,并从NCBI上下载气单胞菌属不同菌种的flaA基因,应用Mega4.0软件构建系统进化树.
1.7 鞭毛flaA基因编码蛋白的生物信息学分析
将flaA基因开放阅读框录入DNAStar的Editseq工作区,用Translate DNA功能翻译flaA氨基酸序列;利用 http:∥www.expasy.org/cgi-bin/protparam预测蛋白质基本理化性质;利用 SingalP v 3.0(http:∥www.cbs.dtu.dk/sercices/SingalP)对氨基酸序列信号肽进行分析;利用TMHMM v 2.0(http:∥genome.cbs.dtu.dk/services/TMHMM-2.0)对序列跨膜区分析;利用BioEdit和DNAStar分析序列亲水性和疏水性;利用DNAStar软件的Proteam分析氨基酸序列的二级结构;利用 Swiss-Model Workspace(http:∥swissmodel.expasy.org/wokspace)对蛋白质结构做同源建模.
2 结果与分析
2.1 鞭毛flaA基因的PCR扩增和鉴定
以菌体基因组DNA为模板,经PCR扩增出约915 bp的特异性条带(图1).将扩增的flaA基因片段纯化后与pMD18-T verctor连接,经氨苄青霉素抗性筛选后,阳性重组质粒通过PCR鉴定,得到与目的基因大小一致的片段(图2).
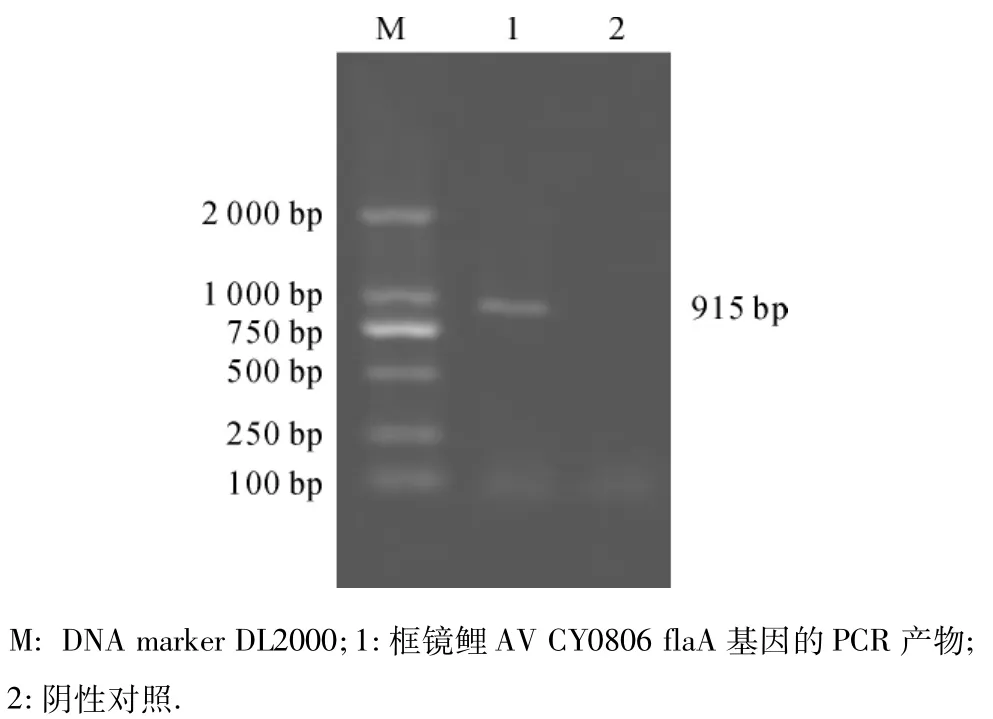
图1 框镜鲤AV CY0806 flaA基因的PCR扩增Fig.1 Amplified flaA gene from Cyprinus carpio AV CY0806 by PCR

图2 重组质粒的PCR鉴定Fig.2 Identification of recombinant plasmid by PCR
2.2 鞭毛flaA基因的序列分析与系统进化树构建
经序列测定,flaA基因全长915 bp,编码304个氨基酸.序列比对与系统进化树分析(图3)结果表明:维氏气单胞菌CY0806株flaA基因与维氏气单胞菌EU410309和EU410323的flaA基因进化距离近.

图3 框镜鲤AV CY0806 flaA基因的系统进化树Fig.3 Phylogenetic tree of Cyprinus carpio AV CY0806 flaA gene
2.3 鞭毛flaA基因编码蛋白生物信息学分析
2.3.1 鞭毛flaA基因编码蛋白分子特征 鞭毛flaA基因编码蛋白推导相对分子质量32098.66,含有23个强碱性氨基酸(K、R)、24个强酸性氨基酸(D、E)、105 个疏水氨基酸(A、I、L、F、W、V)、121 个极性氨基酸(N、C、Q、S、T、Y),等电点为 5.57,推测分子式C1853H2229N409O474S9,消化系数7450,半衰期为30 h(体外哺乳动物类网状细胞)、大于20 h(在酵母体内)及10 h(在大肠埃希菌体内),不稳定系数32.31(稳定蛋白),脂肪系数81.05.
2.3.2 鞭毛flaA基因编码蛋白的信号肽与跨膜区分析 通过SingalP软件预测分析,鞭毛flaA基因编码蛋白分子无信号肽;TMHMM分析结果显示:此蛋白分子不存在跨膜区.
2.3.3 鞭毛flaA基因编码蛋白的亲水性和疏水性分析 利用BioEdit和DNAStar分析:鞭毛flaA基因编码蛋白最大疏水指数1.86,最小疏水指数-2.68;最大亲水指数2.68,最小亲水指数-1.86.其分析结果如图4所示.
2.3.4 鞭毛flaA基因编码蛋白的二级结构预测
通过Gamier-Robso方法预测蛋白质二级结构发现,鞭毛flaA基因编码蛋白分子存在11处α螺旋、21处β折叠、β转角和无规则卷曲则相对较少;而应用Chou-Fasman方法,发现有10处 α 螺旋、11处 β 折叠、β转角则多至18处.
2.3.5 鞭毛flaA基因编码蛋白的三维结构预测
将推导的氨基酸序列利用Swiss-Model Workspace进行同源建模,以第2~303位氨基酸序列预测鞭毛flaA基因编码蛋白的三维结构(图5).
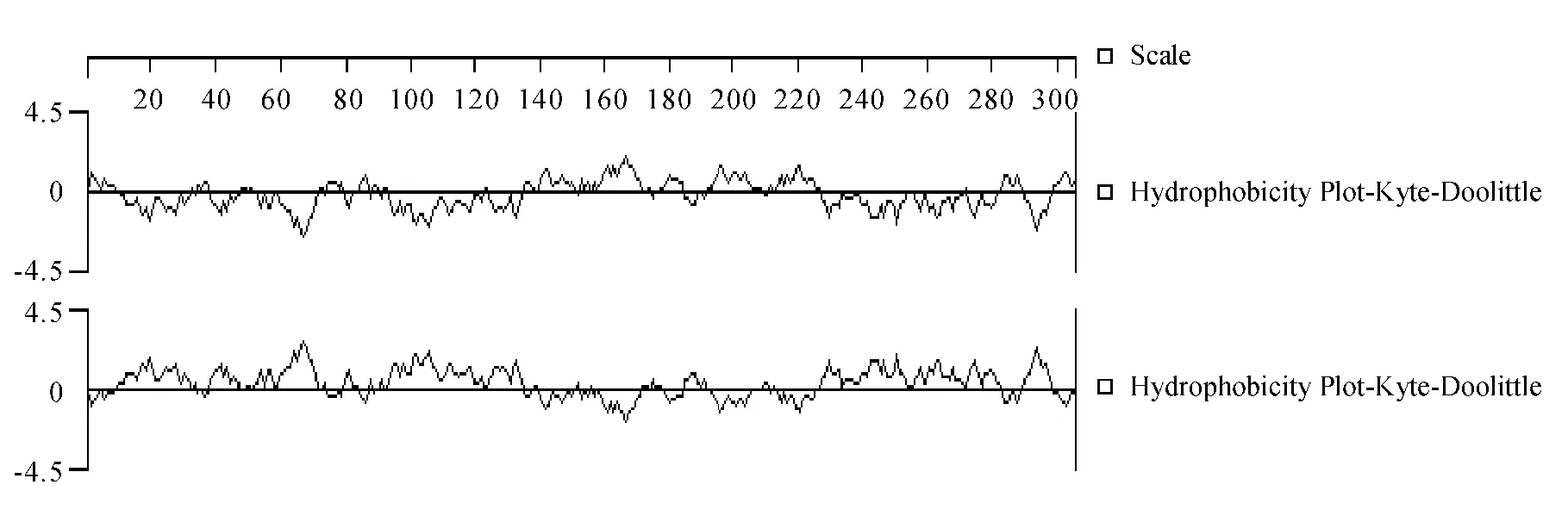
图4 框镜鲤AV CY0806 flaA蛋白的疏水性和亲水性分析Fig.4 Hydrophilicity prediction and hydrophobicity prediction of Cyprinus carpio AV CY0806 flaA

图5 flaA三维结构预测Fig.5 3D structure prediction of flaA
3 讨论
维氏气单胞菌作为一种较新型的人-兽-鱼共患病原菌,在引发人的各种疾病的同时,近年来,已有相当多的报道,证明其可以感染多种水生动物并引发多种疾病的流行.本研究所用菌株即为框镜鲤败血症病原菌[7],该菌株经试验证实,可以感染多种鱼类并引起相应的病症,但其发病机理尚不清楚.而鞭毛作为多种细菌的运动器官,在细菌感染、免疫等方面发挥重要作用,其主要化学组成为蛋白质,具有良好的免疫原性.目前,从基因水平研究病原菌的鞭毛,是研究病原菌致病的分子机制和研发基因工程疫苗的基础[8-9].为此,本试验对框镜鲤源 AV鞭毛flaA基因进行了克隆并对其编码蛋白进行了相关生物信息学的分析.
本研究从框镜鲤AV CY0806株中克隆了flaA基因,经PCR与测序分析,成功地获得了长915 bp的flaA基因,其编码304个氨基酸,与其他气单胞菌属的菌株进行相似性分析,发现菌株CY0806 flaA基因与 GenBank上的维氏气单胞菌 EU410309、EU410323进化距离较近,进化树在同一分支上.但也发现,有部分基因存在差异,可能与菌株来源、地域差异有很大关系.
预测蛋白质的三维立体结构,是了解蛋白质空间结构信息的重要途径,其预测方法以同源建模、线串法和从头建算法为主[10],其中,同源建模法是最为成功和准确的方法.本研究以同源建模法预测了flaA三维立体结构.预测结果,将有利于对蛋白质结构进行改造,使蛋白质的相应特性更趋于理想;另一方面还可进行分子设计,使可能成为药物的蛋白质更好地与受体结合,充分发挥药物的功效[11].
本试验克隆了维氏气单胞菌CY0806株的flaA基因,构建了系统进化树,并对其编码的蛋白进行了生物信息学分析,为以后研究维氏气单胞菌的发病机制、诊断方法的建立及研发疫苗以预防由AV引起的疾病提供了理论依据,为更好地研究这一新型人-兽-鱼共患病原菌奠定了基础.
[1]SHIINA Y,LI K,IWANAGA M.An Aeromonas veronii biovar sobria infection with disseminated intravascular gas production[J].J Infect Chemother,2004,10(1):37-41.
[2]GRBNER S,BISSINGER A L,RAIBLE A,et al.Severe diarrhea caused by Aeromonas veronii biovar sobria in a patient with metastasised GIST[J].Polish Journal of Microbiology,2007,56(4):277-279.
[3]CUI Hong-yi,HAO Sun-yang,AROUS E.A distinct cause of necrotizing fasciitis:Aeromonas veronii biovar sobria[J].Surgical Infections,2007,8(5):523-528.
[4]RAHMAN M,COLQUE-NAVARRO P,KLIHN I,et al.Identification and characterization of pathogenic Aeromonas veronii biovar sobria associated with epizootic ulcerative syndrome in fish in Bangladesh[J].Applied Environmental Microbiology,2002,68(2):650-655.
[5]房海,陈翠珍,张晓君,等.中华绒螯蟹病原维氏气单胞菌的检验[J].中国人兽共患病学报,2008,24(1):45-49.
[6]潘晓艺,沈锦玉,李建应,等.青虾“软壳综合症”病原及其特性[J].微生物学通报,2009,36(10):1571-1576.
[7]龚倩,高淑琴,单晓枫,等.框镜鲤致病性维氏气单胞菌的分离鉴定[J].中国预防兽医学学报,2010,32(12):981-983.
[8]MARUYAMARU Y,MOMMA M,MIKAMI B,et al.Crystal structure of novel bacterial cell-surface flagellin binding to a polysaccharide[J].Biochemistry,2008,47(5):1393-1402.
[9]YONEKURA K,MAKI S,NAMBA K.Complete atomic model of the bacterial flagellar filament by electron cryomicroscopy[J].Nature,2003,424(32):643-650.
[10]薛庆中.DNA和蛋白质序列数据分析工具[M].2版.北京:科学出版社,2010.
[11]翟军军,窦永喜,张海瑞,等.小反刍兽疫病毒P基因的克隆及其结构与功能分析[J].中国农业科学,2010,43(11):2355-2362.

