多巴胺对鸣禽发声相关神经元活动的调控
潘 璇,廖从舒,李东风
(华南师范大学生命科学学院,广东广州 510631)
多巴胺对鸣禽发声相关神经元活动的调控
潘 璇,廖从舒,李东风*
(华南师范大学生命科学学院,广东广州 510631)
鸣禽多巴胺(DA)神经元主要分布于中脑腹侧被盖区-黑质体致密部(VTA-SNc复合体)和中脑导水管周围灰质(PAG),分别发出纤维投射至鸣唱控制核团前脑纹状X区、弓状皮质栎核(RA)和高级发声中枢(HVC).近年研究表明,中脑向鸣唱控制核团中释放的DA可以调控鸣唱控制核团中神经元的活动,进而调节鸣禽的鸣唱行为.该文结合课题组研究,介绍多巴胺对鸣禽发声相关神经元活动调控的研究进展.
多巴胺; 鸣禽; X区; 弓状皮质栎核; 电生理活动
鸣禽是除了人类以外极少数具有发声学习能力的动物,其已成为研究运动序列控制和人类语言学习与产生的理想模型[1].
鸣唱控制系统由鸣禽脑内的核团及其通路构成.其中鸣唱运动通路(VMP, Vocal Motor Pathway)由高级发声中枢(HVC)→弓状皮质栎核(RA)→舌下神经气管鸣管亚核(nXⅡts), VMP的主要功能是控制鸣曲的产生,直接参与鸣禽的发声行为.另一条是鸣唱学习通路,也称为前端脑通路(AFP, Anterior Forebrain Pathway).AFP由HVC→X区(Area X)→丘脑背外侧核(DLM)→新纹状体巨细胞核外侧部(LMAN)→RA.AFP的主要功能在于幼鸟的鸣唱学习和成鸟的鸣唱稳定性.
1 鸣禽DA神经元的分布及调控区域
鸣禽DA神经元集中分布于中脑VTA-SNc复合体及PAG(也称CG或GCT).中脑DA神经元通过发出的纤维投射到鸣唱控制核团,调节鸣禽的鸣唱学习与产生,其中VTA-SNc复合体的DA神经元会密集投射到X区,少部分投射到HVC和RA;PAG的DA神经元则只投射到HVC 和RA(图1)[2-4].反过来,鸣唱控制系统也可以将鸣唱信息及时反馈给中脑DA神经元,主要通过X区Pd(苍白球样神经元)发出的纤维下行至VP(腹侧苍白球),VP神经元再发出纤维投射至VTA-SNc复合体[5],这样就在X区与中脑DA神经元之间建立起一条完整的往返回路,使得DA神经元可以更加准确地调节鸣禽鸣唱行为[6].而DAR(多巴胺受体)在鸣禽脑内的分布也表明鸣唱控制核团可能受到中脑投射的DA调控.DAR主要分为D1和D2两类, D1R(D1受体)又有 D1A、D1B、D1C、D1D、D1X等亚型; D2R (D2受体)有 D2、D3、D4等亚型,其中D2亚型又可分为D2long、D2short的异构形式.每一亚型的受体与多巴胺结合后可能产生不同的生理效应.总的来说,被DA激活后,D1R会激活兴奋性G蛋白,增强腺苷酸环化酶的活性,从而增加cAMP的生成,产生兴奋性效果;D2R则会激活抑制性G蛋白,产生相反的效果[7].KUBIKOVA等[8]应用原位杂交研究发现,DAR在鸣禽端脑的分布与鸣唱控制核团具有显著的相关性,其中D1A受体、D1B受体在X区非常密集地表达,在RA和HVC中也有较密集的表达;D2受体在X区有密集表达;D3受体在RA和HVC中有较密集的表达;而D1D受体只在非鸣唱控制核团中有表达.这些都暗示了DA可以通过激活分布于鸣唱控制核团中不同的DAR调节鸣唱相关神经元的活动、基因的表达以及鸣唱行为.

图1 多巴胺系统在鸟脑中的分布
Figure 1 Distribution of dopamine system in the brain of songbirds
2 DA对X区神经元活动的调控
X区位于鸣禽前脑LPO (旁嗅叶)中,呈卵圆形.它与哺乳动物脑中的基底神经节在进化上同源,具有系统进化和个体发育上的保守性. X区接受HVC和LMAN中神经元的谷氨酸突触输入.此外,在X区的树突丛中还有来自AVT投射形成的多巴胺突触.X区内有5类神经元:SN(棘神经元)、LA(长持续后超级化神经元)、LTS(低阈值发放神经元)、FS(快发放神经元)、AF(无棘快发放神经元,由于与哺乳动物苍白球内神经元很相似也称苍白球样神经元,Pd).其中SN和AF为投射神经元,SN接受HVC和LMAN的突触输入,之后与AF形成GABA突触联系,AF再发出GABA纤维投射到DLM[9].
X区既具有最密集的DAR分布,又具有最丰富的DA输入,所以X区成为DA对鸣唱行为调控研究的焦点.自2002年起,DING等开始应用全细胞膜片钳记录技术,开展了一系列DA对X区SN电生理活动调节的研究.首先,他们发现DA能够调节X区SN的诱发动作电位的发放,当D1R激活后,SN诱发动作电位的发放频率增加,而D2R激活后,SN诱发动作电位的频率降低,并且2类受体同时存在于同一神经元上,所以DA对SN诱发动作电位发放的调节,依赖于2种受体在同一神经元上所占的比例,表明了DA能够通过激活不同的DAR调节X区SN兴奋性[10]. 进一步探究DA对鸣唱通路间信息传递的调节作用,应用D1R激动剂激活X区内D1R可以降低HVC和LMAN到X区SN的谷氨酸突触输入.其机制可能是DA首先激活记录神经元旁边的神经元上D1R,之后通过PKA通路,增加腺苷(A)的分泌,进而激活记录神经元的突触前神经元上腺苷受体(AR),减少了突触前谷氨酸的释放,使得记录神经元上EPSC幅度降低,即DA降低了HVC或LMAN到X区的信息传递(图2)[11].LTP(长时程增强) 是突触水平上的一种信息存储方式[12],被认为是学习记忆的可能机制.在X区SN上联合给予突触后去极化到0伏和突触前100Hz的强直刺激可以诱导出LTP,这种LTP与哺乳动物海马中Schaffer侧支到联合通路谷氨酸突触上产生的LTP十分相似.但不同的是,鸣禽X区SN上LTP的产生不仅需要NMDA受体的激活,还需要D1R的激活,表明DA可能在鸣禽鸣唱学习过程中具有重要的作用,其机制可能是由于DA激活了SN的D1R后,增加了cAMP活性,易化了LTP的产生; 也有可能由于D1R的活动增强了L型钙离子通道的通透,钙离子的内流增加,易化了LTP的产生[13].此外,他们还发现该LTP诱导的能力在雏鸟﹑幼鸟和成鸟中表现出增加的趋势.这个趋势平行于在发育水平上X区DA支配密度的增加[14],这与产生LTP依赖于D1R相一致.因此,该LTP的特性可以在一定程度上受到发育水平上变化的DA的调节,更进一步地暗示了DA在鸣禽鸣唱系统发育中的重要意义.
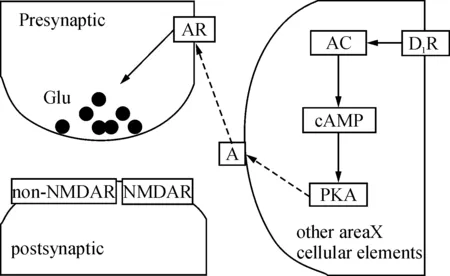
图2 多巴胺通过突触前机制调节神经元间信息的传递
Figure 2 Hypothesized mechanism underlying the D1-like DA receptor-mediated presynaptic depression
对于X区 Pd, DA同样具有非常重要的作用.DA通过激活D1R增加Pd自发动作电位发放频率,同时又能够降低刺激HVC所引起的Pd诱发反应.在体实验中发现,X区内注入D1R阻断剂会使鸣禽鸣曲的稳定性降低,即在雌鸟存在的情况下,雄鸟也无法产生更稳定的求偶性鸣唱[15].而鸣曲的稳定性,一直认为与AFP到RA的输入有关,损毁LMAN或LMAN→RA 的输入降低,都可以增加鸣曲的稳定性[16-18].所以有可能雄鸟在雌鸟存在时能够产生特异的求偶性鸣唱,正是由于输入到X区的DA发挥了功能,输入到X区的DA激活D1R调节SN和Pd的自发及诱发电生理反应,减少X区→DLM的信息传递,进而导致AFP的功能降低,减少了HVC→RA信息输入的干扰,产生了更稳定的求偶性鸣唱[13]. X区DA水平的变化也与该观点相符,SASAKI等[19]使用微透析的方法监视在斑胸草雀鸣唱过程中X区DA的释放量.发现以10 min间隔来抽样,鸣唱比安静时X区具有更高的DA水平;与非求偶性鸣唱相比,求偶性鸣唱过程中X区DA水平更高.一方面,可能是由于VTA-SNc复合体中DA神经元活动增加,使投射到X区的DA量增加;另一方面可能是由于投射到X区的DA神经元突触末梢DAT(DA 载体)对胞外DA重吸收功能的改变.在非求偶性鸣唱过程中,DAT快速的重吸收高水平的DA,而在求偶性鸣唱过程中,DAT的功能被最少化,使得X区维持高水平的DA.实验表明,阻断DAT可以使非求偶性鸣唱过程中DA水平增加,使得鸣禽的非求偶性鸣唱变得与求偶性鸣唱相似,消除了环境依赖性差异.同时,应用伏安法测量胞外DA浓度变化,发现在投射到X区的DA神经元突触末梢不仅具有DAT,还具有NET(NE载体),并且NET作用可能用来转运DA[20].在特定的环境中,正是由于上述2种机制维持了X区内DA高水平,而这些DA调控着X区神经元的活动,以及鸣唱通路中信息的传递,使鸣禽产生了特定的鸣唱行为.
3 DA 对RA神经元活动的调控
DAR不仅分布于X区,在RA和HVC中也有较高密度的分布,同时,中脑也有投射到RA和 HVC的DA神经元,特别是PAG内DA神经元只投射到RA和HVC.有研究指出,PAG中DA神经元的活动与鸣禽鸣唱行为表现出高相关性,通过对TH(酪氨酸羟化酶,DA合成的限速酶)和Fos(fos表达的产物,fos为鸣唱相关基因)的标记,发现在成鸟进行求偶性鸣唱中,PAG内TH水平与求偶性鸣曲产生数目相关[21];在幼鸟鸣唱学习中,PAG中TH-Fos的双表达与幼鸟对于教习曲的识别和学习密切相关[22].这些暗示了PAG中DA神经元的数量和活动参与鸣禽求偶性鸣唱产生和鸣唱的学习,而其调控作用的发挥可能是通过对RA或HVC中神经元活动的调控实现的.
RA位于弓状皮质背层下方的腹内侧,接受HVC和LMAN信息的双重传入.RA腹侧神经元的轴突投射到舌下神经运动神经元,支配鸣肌运动.RA背侧神经元的轴突投射到延髓外侧控制呼吸运动的区域.在非鸣唱情况下,RA神经元表现为一种紧张的起搏器样活动状态;鸣唱期间,这种活动模式则变化为一种与鸣曲的音节特征高度相关的相位模式.RA由投射神经元和中间神经元两类细胞构成,其突触连接形式多样.2类细胞均同时接受来自HVC和LMAN的谷氨酸兴奋性突触传入[23],并与其中的GABA中间神经元形成局部抑制性突触连接[24],与投射神经元的突触侧支形成局部兴奋性突触联系[25](图3).笔者实验室在研究RA 投射神经元和中间神经元的电生理学特性中发现,静息状态时,中间神经元自发放非常少或无,而投射神经元表现出规律性间隔自发放;注入去极化电流刺激时,中间神经元表现出高频动作电位串发放,频率随刺激强度增大而增大,而投射神经元诱发动作电位的发放频率较低,动作电位波宽也较大,并重叠于自发电位中;注入超级化电流刺激时,投射神经元表现出特有的内向整流现象[26].
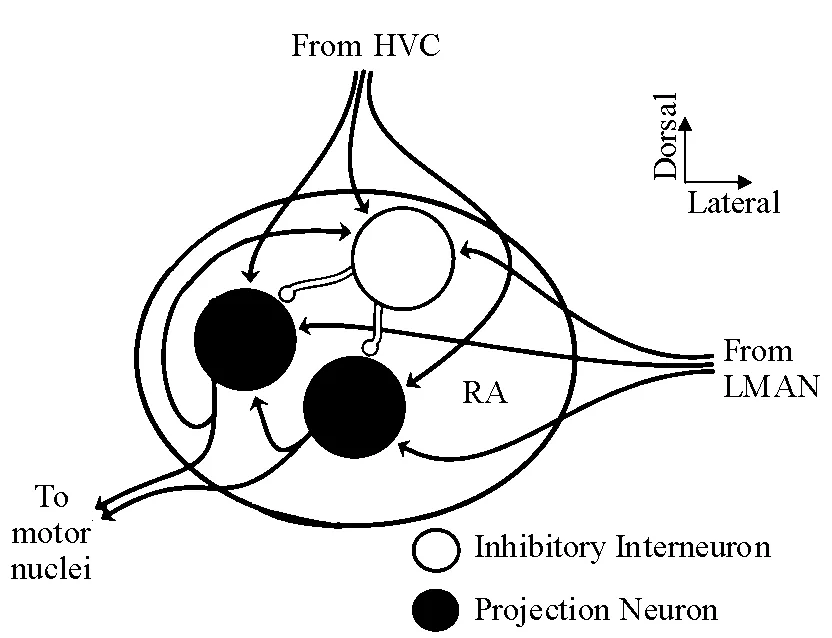
图3 RA内神经元间的突触联系
Figure 3 Synaptic connections between neurons in RA nucleus
鸣禽发声运动的指令由HVC产生,HVC神经元在鸣唱期间发出一些稀疏的非连续信号,与鸣曲基序有严格的时间对应关系,但如不经过进一步的加工处理,将无法驱动鸣肌产生连续性的鸣唱运动.作为HVC与脑干运动通路之间的联系核团,RA承担了这一信号转换的重要任务.场电位记录显示,鸣曲中音素和音节的发放模式与RA的电位发放活动正相关[27](图4).单细胞记录的结果显示,RA神经元在每次鸣曲基序期间可产生多次高频脉冲发放.这些脉冲发放的起始时间及发放模式与鸣曲的音节结构高度对应.RA神经元的这种鸣唱相关发放模式虽源自HVC投射到RA的神经元,但经过RA内大范围抑制性环路的作用,产生了有别于HVC神经元的电生理学特性.这种发放模式与鸣曲的音节结构直接相关,并作为输出信号传达到脑干运动通路,控制着鸣唱的产生[27].FEE等[28]也证实,在正常鸣唱期间刺激RA,将导致鸣唱行为出现短时混乱.所以,只要能够影响到RA神经元的电位发放就能够改变鸣禽的鸣唱行为.笔者采用全细胞膜片钳记录技术,注入200 pA,500 ms的去极化刺激,诱发RA投射神经元产生动作电位发放,发现在加入DA 5 min后,神经元诱发动作电位发放个数显著增加,表明DA能够显著提高RA投射神经元兴奋性,用D1R阻断剂处理,DA的这种易化作用消失,没有出现抑制作用,表明RA内可能只有D1R被DA激活,进而增加了RA投射神经元兴奋性.这与RA内DAR分布结果相一致,RA内主要有D1A、D1B和D3等3种受体分布,而D3受体的功能主要是在DA系统病理状态时,调节D1R和D2R间的平衡,是治疗DA系统疾病药物作用的靶点,所以在正常状态时,并不发挥显著作用[29].DA增加RA投射神经元的兴奋性对于鸣唱行为具有重要作用,RA投射神经元兴奋性的增加,可以使RA更准确地接收HVC和LMAN所传递的信息,进而更准确地调控鸣曲的产生.但是DA对于HVC和LMAN到RA的双重信息输入的调控作用以及RA内DA水平与鸣禽鸣唱行为的相关性,有待于进一步研究.
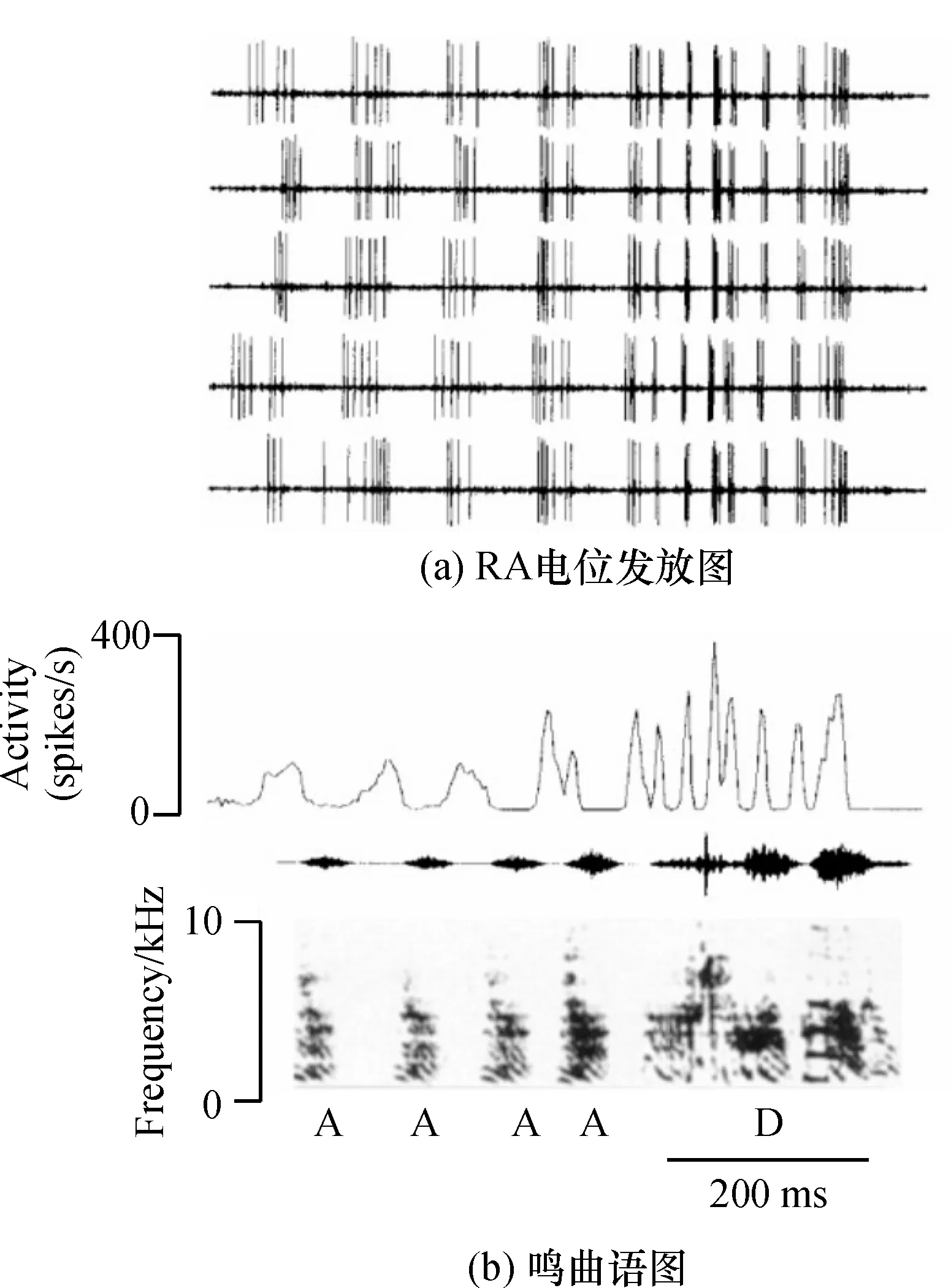
图4 鸣曲中音素和音节的发放模式与RA的电位发放活动相关
Figure 4 Element and syllable in song related to potentials fires in RA nucleus
鸣禽的鸣唱行为富于变化,幼鸟在鸣唱学习过程中,鸣唱高度不稳定,表现为音节序列和音节声学结构多变,成年后尽管鸣曲模式固定,但音节基频和响度等仍然表现出由于鸣唱目的不同而引起的改变,一般认为鸣唱行为的这种不稳定性是由于2条通路向RA信息输入的差异,HVC至RA的兴奋性突触输入会使鸣禽产生固定鸣曲模式,而来自LMAN到RA的兴奋性突触输入则引起鸣唱的变化[30].综上所述,可以得到这样的猜想,在特定环境(如雌鸟存在)下,鸣禽中脑DA神经元活动增加,导致投射到鸣唱控制核团中DA水平的增加,一方面,投射到X区的DA增加,减少X区下行信息的传递,导致整个AFP功能的降低即LMAN→RA输入的减少.另一方面,投射到RA的DA增加,增强RA投射神经元的兴奋性,提高RA对HVC信号输入的接收能力.两方面共同促使鸣禽产生了更稳定的求偶性鸣唱.另外,HVC作为鸣曲产生的起始核团,既具有DAR分布,又接收DA输入,很可能也接受着DA的调控,这种调控是否也参与到鸣唱稳定性的调控中,仍有待探讨.
[1] DOUPE A J, KUHL P K. Birdsong and human speech: Common themes and mechanisms [J]. Annu Rev Neurosci, 1999,22:567-631.
[2] APPELTANTS D, BALL G F, BALTHAZART J. The origin of catecholaminergic inputs to the song control nucleus RA in canaries [J]. Neuroreport, 2002, 13(5):649-653.
[3] LYNCH K S, DIEKAMP B, BALL G F. Catecholaminergic cell groups and vocal communication in male songbirds [J]. Physiol Behav, 2008, 93(4/5):870-876.
[4] KUBIKOVA L, KOSTL L. Dopaminergic system in birdsong learning and maintenance [J]. J Chem Neuroanat, 2010, 39(2):112-123.
[5] GALE S D, PERSON A L, PERKEL D J. A novel basal ganglia pathway forms a loop linking a vocal learning circuit with its dopaminergic input [J]. J Comp Neurol, 2008, 508(5):824-839.
[6] 潘璇, 李东风. 中脑多巴胺能神经元与鸣禽鸣唱行为[J]. 生理科学进展, 2011,42(1):72-74.
[7] MISSALE C, NASH S, ROBINSON S,et al. Dopamine receptors: from structure to function [J]. Physiol Rev, 1998, 78:189-225.
[8] KUBIKOVA L, WADA K, JARVIS E D. Dopamine receptors in a songbird brain [J]. J Comp Neurol, 2010, 518(6):741-769.
[9] 王晓东, 肖鹏, 李东风. 鸣禽前脑X区结构功能的研究进展[J]. 动物学研究, 2005,26(3):332-336.
[10] DING L, PERKEL D J. Dopamine modulates excitability of spiny neurons in the avian basal ganglia [J]. J Neurosci, 2002, 22(12):5210-5218.
[11] DING L, PERKEL D J, FARRIES M A. Presynaptic depression of glutamatergic synaptic transmission by D1-like dopamine receptor activation in the avian basal ganglia [J]. J Neurosci, 2003, 23(14):6086-6095.
[12] 孟玮,廖素群,肖鹏,等. 鸟类神经系统的长时程增强[J]. 心理科学进展, 2005,13(3):333-340.
[13] DING L, PERKEL D J. Long-term potentiation in an avian basal ganglia nucleus essential for vocal learning [J]. J Neurosci, 2004, 24(2):488-494.
[14] HARDING C F, BARCLAY S R, WATERMAN S A. Changes in catecholamine levels and turnover rates in hypothalamic, vocal control, and auditory nuclei in male zebra finches during development [J]. J Neurobiol, 1998, 34(4):329-346.
[15] LEBLOIS A, WENDEL B J, PERKEL D J. Striatal dopamine modulates basal ganglia output and regulates social context-dependent behavioral variability through D1receptors [J]. J Neurosci, 2010, 30(16):5730-5743.
[16] KAO M H, DOUPE A J, BRAINARD M S. Contributions of an avian basal ganglia forebrain circuit to real-time modulation of song [J]. Nature, 2005, 433(7026):638-643.
[17] KAO M H, BRAINARD M S. Lesions of an avian basal ganglia circuit prevent context-dependent changes to song variability [J]. J Neurophysiol, 2006, 96(3):1441-1455.
[18] OLVECZKY B P, ANDALMAN A S, FEE M S. Vocal experimentation in the juvenile songbird requires a basal ganglia circuit [J]. PloS Biol, 2005, 3(5):e153.
[19] SASAKI A, SOTNIKOVA T D, GAINETDINOV R R, et al. Social context-dependent singing-regulated dopamine[J]. J Neuroscie, 2006, 26(35):9010-9014.
[20] GALE S D, PERKEL D J. Properties of dopamine release and uptake in the songbird basal ganglia [J]. J Neurophysiol, 2005, 93(4):1871-1879.
[21] GOODSON J L, KABELIK D, KELLY A M, et al. Midbrain dopamine neurons reflect affiliation phenotypes in finches and are tightly coupled to courtship[J]. Proc Natl Acad Sci U S A, 2009, 106(21):8737-8742.
[22] NORDEEN E J, HOLTZMAN D A, NORDEEN K W. Increased fos expression among midbrain dopaminergic cell groups during birdsong tutoring [J]. Eur J Neurosci, 2009, 30(4):662-670.
[23] 孟玮, 顾兵, 李东风. 鸣禽端脑发声运动通路的电生理学特性[J]. 生物物理学报, 2010,26(6): 447-456.
[24] MOONEY R, PRATHER J F. The HVC microcircuit: The synaptic basis for interactions between song motor and vocal plasticity pathways [J]. J Neurosci, 2005, 25(8):1952-1964.
[25] SPIRO J E , MATTHEW B D , MOONEY R. Long-range inhibition within the zebra finch song nucleus RA can coordinate the firing of multiple projection neurons[J].J Neurophysiol,1999,81:3007-3020.
[26] LIAO S Q, HOU G Q, LIU X L, et al. Electrophysiological properties of neurons in the robust nucleus of the arcopallium of adult male zebra finches[J]. Neurosci Lett, 2011, 487(2):234-239.
[27] YU A C,MARGOLIASH D. Temporal hierarchical control of singing in birds[J]. Science, 1996,273: 1871-1875.
[28] FEE M S, KOZHEVNIKOV A A, HAHNLOSER R H. Neural mechanisms of vocal sequence generation in the songbird [J]. Ann N Y Acad Sci, 2004, 1016:153-170.
[29] 和友, 金国章. 多巴胺D3受体(D3R)的神经科学新进展[J]. 生命科学, 2005,2(17):170-175.
[30] THOMPSON J A, JOHNSON F. HVC microlesions do not destabilize the vocal patterns of adult male zebra finches with prior ablation of LMAN [J]. Dev Neurobiol, 2007, 67(2):205-218.
Keywords: DA; songbirds; X area; RA; electrophysiological activity
TheControlofDopaminetoVocalRelatedNeuronsinSongbirds
PAN Xuan, LIAO Congshu, LI Dongfeng*
(School of Life Science, South China Normal University, Guangzhou 510631, China)
Dopamine (DA) neurons distributed throughout VTA-SNc and PAG (the ventral tegmental area, the substantia nigra pars com-pacta, the periaque-ductal gray) of midbrain in songbirds, and projected to X area, the robust nucleus of the archistriatum (RA) and the high vocal center (HVC). In recent years, research showed that dopaminergic inputs to the forebrain regulate the activity of neurons in song system, and control the song behavior.This paper reviewed progress in this field.
2011-09-05
国家自然科学基金项目(30970363;31172092)
*通讯作者, dfliswx@126.com
1000-5463(2012)01-0001-05
Q495
A
【责任编辑 庄晓琼】

