乙草胺、丁草胺及其复合污染对浮萍的毒性效应研究
梁卫玲,唐美珍,王艳娜
(曲阜师范大学 生命科学学院,山东 曲阜273165)
1 引言
浮萍(Lemna s p p)为漂浮水生维管束植物,全球分布广泛,是一种有效的环境监测植物[1~7],常被用于植物生理学研究。近年来,国外诸多学者已经对浮萍在水生生态毒理学方面的应用进行了深入的探究[1~4],浮萍的保存方法以及与其相关的实验方法也已报道,而在国内,以浮萍作为毒理学材料的研究和应用并不多。目前,国内外关于农药对藻类的毒性效应研究已经比较全面,但一般为研究单一毒物对浮萍的生长抑制试验[7~9],关于农药的复合污染对浮萍生长抑制实验的研究尚少。
POD是植物体内重要的氧化还原酶,可催化有毒物质如活性氧等的氧化分解,是反映污染胁迫的灵敏指标。当农药进入植物组织后,产生的有毒物质在POD酶正常分解能力范围内时,POD活性会随酶底物浓度的增加而提高;当POD活性降低时表明有毒物质浓度已超出其正常分解能力,使活性氧自由基浓度上升,对植物产生伤害。
本实验以我国广泛使用的除草剂乙草胺及丁草胺为供试农药,以浮萍为研究对象,以POD活性为测定指标,探究了乙草胺和丁草胺单独作用与复合作用对浮萍POD活性的影响,为利用浮萍监测水体污染提供科学的依据,同时也为酰胺类农药对水生植物的毒性效应作出科学的评价。
2 材料与方法
2.1 实验材料
2.1.1 浮萍的采集
春季5月份在曲阜沂河中采集的浮萍(Lemna s p p)。
2.1.2 实验试剂
乙草胺(山东乐邦化学品有限公司生产的50%的乙草胺乳油),丁草胺(营口三征农药厂生产的48% 的丁草胺乳油)。
2.2 实验方法
2.2.1 浮萍的培养
将采集的浮萍放入已曝气的澄清自来水中,每天进行适当的光照,于20±2℃下驯养3d。实验前选取外形完好、形状和大小都相近的三叶状萍体作为实验材料。
2.2.2 毒性实验的方法
(1)单一毒物毒性实验。以预备实验的探究为基础,确定设置6个浓度梯度,1个空白对照,以从天然水体中采集的水为溶剂。准备容积为1L的烧杯7个编号为1、2、3、4、5、6和7,在各烧杯中放入含1.02g/mL乙草胺的处理液0mL、0.5mL、1.5mL、3mL、5mL、15 mL和45mL;准备另外的7个容积为1L的烧杯,编号为 A、B、C、D、E、F和 G,在各烧杯中加入1.04g/mL丁草胺的处理液0mL、1mL、1.5mL、4.5mL、10mL、15m和20mL。在每个烧杯中放入240个植物体(80个三叶状体),在于培养条件相同温度(20±2℃),相同的光照条件下连续培养,每隔两天取样测定POD的活性,重复三次实验过程,以保证实验数据的可靠性。
(2)联合毒性试验。在单一毒性试验的基础上,按乙草胺和丁草胺的处理液体积比1∶1进行联合毒性试验,其实验过程和测试指标的时间间隔和方法与单一毒物毒性实验完全相同。
2.2.3 酶液的制备
称取0.1g浮萍放入玻璃研钵中,加适量磷酸缓冲液,快速研磨使其成为匀浆,所得的匀浆转移到50mL的容量瓶中,蒸馏水定容摇匀后,静置30min,用干滤器滤入干瓶中,并且弃去最初滤下的5~10mL滤液,得到的上清液即为所需的酶液。
2.2.4 POD测定方法
(1)银标准曲线的绘制。取7支试管,每支试管中分别加入0.5g/L 的硝酸银溶液0.1mL、1mL、2mL、3mL、4mL、5mL和6mL,分别加蒸馏水至8mL混匀,再分别加入0.3%愈创木酚溶液1mL后混匀。将试管置于22℃的水浴锅中进行水浴加热,当试管中的温度达到22℃时开始计时,每间隔1min按编号顺序向一个试管中加入3%的过硫酸铵溶液1mL,摇匀后继续水浴加热,直到第一个试管加入过硫酸铵达到15min后,在440nm波长处,以蒸馏水为空白对照,测定第一个试管的吸光度,之后每间隔1min按编号顺序测定一个试管中酶液的吸光度,根据所测的吸光度值绘制标准曲线[10](图1)。
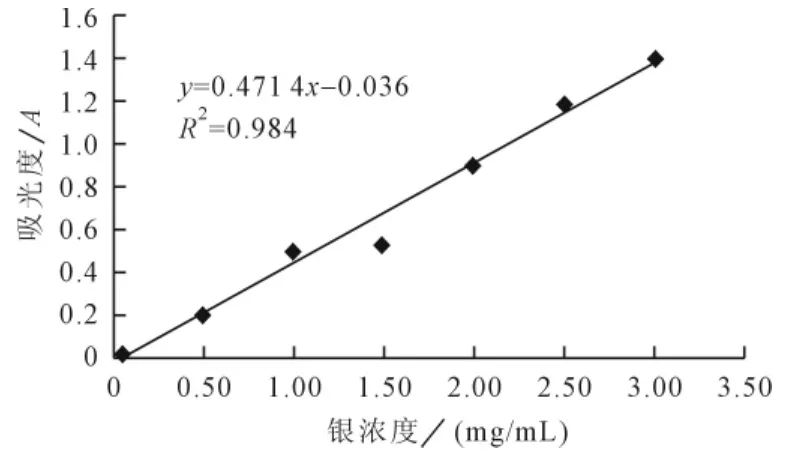
图1 银标准曲线
(2)POD活性的测定。用移液管精确吸取制备好的酶液1mL,置于干燥试管中,加蒸馏水8mL,混匀后加入1mL0.3%愈创木酚,摇匀,22℃下水浴加热。当试管中酶液的温度达到22℃时,加入0.05mol/L的过氧化氢溶液1mL,立即摇匀,继续水浴加热,待加入过氧化氢15min后,在440nm波长下,以蒸馏水为空白对照测定其吸光度值。同时取1mL上清夜,加入9mL蒸馏水,混匀,浸入22℃的水浴中,进行同样的测定,以作参比液。根据所测吸光度值在标准曲线上查出对应的Ag浓度。
3 结果与分析
3.1 POD活性的计算
根据所测的吸光度值,由银标准曲线计算出相应的银浓度C依据下面公式得出浮萍POD的活性A:
A=50×10×2.53×C/(15×1×G)=84.3×C/G
式中A为22℃下POD活性mg/(g×min);C为由银标准曲线求得的银浓度mg/mL;G为制备酶液所取浮萍重量g。
3.2 乙草胺对浮萍过氧化物酶活性的影响
由POD活性计算公式求出乙草胺下列浓度0、2.55mg/L、7.65mg/L、15.3mg/L、25.5mg/L、76.5mg/L和229.5mg/L各作用于浮萍2d、4d、6d和8d时对POD活性的影响如图2所示。

图2 乙草胺对浮萍POD活性的影响
由图2可知,乙草胺对浮萍POD活性的影响与时间和乙草胺的浓度密切相关。第2天,低浓度时随浓度的增加POD活性增强,在浓度为7.65mg/L时达到最大值为363.64,之后随浓度的增加POD活性降低,最终达到稳定,原因可能是浓度达到7.65mg/L左右时超过了浮萍的耐受限度使浮萍受到损伤,从而POD活性降低;第4天,POD活性随乙草胺浓度变化的规律性并不强,呈现忽高忽低的状态,具体原因有待进一步研究;第6天和第7天,浓度低于76.5mg/L时POD活性一直随浓度增加降低,达到76.5mg/L时POD活性呈现明显的上升趋势,但浓度继续增加时POD活性有大幅度的下降,可能是由于长时间接触高浓度农药使浮萍产生适应性,从而改变了其抗性,而浓度过高又不利于浮萍生存。
从总体来看,实验初期,低浓度的乙草胺能够促进浮萍POD的活性,高浓度的乙草胺则抑制浮萍POD的活性,但随着时间的推移,促进作用逐渐消失,POD的活性表现为逐渐下降;实验后期,浓度为76.5mg/L的乙草胺对POD活性影响与其他浓度不同,又产生了稍微的促进作用。根据空白对照计算得出农药对浮萍POD活性的影响率(抑制率或促进率),具体数据见表1,表中-表示抑制率;+表示促进率。
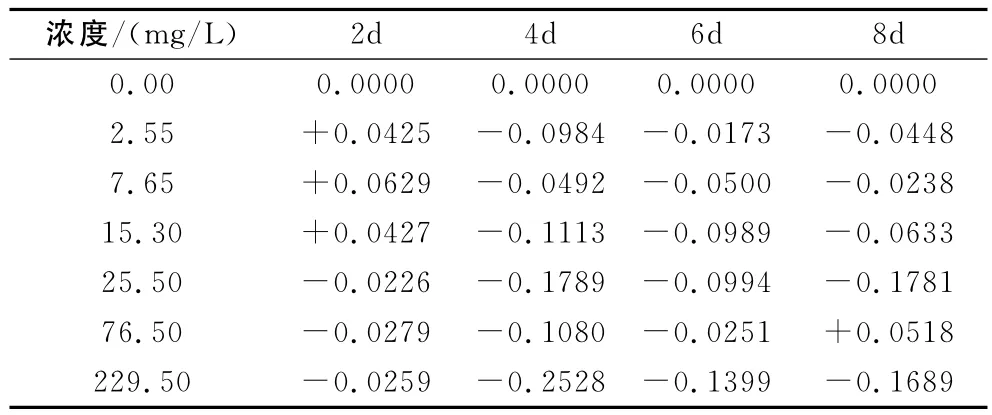
表1 乙草胺对浮萍POD活性的影响率
由上表可以得出,当乙草胺浓度为7.65mg/L时,乙草胺对浮萍POD的激活率最大,为6.29%,当其浓度为229.50mg/L时,乙草胺对浮萍POD的抑制率最大,可达25.28%。乙草胺对浮萍POD活性的影响在浓度低于15.3mg/L时总体表现为在第2天有不同程度的促进作用,使POD活性高于对照组,随时间的推移促进作用消失,当浓度继续增大促进作用消失。
3.3 丁草胺对浮萍过氧化物酶活性的影响
同乙草胺一样由POD活性计算公式求出丁草胺下列 浓 度 0、2.496mg/L、3.744mg/L、11.232mg/L、24.96mg/L、37.44mg/L和49.92mg/L各作用于浮萍2d、4d、6d和8d时对POD活性的影响如图3所示。

图3 丁草胺对浮萍POD活性的影响
由图3可知,实验的第2天和第8天,随着丁草胺浓度的增加,POD的活性都呈现先增加然后逐渐降低的状态,可能的原因是低浓度的丁草胺促进了POD的活性,而浓度增加到一定程度又反过来抑制POD的活性;第4天,随着丁草胺浓度的增加,POD的活性逐渐降低,可能的原因是浮萍尚未适应所处的丁草胺的环境;第6天,随丁草胺浓度的增加,POD的活性先增后减,然后再增加,最后逐渐减小,可能的原因是对环境的适应能力存在个体间的差异,导致所测的数据没有规律可循。
总的来说,丁草胺对POD的活性的影响随着丁草胺浓度的增加基本呈现先增加然后逐渐降低的趋势,由此可知,低浓度的丁草胺可以促进POD的活性,而高浓度的丁草胺则抑制POD的活性。根据空白对照计算得出农药对浮萍POD活性的影响率(抑制率或促进率),具体数据见表2,表中-表示抑制率;+表示促进率。
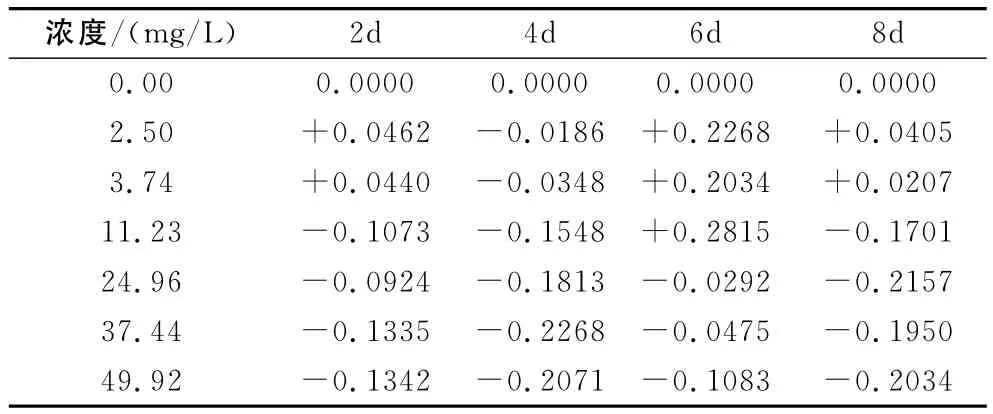
表2 丁草胺对浮萍POD活性的抑制率
根据表2可得,当丁草胺浓度为2.50mg/L时,丁草胺对浮萍POD的激活率最大,为22.68%,当其浓度为37.44mg/L时,丁草胺对浮萍POD的抑制率最大,可达22.68%。在浓度为2.50mg/L和3.74mg/L时,除第4天均表现为促进作用,浓度增大后基本表现为抑制作用。
3.4 乙草胺-丁草胺复合污染对浮萍过氧化物酶的活性影响
同乙草胺、丁草胺单独作用于浮萍一样,由POD活性计算公式求出乙草胺-丁草胺复合作用下浮萍在2 d、4d、6d、8d相应的POD活性值如图4所示。
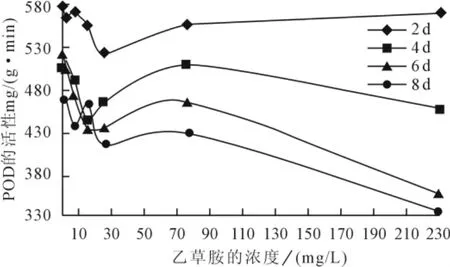
图4 乙草胺-丁草胺对浮萍POD活性的影响
由图4曲线可以看出,在实验的第2天、第4天、第6天,随着乙草胺-丁草胺混合浓度的增加,POD活性逐渐降低,但当浓度增加到76.5mg/L时POD活性又有增加的趋势,可能的原因是高浓度的乙草胺和丁草胺相互作用从而促进了POD的活性,但随着时间的推移促进的幅度降低;第8天,在混合浓度为15.3mg/L和76.5mg/L处,都对POD活性产生促进作用,但前者促进的幅度较后者大,可能的原因是随着时间的推移,浮萍对环境的适应能力增强,从而使得在较低混合浓度处也对POD活性产生促进作用。
从整体来看,随着乙草胺-丁草胺混合浓度的增加,POD活性呈现逐渐降低的趋势,而在高浓度时,却对POD活性起促进作用,可能的原因是高浓度的乙草胺和丁草胺都对POD活性起抑制作用,但两种作用是拮抗关系相互抑制,从而降低了抑制的程度。根据空白对照计算得出农药对浮萍POD活性的影响率(抑制率或促进率),具体数据见表3,表中-表示抑制率;+表示促进率。
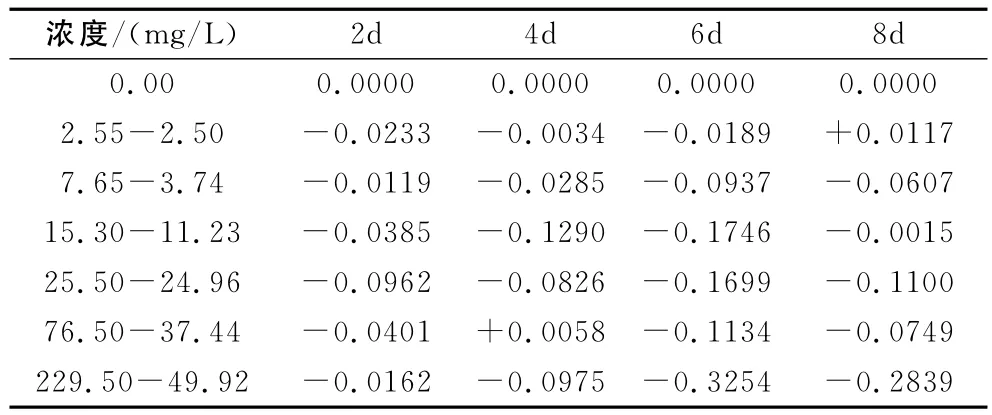
表3 乙草胺-丁草胺对浮萍POD活性的抑制率
由表3可知,乙草胺-丁草胺的复合污染对浮萍POD的活性基本上为抑制作用,且当乙草胺浓度为229.5mg/L,丁草胺浓度为49.92mg/L时,乙草胺-丁草胺对浮萍POD活性的抑制率最大可达32.54%;当混合浓度分别15.30~11.23mg/L,在第8天呈现出最低抑制率仅为0.15%。随时间及浓度的改变,并没有很强的规律性,可能是由于两种农药相互作用的结果。
4 结语
(1)根据试验结果得出丁草胺对浮萍的毒性大于乙草胺。一般表现为低浓度时有促进作用,浓度增加后促进作用逐渐消失,当浓度增加到一定程度又会表现相对的抑制作用减弱,甚至会出现促进作用。
(2)乙草胺-丁草胺的复合污染对浮萍POD的活性的影响在高浓度时表现出拮抗作用,各复合浓度的影响基本表现为抑制作用,具体的数据规律性并不强,可能是由于农药之间的相互作用,有待进一步的研究。
[1] 何 文,郭正元,贺仲兵.异恶草酮对三叶浮萍的毒性研究[J].贵州农业科学,2006,34(1):71~72.
[2] 张 莉,王友保,刘登义.利用浮萍检测Cu、As及其复合污染的植物学毒性[J].安徽师范大学学报,2001.24(4):392~394.
[3] 徐 楠,施国新,杜开如,等.Hg、Cd及其复合污染对浮萍叶片的毒害研究[J].南京师范大学学报,2002,25(3):109~115.
[4] 马剑敏,杜晋立,吴晶敏,等.Hg~2DBS对浮萍伤害研究[J].河南师范大学学报,2001,29(1):114~116.
[5] Wang W.Review:Literatures review on duckweed toxicity testing[J].Environ Rev,1990(52):7~22.
[6] Wang W.Literature review on higherp lants for toxicity testing[J].Wat,Air and SoiL PoLLut,1991(59):381~400.
[7] Zhang Tong,Jin Hongjun.Phyto toxicity evaluation of four pollution by lemna minor test[J].Chinae nvironm ental Science,1995,15(4):266~270.
[8] Fairchild J F,Ruessler D S,Hverland P S,et al.Comparativesensitivity Selenastrum caprI Cornutum and Lemna minor to six 2teen herbicides[J].Arch Environ Contam Toxicol,1997(57):353~357.
[9] 张 莉,王友保,刘登义.Phyto toxicity evaLuation of Cu,As and their combination pollution by Lemna minor test[J].JournaL of Anhui Norma Luniversity,2001,24(4):392~395.
[10] 杜荣骞.生物统计学[M].北京:高等教育出版社,2003.

