光纤传感过程分析法评价不同厂家氨茶碱片的体外溶出度Δ
王艳,丁海燕,李新霞,李莉,郑立民(.新疆医科大学药学院,乌鲁木齐8 3 0 0 ;2.新疆医科大学第五附属医院,乌鲁木齐 8 3 0 0 )
光纤传感过程分析法评价不同厂家氨茶碱片的体外溶出度Δ
王艳1*,丁海燕1,李新霞1,李莉1,郑立民2#(1.新疆医科大学药学院,乌鲁木齐8 3 0 0 1 1;2.新疆医科大学第五附属医院,乌鲁木齐 8 3 0 0 1 1)
目的:采用光纤传感过程分析法评价不同厂家氨茶碱片的体外溶出度,以考察不同厂家样品的质量差异。方法:采用对照品法,对5个厂家的片剂在4种溶出介质(水、pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液)中的溶出行为进行测定,并以相似因子法进行比较。结果:氨茶碱片在不同溶剂中的溶出行为不一致,只有B厂样品在4种介质中均具有较好的溶出度;以B厂样品为参比制剂,其他4个厂样品与其比较的相似因子值均小于5 0%。结论:光纤传感过程分析法能够准确、方便地提供药物的溶出数据、反映药物的溶出行为,为全面考察药物的内在质量提供了良好的检测手段;不同厂家氨茶碱片质量有明显差异。
光纤传感过程分析法;氨茶碱片;厂家;体外溶出度
氨茶碱是临床常用的支气管扩张药,文献[1]报道其溶出度在某种程度上与生物利用度呈现一定的相关性,美国FDA规定,对于体外溶出度和体内生物利用度相关的药物,可以用体外溶出度试验替代体内生物利用度试验进行生物等效性评价[2]。
光纤传感过程分析(FODT)能获取连续的溶出曲线,可以实现对药物整个溶出过程的监测。笔者采用FODT法对市售的5个厂家的氨茶碱片在4种溶出介质中的溶出度进行了考察,并且按照国家食品药品监督管理局颁布的“药品评价抽验质量分析指导原则”(简称“指导原则”)[3],采用相似因子(f2)法对其进行溶出过程比较,以期为药品生产和临床用药提供参考。
1 仪器与试药
1.1 仪器
Cintra4 0 4紫外-可见分光光度计(澳大利亚GBC公司);AB1 3 5-S电子天平(瑞士梅特勒-托利多公司);FODT-6 0 1光纤药物溶出度过程监测仪(简称FODT监测仪,新疆富科思生物技术有限公司)。
1.2 试药
茶碱对照品(成都曼斯特科技有限公司,批号:MUST-1 0 0 9 2 2 0 1,纯度:9 8.2 0%);氨茶碱片(A厂生产,简称A片,批号:0 9 1 1 0 1;B厂生产,简称B片,批号:B1 1 2 0 1;C厂生产,简称C片,批号:1 0 0 9 0 5;D厂生产,简称D片,批号:2 0 1 1 0 3 0 4;E厂生产,简称E片,批号:1 0 0 3 0 5。规格均为:每片1 0 0 mg);氯化钠、盐酸、冰醋酸、醋酸钠、磷酸二氢钾等均为分析纯。
2 方法与结果
2.1 溶液的制备
精密称取茶碱对照品0.5 5 4 3 g,用水(简称a)溶解并定容至2 5 0mL,制备成贮备液。分别精密量取贮备液1 0、2 0、3 0、4 0、5 0、6 0 mL置于1 0 0 mL量瓶中,并用a稀释至刻度,得到质量浓度分别为2 2.1 7、4 4.3 4、6 6.5 2、8 8.6 9、1 1 0.8 6、1 3 3.0 3 mg·L-1的氨茶碱系列水溶液,相当于2 0.4%、4 0.9%、6 1.3%、8 1.7%、1 0 2.1%和1 2 2.6%的药物溶出度[4]。以pH 1.2盐酸溶液(b)、pH 4.5醋酸盐缓冲液(c)和pH 6.8磷酸盐缓冲液(d)[5]作为溶出介质的氨茶碱系列标准溶液的制备方法同上。
2.2 FODT测定条件的选择
2 0 1 0年版《中国药典》(以下简称药典)氨茶碱片溶出度测定方法[6]的处理过程需要加0.1 mol·L-1的氢氧化钠溶液以稳定氨茶碱溶液,因此改变了氨茶碱的最大吸收波长;而光纤药物溶出度过程监测仪可实现药物溶出过程的原位、实时监测,省去手工取样的烦琐,可快速检测,因此采用FODT测定氨茶碱片的溶出度,不需要加氢氧化钠溶液。
用a制备茶碱对照品溶液(1 0 mg·L-1),在FODT监测仪上扫描吸收光谱,结果显示最大吸收波长为2 7 1 nm(药典方法规定为2 7 5nm),因此本法选择2 7 1nm作为测定波长,并选择5 5 0nm作为参比波长,进行双波长空白校正。标示量为1 0 0 mg的氨茶碱片完全溶解在8 0 0mL溶出介质中,质量浓度为1 2 5 mg·L-1,根据Lambert-Beer定律,分别考察1.0、2.0 mm光程时的吸光度与浓度的关系。结果,当光程为2.0 mm(探头规格为1.0mm)时,吸光度与浓度呈较好的线性关系。综上所述,FODT的测定条件为:测定波长2 7 1 nm,参比波长5 5 0 nm,探头规格1.0 mm,测定光程2.0 mm;另,取样间隔确定为3 0 s。
2.3 方法学考察
2.3.1 标准曲线制备。打开FODT系统,进入其中的“标准品测定”模式下分别测定“2.1”项下4种溶出介质中系列标准溶液的吸光度,并进行线性回归,系统自动生成标准曲线。在4种溶出介质中六通道的标准曲线方程见表1(A为吸光度,c为浓度)。

表1 茶碱在4种溶出介质中的标准曲线方程Tab 1 Standard curves of aminophylline in 4 kinds of mediums
2.3.2 精密度与回收率试验。按相关方法进行考察,结果日内及日间RSD分别为0.6%和1.6%(n=6)。低、中、高浓度(2 2.1 7、6 6.5 2、1 1 0.8 6mg·L-1)平均回收率分别为 9 7.6%、9 7.5%、9 8.1%,RSD分别为3.0%、2.8%、2.4%。
2.4 溶出度测定
在FODT系统的“溶出度测定”模式下,参照药典氨茶碱片溶出度测定方法[6],采用篮法,分别测定溶出介质为a、b、c、d时的溶出度。介质体积均为8 0 0 mL,转速为1 0 0 r·min-1,温度为3 7℃。取6片投入转篮置于溶出杯中,设置测定波长为2 7 1 nm、参比波长为5 5 0 nm、监测时间为4 5 min,计算机实时监测氨茶碱片的溶出过程,获得溶出曲线。
2.5 FODT法与药典法溶出度结果的比较
为了验证本方法与药典方法是否一致,在采用FODT监测氨茶碱片在a中溶出度的同时,于紫外分光光度仪上,按照药典法进行对照试验,将FODT系统获得的溶出数据与药典法数据比较。经过统计学分析,FODT法与药典法所检测的氨茶碱片的溶出度结果差异无统计学意义(溶出度均值为9 7.0%、9 6.5%,RSD为1.8%、2.1%,P>0.0 5)。
2.6 不同介质中氨茶碱片的溶出曲线
将5个厂家的氨茶碱片分别在4种溶出介质中的溶出曲线列于同一坐标进行比较。结果显示,只有B厂生产的氨茶碱片在4种溶出介质中具有相同的溶出趋势和溶出行为,1 5 min时溶出度均达到8 5%以上;而其他4个厂样品在4种溶出介质
中的溶出曲线差异较大,详见图1。
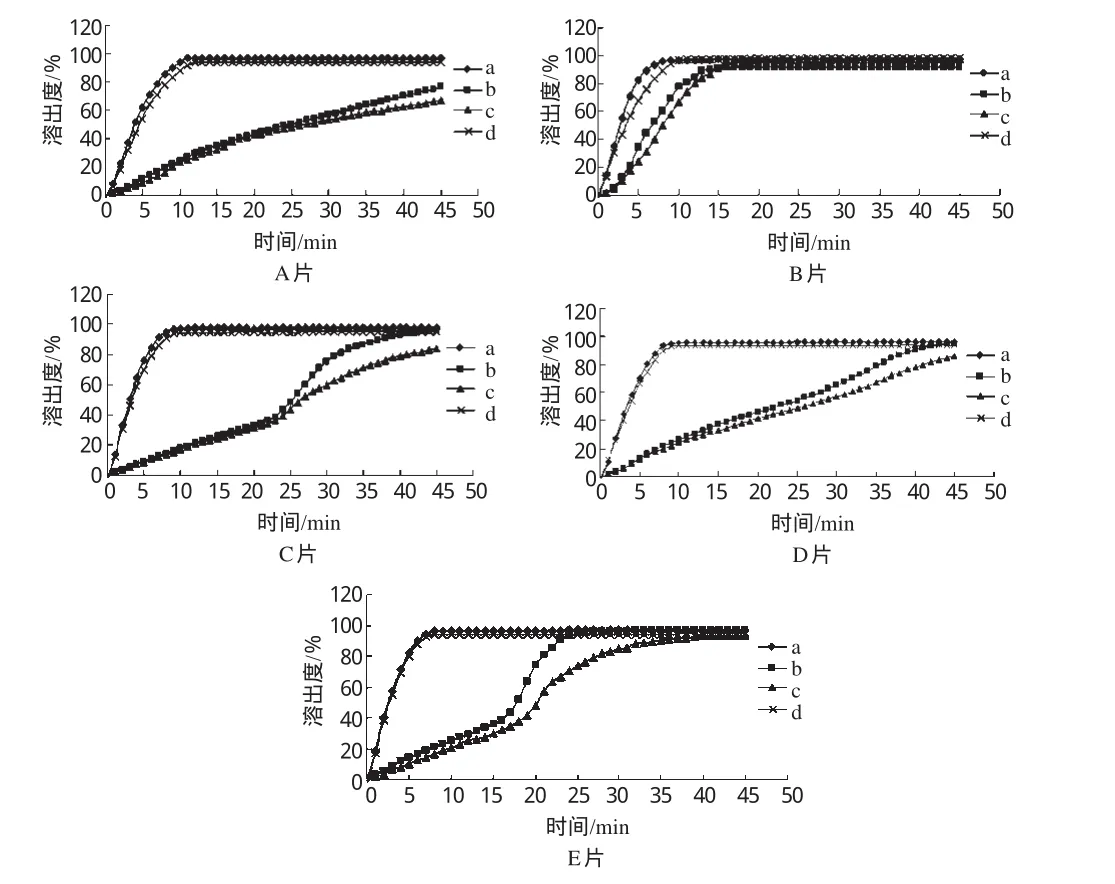
图1 样品在4种溶出介质中的溶出曲线Fig 1 Dissolution curves of tablets in 4kinds of mediums
2.7 相同介质中不同厂家的溶出曲线
将5个厂家的氨茶碱片在同一介质中的溶出曲线列于同一坐标进行比较,详见图2;同时由FODT系统实时数据提取1 0 min时(药典规定检测时间为1 0 min)5个厂同一批号的6片氨茶碱片的溶出度均值(n=6),详见表2。
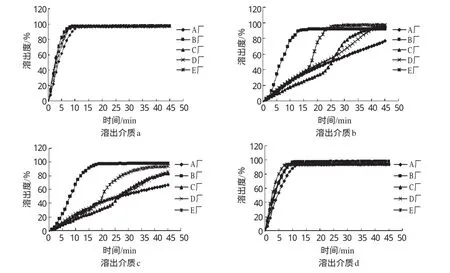
图2 4种溶出介质中5厂家样品的溶出曲线Fig 2 Dissolution curves of tablets from 5 manufacturers in 4kinds of mediums
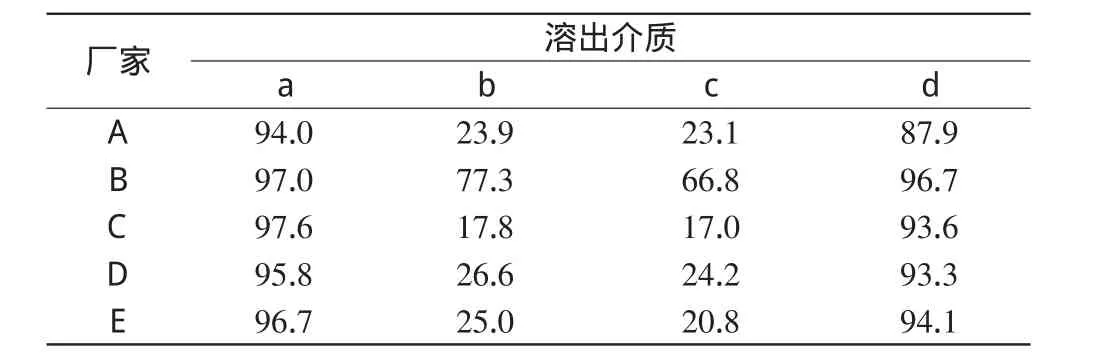
表2 5厂家样品10min时在4种溶出介质中的溶出度(%%)Tab 2 Dissolution rate of tablets from 5 manufacturers in 4 kinds of mediums at 10min(%%)
2.8 比较溶出过程的f2值考察
“指导原则”[3]规定在使用f2法时,若参比制剂与受试制剂在1 5 min内溶出均达到8 5%,则勿需进行溶出过程比较。在本研究中,采用溶出介质a、d时,5个厂的氨茶碱片的溶出度在1 5 min内均达到8 5%以上,不需进行比较,认为彼此相似。因此,在溶出介质a、d中,5个厂的氨茶碱片体外溶出曲线相似,体内具有生物等效性。
不同厂家的氨茶碱片在溶出介质b、c中的溶出过程的比较,选择了本研究中在各溶出介质中溶出曲线类型稳定、溶出度符合药典要求的B片作为参比制剂。FODT系统可以自动提取参比制剂和受试制剂的溶出数据进行f2值比较,计算机系统记录并统计出参比制剂与受试制剂的平均溶出曲线,参比制剂溶出1 0%、3 0%、5 0%、7 0%和9 0%的时间以及各个时间点的溶出度均值和RSD,并以这5个时间点数据进行分析,计算f2值。以在溶出介质c中受试制剂C片与参比制剂B片的比较为例,比较结果的系统界面如图3所示。
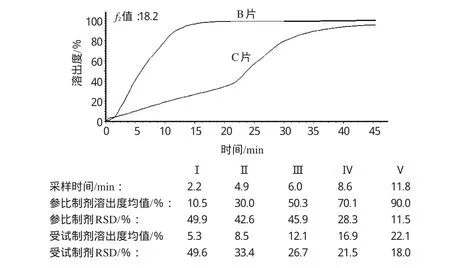
图3 B片与C片的f2比较的系统界面Fig 3 Interface for comparison of f2of B and C tablets
由图3可见,参比制剂由于其片间差异较大,不符合f2法比较的条件,但是为了表达f2值,在假设B片符合参比制剂要求的情况下进行比较。结果,在溶出介质c中,A、C、D、E片的f2值分别为2 0.1、1 8.2、2 1.2、2 1.0;在溶出介质d中,A、C、D、E片的f2值分别为2 0.9、1 8.2、2 2.2、2 1.4,溶出差异较大,溶出过程均不相似。
3 讨论
3.1 FODT法与药典法的比较
氨茶碱片属于快速释放药物,采用药典的溶出度测定方法测定要经过人工取液、过滤、稀释,再进行紫外测定,操作步骤多且过程复杂,误差较大。FODT法采用双波长法可消除赋形剂的干扰,无需过滤;通过调节光程来调节药物的吸光度,减少了稀释环节。因此FODT法省去了人工取液、过滤和稀释的操作步骤,即节省了时间又减少了人为操作的误差,实现了速释制剂的原位、实时、在线的过程分析。本试验对5厂样品在4种溶出介质中的溶出行为都进行了考察。如果采用药典法,工作量大且操作复杂;而FODT法能准确、方便地提供药物的溶出数据、反映药物的溶出行为,为全面考察药物的内在质量提供了良好的检测手段。
3.2 溶出介质的影响
药物主要在消化道吸收,由于人体内环境千差万别,故消化道内的体液pH值也各不相同。优质的药品应不受pH值的影响,在各种环境下均能有所释放,从而被吸收[7]。由溶出曲线可以看出,B厂样品在4种溶出介质中均具有良好的溶出性,4条溶出曲线基本一致,1 5 min时溶出度已达到8 5%以上,这说明该厂的制剂工艺制得的氨茶碱片无论在何种人体环境下均有良好的释放和吸收,对于各种年龄和各种体质的人群均具有良好的生物利用度;而其他4厂样品在4种溶出介质中的溶出行为不同,因此这4个厂家生产的氨茶碱片用于不同的患者,生物利用度可能不同。
总体上,5厂样品都在溶出介质a、d中溶出较完全(药典规定的溶出介质为a),均符合药典规定的限度要求(1 0 min内溶出度不低于标示量的6 0%);而在溶出介质b、c中,5厂样品存在较大的差异,溶出曲线各异,除B厂外,其他厂家均达不到药典的限度要求。这可能是因为溶出介质d与a的pH接近,所以在这2种溶出介质中表现出一致的溶出趋势。由于药典规定的溶出介质为a(水),5厂样品在溶出介质a、d中均有较好的溶出行为;而对于药典没有要求的溶出介质,则溶出较差。
3.3 溶出过程及生物等效性评价
“指导原则”[3]规定,在使用f2法时,要求每个制剂做1 2片(粒),参比制剂与受试制剂数据点时间应相同,数据点数应在4个以上;溶出超过8 5%后只取1个数据点,参比制剂与受试制剂前4个时间点组内溶出度值RSD小于2 0%,最后1个时间点组内溶出度值RSD小于1 0%。遗憾的是,本试验发现,国内生产的氨茶碱片在溶出介质b、c中的溶出度片间差异较大,根本达不到使用f2法的要求;即使假设参比制剂符合要求,进行f2值比较,也判定4个受试制剂与参比制剂的溶出过程均不相似(f2>5 0,溶出曲线相似),生物不等效。而与此相反,在溶出介质a、d中,按照f2法,不需进行比较即可认为彼此相似,具有生物等效性。这再一次证明了很多企业溶出度质量标准的拟定,绝大部分均是“为了让产品合格”。
药典只设定单一溶出介质和单点法来控制药品的质量,标准较低,很多生产厂家针对国家规定的1种溶出介质或1个限度点去确定生产工艺,而对其他溶出介质或整个溶出过程不予考虑,这导致了国产药品的质量参差不齐。为了提高药物的品质,使不同企业生产的同一药品均能具有相同的生物等效性,应对体外溶出度试验进行更加细致、深入和全面的研究,才能有效地利用体外溶出度试验来提高药物体内的生物利用度;并且,通过对体外溶出度试验的严格要求,才能推动制药企业改进制剂工艺,从而提高药物的内在品质和临床疗效。
[1] 苏云驰,薛大权,徐建平.氨茶碱片体内外相关性的研究[J].中国医院药学杂志,1 9 8 8,8(6):2 4 4.
[2] 杨远荣,吴健鸿,张 隽,等.头孢氨苄片的体外释放度与人体吸收度相关性研究[J].中国药师,2 0 1 0,1 3(1):1 7.
[3] 国家食品药品监督管理局.药品评价抽检质量分析指导原则[S].2 0 0 9.
[4] Nie K,Li L,Li XX,et al.Monitoring ambroxol hydrochloride sustained-release tablets release by fiber-optic drug dissolution in situ test system[J].Dissolution Technologies,2 0 0 9,1 6(1):1 5.
[5] 胡文军,张国梅,徐腾光,等.光纤药物溶出度原位过程监测仪实时测定1 0厂家苯妥英钠片溶出度[J].中国药房,2 0 1 0,2 1(4 5):4 2 8 1.
[6] 国家药典委员会.中华人民共和国药典(二部)[S].2 0 1 0年版.北京:中国医药科技出版社,2 0 1 0:8 3 6.
[7] 谢沐风.简介日本“药品品质再评价”工程(溶出度研究系列一)[J].中国药品标准,2 0 0 5,6(6):4 2.
Evaluation of the Dissolution in Vitro of Aminophylline Tablets from Different Manufacturers by FODT
WANG Yan,DING Hai-yan,LI Xin-xia,LI Li(Pharmacy College,Xinjiang Medical University,Urumqi 8 3 0 0 1 1,China)
ZHENG Li-min(The Fifth Affiliated Hospital of Xinjiang Medical University,Urumqi 8 3 0 0 1 1,China)
OBJECTIVE:To evaluate the dissolution in vitro of Aminophylline tablets from different manufacturers by fiber-optic dissolution test(FODT),and to investigate the difference of samples from different manufacturers in quality.METHODS:By using substance control method,the dissolutions of Aminophylline tablets from 5manufacturers were determined in the 4kinds of mediums(water,hydrochloric acid(pH 1.2),acetic acid buffer solution(pH 4.5),phosphate buffer solution(pH 6.8)),compared with similarity factor method.RESULTS:The dissolutions of Aminophylline tablets were different in different mediums.Aminophylline tablets from manufacturer B well released in 4mediums;using the tablet of manufacturer B as control,the similarity of tablets from other 4manufacturers were all lower than 5 0%.CONCLUSION:FODT is capable of monitoring the drug dissolution and reflecting dissolution behavior accurately.The method provides an effective way to investigate the inner quality of drug completely.The product from different manufacturers were different in quality.
Fiber-optic dissolution test;Aminophylline tablet;Manufacturer;Dissolution in vitro
R9 2 7.2;R9 7 4
A
1 0 0 1-0 4 0 8(2 0 1 2)3 3-3 1 2 2-0 3
DOI1 0.6 0 3 9/j.issn.1 0 0 1-0 4 0 8.2 0 1 2.3 3.1 9
Δ新疆维吾尔自治区自然科学基金资助项目(2 0 1 1 2 1 1 A0 4 1);新疆维吾尔自治区科技计划项目(2 0 0 9 1 0 1 0 7)
*讲师,硕士。研究方向:药物分析、新疆地方药用植物。电话:0 9 9 1-4 3 6 2 4 7 0。E-mail:wangyan1 0 6 0@yahoo.com.cn
#通讯作者:主任药师,副教授。研究方向:药剂学。E-mail:zlmsecond@1 6 3.com
2 0 1 1-0 9-2 3
2 0 1 1-1 1-0 9)

