纳豆芽孢杆菌的分离培养与鉴定
孙春萍 尹志明 王莉 刘玉民 (山东华牧天元农牧股份有限公司 山东 济南 250101)
纳豆芽孢杆菌的分离培养与鉴定
孙春萍 尹志明 王莉 刘玉民 (山东华牧天元农牧股份有限公司 山东 济南 250101)
根据纳豆芽孢杆菌耐盐、耐温、耐pH的能力及C/H值大小,从豆豉中分离出几株淀粉水解能力较强的菌株,通过初筛、复筛选出一株最优菌株,通过革兰氏染色、细胞形态、菌落形态观察和生理生化反应及大豆发酵试验,确定该菌株为枯草芽孢杆菌的一个变种,即纳豆芽孢杆菌
纳豆芽孢杆菌 分离 鉴定 生化试验
纳豆(Natto)是日本的一种传统食品,由纳豆菌(B acillus natto)在一定温度、湿度下发酵蒸煮大豆制备而成。纳豆含有丰富的蛋白质、氨基酸和多种人体所需的生物活性物质,如纳豆激酶、超氧化物歧化酶(SOD)、吡啶二羧酸等,其中的纳豆激酶(nattokinase,NK)是纳豆发酵过程中由纳豆菌产生的一种具有纤溶活性的丝氨酸蛋白酶,具有良好的溶解血栓能力[1-2]。纳豆具有多种医疗保健功能,近年来大量的研究证实常食纳豆不仅能有效预防和治疗心脑血管疾病,而且还具有强身健体、防癌抗癌、调整肠功能、延缓衰老等功效[3-4],因此被称为21世纪的“超级中药”,在日本享有“蔬菜干酪”的美誉[5-6]。从纳豆中筛选出的纳豆枯草芽孢杆菌(B acillus subtilisnatto),经菌种鉴定属于芽孢杆菌属枯草芽孢菌,广泛应用于生物制药、农业、畜牧业等行业,是人类的重要“益生菌”[7]。本试验主要对从纳豆中分离得到的纳豆芽孢杆菌的细胞、菌落形态及生理特性进行研究,以明确这些菌株的种类,为后续试验提供菌种材料。
1 材料和方法
1.1 材料
1.1.1 豆豉样品数份 购自农贸市场。
1.1.2 抗生素药敏片 购自杭州天和微生物试剂有限公司。
1.1.3 纳豆芽孢杆菌C5 山东农业大学大学食品微生物实验室赠予。纳豆芽孢杆菌CICC:10023购自中国工业微生物菌种保藏管理中心。
1.1.4 培养基 淀粉培养基,牛肉膏蛋白胨培养基购自青岛海博生物技术有限公司。
1.2 方法
1.2.1 纳豆芽孢杆菌的分离 称取豆豉10g置于装有90ml无菌生理盐水的500ml三角瓶中浸泡72h,间隔20min振荡1次。72h后用80~90℃水浴加热10~15min,冷却,梯度稀释后,取0.2ml加入无菌平皿,倾入淀粉培养基,立即摇匀。37℃倒置培养24~48h。挑取淀粉水解圈直径与菌落直径比值(C/H的值)较大的菌落接入牛肉膏蛋白胨斜面培养基,培养备用。
1.2.2 纳豆芽孢杆菌纯化 将上述选定的菌株在淀粉培养基上进行平板划线分离纯化,重复操作3~4次,直至获得单一菌株,转接到斜面培养基上,37℃培养24h,4℃冰箱保存备用。根据革兰氏染色、细胞形态及菌落特征进行纳豆芽孢杆菌初步鉴定。
1.2.3 菌株的初选 纳豆芽孢杆菌具有一定的耐盐、耐pH及耐热性,为了从分离的菌株中筛选出符合需要的优势菌株,选择了含盐量7%、pH5.0、温度55℃和淀粉水解圈直径与菌落直径比值(C/H)四项指标进行初筛,获得两个纳豆芽孢杆菌单菌株B2,B15,并进行菌株鉴定确认。(1)耐盐试验:取含70g/LNaCl牛肉膏蛋白胨培养各50ml于150ml三角瓶中,灭菌0.1MPa/20min,接种纳豆芽孢杆菌菌液0.2ml,于37℃、120r/min培养24h。以含5g/L NaCl的培养基为对照,测定△A660nm/ACK660nm。(2)耐温试验:取牛肉膏蛋白胨培养基各50ml于150ml三角瓶中,灭菌0.1MPa/20min,接种活化菌液0.2ml,于55℃、120min,培养24h。以培养温度37℃为对照,测定△A660nm/ACK660nm。(3)耐pH试验:取牛肉膏蛋白胨培养基(pH5.1)50ml于150ml三角瓶中,灭菌0.1MPa/ 20min,接种活化菌液0.2ml,于37℃、120r/min培养24h,以培养基pH7.2为对照,测定△A660nm/ACK 660nm。(4)C/H测定:将上述各活化菌液无菌10倍递增稀释,分别取后3个稀释度菌液各0.2ml于无菌平皿,每一稀释度做2个平行。将放置在45℃水浴锅中的的淀粉培养基倾入各平皿中,立即摇匀,待凝固后37℃倒置培养24~48h,测定淀粉水解圈直径与菌落直径比值(C/H)。
1.2.4 优势菌株的复选 (1)菌株对温度的耐受性:比较分离筛选所得菌株与B2、B15与实验室保藏的纳豆芽孢杆菌C2、CICC对温度的耐受性,挑取各菌株2环斜面菌种接种于牛肉膏蛋白胨液体培养基,于37℃、120r/min振荡培养16h,分别取培养液1ml稀释至一定的倍数,将后两个稀释度的菌液分别置93℃和98℃水浴5、10、15、20min,流水冷却,以未经水浴的菌株作为对照,采用平板计数法计算水浴后的存活率。存活率=(水浴处理存活的平均菌数/室温存活的平均菌数)×100%。(2)菌株对pH的耐受性:配制不同的pH缓冲液,缓冲液分2份,一份用于测定灭菌后的pH。其中A液为0.2mol/L的磷酸氢二钠,B液为0.1mol/L的柠檬酸溶液,配制方法见表1。取各菌株培养液1ml加入到各灭菌缓冲液中处理30min,其稀释至一定的倍数,涂布平板计数,计算相对存活率。相对存活率={pH处理后的每实验组存活的平均菌数/Max(pH处理后的每实验组存活的平均菌数)}×100%。(3)菌株对抗生素耐受性:取各菌株培养液适当稀释至菌数在106~107个/ml,分别取0.2ml涂布平板,用无菌镊子取圆形抗生素药敏片贴在平板表面,静置2h后倒置培养24h,测定抑菌圈的直径,以此判断各菌株对各抗生素耐受能力性。
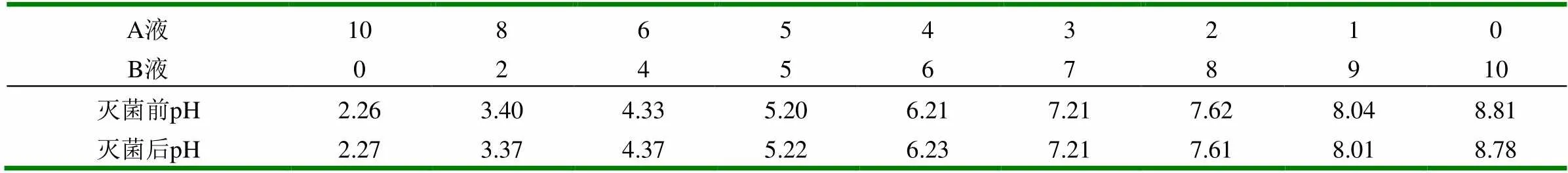
表1 不同pH缓冲液的配制
1.2.5 菌株的鉴定 根据《伯杰细菌鉴定手册》(第八版)所述芽孢杆菌属典型菌体形态、菌落形态和生理生化特性,对所获得菌株进行鉴定。
2 结果
2.1 乳酸杆菌分离和菌落形态
在淀粉培养基上根据C/H值的大小挑取了15个菌株并分别命名为B1~B15,并对菌株进行纯化,选择了其中B2、B4、B7、B11、B15和实验室保藏的菌种C5、CICC共7个菌株进行后续实验。通过菌落形态观察、革兰氏染色和镜检发现上述7个菌株革兰氏染色均呈阳性、菌体杆状,芽孢柱状或椭圆状、中生或近中生且不膨大,菌落乳白色且不透明、中央凸起有皱褶、菌落边缘不整齐,用牙签挑取时可形成很长的拉丝。根据以上特征可初步确定所分离的菌株为纳豆芽孢杆菌。
2.2 纳豆芽孢杆菌的初筛

表2 菌株初筛结果
根据益生菌株在实际应用中所遇到的问题,如在高温处理过程中必须保证一定的存活率,在进入人体或动物体内的时候能经受住胃酸的作用,最后在小肠能够定植并产生较多的代谢物质等,故将菌株对温度、pH的耐受能力和产淀粉酶能力(即C/H值)作为筛选的主要考虑因素,同时将菌株耐盐的强弱作为筛选的一个辅助因素。在3个主要因素中,如果有一个因素不符合要求,就将被排除。
从表2可以看出,各菌株对温度的耐受能力存在较大的差异,对温度耐受能力最强的菌株CICC达到了48%,将对温度的耐受能力在20%以下的菌株B7、B11予以淘汰;符合要求的菌株进行pH耐受能力的比较,各菌株对pH的耐受能力都比较强,再排除C/H的值较小的菌株C5,去掉耐盐能力相对较差的菌株B4,选择B2、B15和CICC菌株作为后续试验菌株。
2.3 纳豆芽孢杆菌的复筛
2.3.1 菌株对温度的耐受性
2.3.2 菌株对pH的耐受性从表3可知,3个菌株对pH的耐受能力B15>B2>CICC。

表3 菌株对pH的耐受性
2.4 菌株对抗生素耐受性
从表4可知各菌株对抗生素的耐受能力都较弱,但存在一定的差异。各菌株对链霉素耐受能力最强,而对头孢噻吩类抗生素耐受能力最差,对其他抗生素耐受能力则介于这二者之间。此外,各个菌株对同一种抗生素的耐受能力没有明显差异。

表4 菌株对抗生素耐受性(抑菌圈直径) (mm)
综合上述结论,最终选择耐受能力都比较强的B2菌株。
2.5 菌株鉴定
以枯草芽孢杆菌为标准对照,进行生理生化试验结果见表5,通过上述的生理生化反应和前面的革兰氏染色、细胞形态及菌落形态观察,可以确定B2菌株为枯草芽孢杆菌。将分离的B2菌株进行大豆发酵实验,2d后观察到在大豆表面形成白色粘稠状物质,用牙签挑取时可形成较长的拉丝,由此判断该菌株为枯草芽孢杆菌的一个变种,即纳豆芽孢杆菌。

表5 B2的生理生化试验
3 结论
采用涂布平板、划线分离等微生物分离纯化技术从我国传统食品豆豉中分离出几株淀粉水解能力较强的菌株,并通过比较分离的菌株与本实验室保存的纳豆芽孢杆菌的耐盐、耐温、耐pH的能力及C/H值大小进行初筛,复筛比较了分离菌和实验室保存的纳豆芽孢杆菌的耐受性,从中选出一株最优菌株B2。通过革兰氏染色、细胞形态、菌落形态观察和生理生化反应及大豆发酵实验,确定B2菌株为枯草芽孢杆菌的一个变种,即纳豆芽孢杆菌。
[1] Sumi H, Hamada H, Tsushima H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheesenatto: atyp ical and popular soybean food in the Japanese diet[J].Exerientia, 1987, 43(10): 1 11021 111.
[2] 王刚, 陈光. 9株纳豆菌产酶活力的比较研究[J]. 吉林农业大学学报, 2006, 28 (4): 3762378.
[3] Esaki H, Onozaki H, Osaw T. Antioxidative activity of fermented soybean products[J]. ACS Symp Ser, 1994, 546: 353.
[4] 孙海峰, 王丽霞, 孟玉平等. 纳豆菌的定向筛选及其生物学特征分析[J]. 食品与药品. 2007, 12 (9): 21223.
[5] 张晓敏, 徐宝才. 纳豆-一种值得开发的功能性食品[J]. 中国食品添加剂, 2007(2): 1872192.
[6] 齐海萍, 钱和. 纳豆-一种值得开发的食品[J]. 中国调味品, 2003, 2: 11214.
[7] 陈兵. 纳豆芽孢杆菌分离纯化及对大白鼠肠道微生态系统的影响[J]. 浙江农业学报, 2003, 15(4): 2232227.
(2012–09–19)
山东省技术创新项目(201131901022)、山东省技术创新项目(201121901001)、济南市自主创新计划(201101070)、济南市高新区科技发展计划项目(济高管字[2011]222号))
S852.61+6
A
1007-1733(2012)10-0014-03

