小鼠骨髓及脾脏来源的树突状细胞培养及鉴定
孙国龙,王凯忠,周 莉,付 鑫,田晓巍,王登莉,赵 慧*
(1.吉林大学第一医院 胸外科,吉林 长春130021;2.吉林大学白求恩医学院组织学与胚胎学教研室,吉林 长春130021)
树突状细胞(Dendritic Cell-DC)是由Steinman和Cohn[1](1973)首次分离出来的,它是目前所知的机体内功能最强的抗原提呈细胞,也是唯一能将抗原提呈给初始T细胞,激发初次免疫应答的抗原提呈细胞。本研究从小鼠骨髓及脾脏中获取DC的前体细胞,然后在细胞因子的作用下培养出DC,并对其进行鉴定以及比较这两种不同组织来源细胞分化成DC的差异。
1 材料与方法
1.1 主要实验仪器 三洋CO2培养箱、BD Bioscience流式细胞仪、奥林巴斯光学倒置显微镜。
1.2 实验动物和试剂 ICR小鼠18只,雄性,体重20-25g,周龄8-10w,无菌环境饲养。由吉林大学动物实验中心所提供。EZ-SepTMMouse淋巴细胞分离液购自达科为生物技术有限公司,IL-4、GMCSF、FITC-labeled Anti-Mouse CD80、PE-labeled Anti-Mouse CD86购自美国PEPROTECH公司。
1.3 细胞提取 ICR小鼠经脱颈椎处死后立即浸入体积分数为75%的乙醇中5-10min。无菌取出脾以及游离小鼠四肢带有髓腔的骨骼。
脾脏的处理:去除脾脏外表面的脂肪被膜,以预冷至4℃pH 7.2的PBS冲洗2次,在35mm培养皿中放入4mL EZ-SepTMMouse淋巴细胞分离液。经充分研磨后把悬有脾脏细胞的分离液立即转移到15mL离心管中,覆盖200μl的1640培养基。室温,800g离心30min。细胞层由上到下分4层,1640覆盖层、淋巴细胞层、EZ-Sep分离液层、红细胞及其他细胞和死细胞碎片。吸出淋巴细胞层,再加入10mL1640培养基,颠倒洗涤。室温,250g,离心10min收集细胞。倾倒上清液,用无血清培养基重悬细胞,计数细胞。将细胞浓度调至5×106/ml,然后分瓶培养。
股骨的处理:无菌手术取出股骨、胫骨、肱骨,尽量将其表面的肌肉和结缔组织去除干净,然后放入无菌的PBS中,剪断骨的两端,用1ml无菌注射器抽取含青霉素钠6U/ml,链霉素10U/ml的生理盐水反复冲洗出骨髓,直至骨变白,收入15mL离心管中,1 500r/min,5min离心,弃上清,收集沉淀的骨髓细胞,置于含有双抗、10%胎牛血清、终浓度为2mmol/L的谷氨酰胺的RPMI 1640培养液中培养。分装于细胞培养瓶。置于37℃、5%的CO2培养箱中培养。
脾脏的淋巴细胞和骨髓细胞都静置培养48小时后,倾去悬浮细胞,更换新的培养液,同时加入GMCSF(终浓度500ng/L)和IL-4(终浓度200ng/L)。
1.4 细胞生长状态的观察 在培养的第1、2、3、4、5、6、7天用光镜观察细胞的形态变化,照相。
1.5 流式细胞术检测细胞表面的共刺激分子 收集的培养细胞用PBS悬浮为1×106细胞/ml,加入3个EP管中,300μl/管,在2个管里分别加入FITC-labeled Anti-Mouse CD80 和 PE-labeled Anti-Mouse CD86(终浓度为0.5mg/L),另1个EP管内的培养细胞不加入荧光标记抗体,将其作为空白对照组。混匀,置于37℃、5%的CO2培养箱中孵育45min。孵育结束后用PBS清洗2遍,1 500rpm离心3min,弃上清,各加300μL的PBS(pH=7.4)悬浮,上流式细胞仪检测。各组细胞3、5、7天行流式细胞仪检测,观察CD80、CD86表达随培养细胞成熟的变化趋势。
1.6 统计学分析 应用SPSS13.0软件进行Fisher精确概率法检验,P<0.05为差异有显著性意义。
2 结果
2.1 培养细胞的形态学观察 见图1。

图1 The expression of cytokines of the bone marrow cells cultured with stimulating factor GM-CSF and IL-4at different time points(n=6)
由小鼠骨髓直接分离的DC很少,经GM-CSF和IL-4诱导分化培养3天后DC量逐渐增多,细胞大量增殖,每2只小鼠的骨髓细胞可得到(2.0-5.0)×107个DC,完全能够满足实验的要求。
骨髓细胞镜下观察:培养的第1天在光学显微镜下观察:培养液中充满了大量的骨髓原始细胞,大小不等,悬浮细胞数较多;第2天部分细胞边缘开始出现少量不规则形态的突起,贴壁细胞数目增多;在第3天贴壁细胞数量明显增加,部分细胞伸出很多像树枝样的突起,培养瓶中可见明显细胞集落形成,细胞状态长势良好;第4天细胞数目明显增加,培养液中出现漂浮的或松散聚结的典型DC,部分形成较大的细胞集落;第5天少量细胞悬浮起来;随着培养时间的延长,第6天伸出突起的细胞出现突起回缩的状态,大量细胞悬浮起来;第7天悬浮细胞大量增多,大量细胞出现衰老死亡现象。
脾脏淋巴细胞镜下观察:在培养的7天内光学显微镜下观察培养液中未见贴壁的细胞,大量细胞呈悬浮状态。
2.2 流式细胞术的检测结果 见图2~图4。
本实验检测结果显示:GM-CSF和IL-4诱导培养的骨髓细胞在第3天均可检测到CD80、CD86,但是表达的百分率低,CD86基本不表达。在诱导培养的第5天,CD80表达的百分率是第3天的12倍,但是CD86表达的百分率与第3天表达相比无明显变化。诱导培养第7天CD80表达的百分率是第5天的3倍,但是CD86表达仍很低,与第3天、第5天相似,无明显变化。结果表明,CD80表达的百分率随着细胞培养时间的延长,表达率呈递增趋势,统计学分析结果显示各组间差异显著,P<0.01。而CD86表达的百分率一直呈低表达的现象。
3 讨论
DC是目前为止发现的功能最强的专职抗原提呈细胞,它对诱导初次免疫应答具有独特的功能。尽管其在体内数量甚少,但分布广泛,迁徙力强,加之树枝状表面所赋与的巨大表面积,有利于接触并提呈抗原,是提呈能力最强的抗原提呈细胞。未成熟的DC具有很强的吞噬、加工处理抗原的能力,它作为免疫耐受原在移植免疫应答中的重要地位。它是唯一能激活初始免疫应答的抗原提呈细胞[2-4]。在接受抗原刺激成熟后,DC可以有效地摄取抗原并通过抗原肽/MHC分子复合物的形式将抗原有效地提呈给初始T细胞,并刺激其生成针对该抗原的特异性的细胞毒性T细胞,从而有效地启动机体的免疫反应[5]。
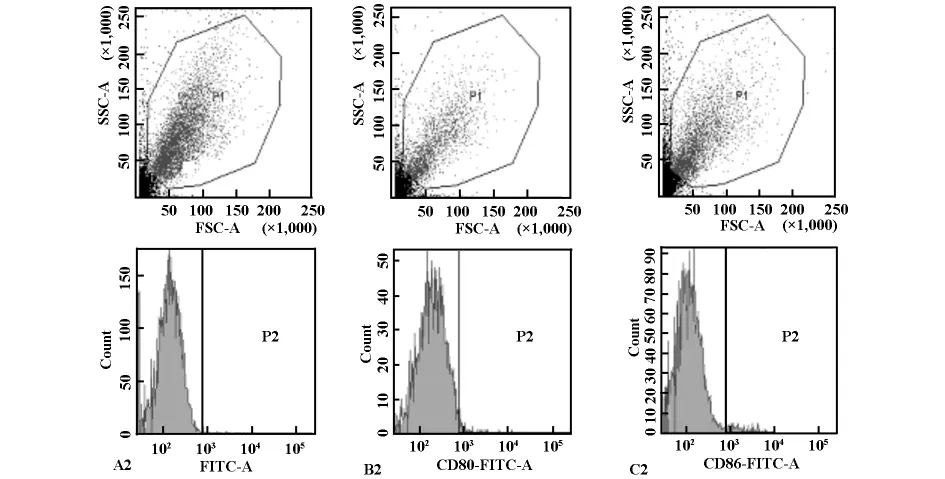
图2 GM-CSF和IL-4诱导培养的骨髓细胞诱导第3天的细胞流式图谱
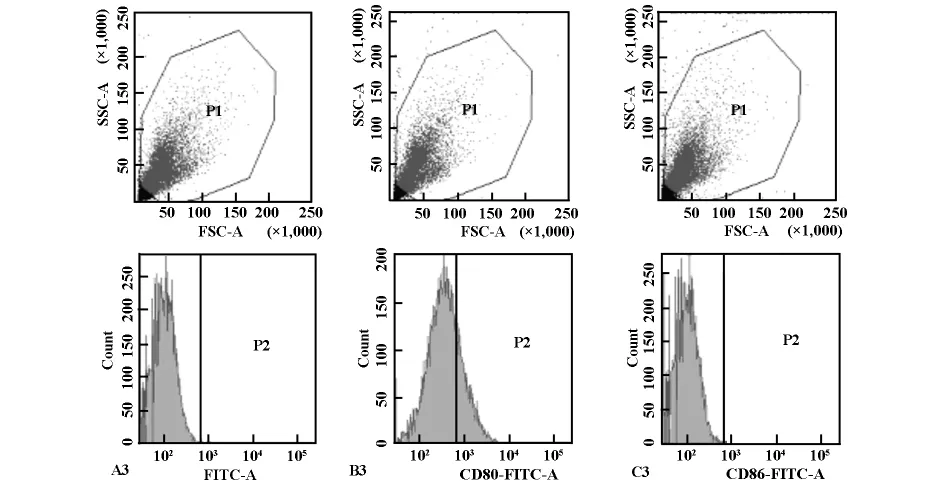
图3 GM-CSF和IL-4诱导培养的骨髓细胞诱导第5天的细胞流式图谱
由于DC在体内含量极低,而且提取物中又会含有其他的细胞,因此DC的体外培养关键问题是DC的分离、提取以及诱导分化。本实验用ICR小鼠做DC的来源,但它骨髓细胞含量极其少,通过培养增加数量,满足实验的要求。从股骨中提取骨髓细胞和脾脏中提取淋巴细胞,进行培养。在培养的过程中,通过细胞的贴壁特性,尽量除去粒细胞,以提高培养DC的纯度。同时应加入刺激因子,使其向DC分化。在培养过程中,GM-CSF起到重要的作用,不仅诱导DC前体细胞增殖,而且还能促进DC的分化和延长DC的寿命,并使骨髓前体细胞形成集落,促进DC的增殖,若是单独使用GM-CSF只能产生少量的DC集落。IL-4能抑制培养体系中的中性粒细胞、巨噬细胞的产生。GM-CSF与IL-4联合应用,既能提高DC的产量,又能增加DC的纯度。通过脾脏淋巴细胞和骨髓细胞分化成DC的结果观察:骨髓细胞的前体细胞诱导分化成DC的数量多,易获得,诱导时间短。而脾脏淋巴细胞诱导分化为DC,不仅难获得,而且诱导周期长,获得的DC数量也极其有限,不利于后续试验的进行。

图4 GM-CSF和IL-4诱导培养的骨髓细胞诱导第7天的细胞流式图谱
本实验的经验总结如下:1)刚提取出来的骨髓细胞,在加入刺激因子之前最好不要频繁地移动培养瓶,以便细胞能充分地贴壁,也防止贴壁的细胞悬浮起来,影响其贴壁的能力;2)选择加入刺激因子的时间为提取细胞培养48小时后加入。原因就是细胞数量大部分已经充分贴壁,可增加诱导成DC的数目。3)对于诱导中采用的细胞的因子浓度,不同的文献报道差异较大,并且诱导时间,处理方法都不完全相同。在本实验中,我们采用终浓度为500 ng/L GM-CSF、200ng/L IL-4的细胞因子组合。诱导培养3d即可见到大量的具有典型树突状突起的细胞生成;4)脾脏来源的主要是淋巴细胞,脾脏的淋巴细胞数目虽多,但培养48小时后贴壁的细胞数目少,加刺激因子后细胞数目变化不大。培养7天后贴壁的细胞数目有所增加,由于诱导周期长,不利于进行后续试验。与文献报道的有很大的差异[6]。为了进行后续实验只能采取骨髓来源来诱导DC;5)体外诱导骨髓细胞培养3d即可见到大量的具有典型树突状突起的细胞生成。随着时间的推移,细胞数目大量的增加,但是通过多次实验的经验,在培养到第7天,细胞就开始出现悬浮状态,并且随着时间的延长,悬浮的细胞数目大量增加,大量细胞出现衰老死亡现象。不利于后续实验的实施。前7天的骨髓细胞处于未成熟期,如果加入LPS(磷酸脂多糖)则可诱导成为成熟的DC。根据细胞的状态,培养到3-5d的细胞可利于后续试验的进行。本实验的目的是获得未成熟的DC。后续试验利用其具有强大的专职抗原提呈细胞的功能以及它对诱导初次免疫应答独特的功能,再与后续分选的CD4+CD25+Treg细胞结合对抗移植器官的排斥反应。
[1]Steinman RM,Cohn ZA.Identification of a novel cell type in peripheral lymphoid organs ofmice.I.Morphology,quantitation tissue distribution[J].J Exp Med,1993,137(5):1142.
[2]Gil-Torregrosa BC,Lennon-Duménil AM,Kessler B,et al.Control of cross-presentation during dendritic cell maturation[J].Eur J Immunol,2004,34(2):398.
[3]Pulendran B.Variegation of the immune response with dendritic cells and pathogen recognition receptors[J].J Immunol,2005,174(5):2457.
[4]Zeng Z,Liu X,Jiang Y,et al.Biophysical studies on the differentiation of human CD14+monocytes into dendritic cells[J].Cell Biochem Biophys,2006,45(1):19.
[5]Chauvin C,Josien R.Dendritic cells as killers:mechanistic aspects and potential roles[J].J Immunol,2008,181(1):11.
[6]李宗辉,黄军华,刘 俊.小鼠脾脏来源树突状细胞的体外扩增培养[J].疑难病杂志,2009,8(9):520.

