α微管蛋白在非小细胞肺癌中的表达及临床意义
刘青松,张科伟,薛梦华,李 智,刘 伟*
(1.吉林大学白求恩第一医院 胸外科,吉林 长春130021;2.第四军医大学唐都医院 胸外科,陕西 西安710038)
α微管蛋白(α-tubulin)是细胞骨架的组成成分之一,在细胞有丝分裂和染色体分离中起关键作用[1]。有研究表明通过药物作用微管蛋白能够阻止肿瘤细胞的有丝分裂导致细胞进入凋亡期,从而抑制肿瘤生长[2],因此微管蛋白在肿瘤的发生和发展中起重要作用。肺癌,特别是NSCLC是全世界癌症死亡的主要原因之一,我国肺癌的发病率也在不断攀升[3],目前关于NSCLC与微管蛋白的研究主要集中在βⅢ-tubulin[4-6],而关于α-tubulin的研究甚少。本研究通过组织芯片技术采用免疫组化方法检测α-tubulin在NSCLC石蜡标本中表达状况,并探讨其临床意义。
1 材料与方法
1.1 临床资料
本组91例NSCLC石蜡组织切片取自1998年1月-2003年12月在吉林大学第一医院胸外科行手术治疗且随访资料完整的患者,所有病例均经术后病理明确诊断,术前均未接受化疗、放疗和其他治疗。91例患者中男性67例,女性24例;年龄35-77岁,中位年龄61岁;非吸烟者36例,吸烟者55例;根据1997年国际抗癌联盟(Union for International Cancer Control,UICC)NSCLC分期标准,Ⅰ期42例,Ⅱ期25例,Ⅲ期24例;病理类型中鳞癌53例,腺癌38例;随访截止日期为2008年4月8日,中位生存期为52±14个月。
1.2 组织芯片制备
91例NSCLC石蜡组织HE染色切片复检后标记供体蜡块靶点;利用组织芯片制作仪(Beecher Instruments公司),从供体蜡块上穿取直径为1mm组织芯2条,依次插入有200个点阵的受体蜡块中制作组织芯片蜡块;以5μm厚度连续切片,阵列切片置于60℃恒温烤箱中烤片16h;组织芯片进行HE染色复检合格后置于5℃冰箱内保存待用。
1.3 免疫组化染色
1.3.1 试剂 本实验采用兔抗人多克隆α-tubulin抗体,购自Cell Signaling公司,适用于石蜡切片,二抗采用抗兔免疫组化检测试剂盒(EnVision+/HRP/Rb),DAKO抗体稀释液,显色剂二氨基联苯胺(DAB)均购自DAKO公司。
1.3.2 结果判定 α-tubulin主要在细胞胞浆内阳性表达,α-tubulin阳性表达根据肿瘤细胞染色百分率与胞浆染色强弱(阴性=0,弱阳性=1,中阳性=2,强阳性=3)的乘积计算。两者乘积≥200者为阳性高表达,<200者为阳性低表达。(见图1、图2)
图1 NSCLC鳞癌组织α-tubulin高表达(20×10倍数)

图2 NSCLC腺癌组织α-tubulin低表达(20×10倍数)
1.4 统计学处理 应用SPSS13.0统计软件进行统计分析,α-tubulin高表达者与患者年龄、性别、吸烟状况、病理类型、肿瘤分期等临床病理资料的关系用Pearsonχ2检验或Fisher's精确概率法检验,生存率计算采用寿命表法并绘制Kaplan-Meier估计生存曲线进行单因素分析,经Log-rank检验后P<0.05表示差异有统计学意义。
2 结果
2.1 α-tubulin在91例NSCLC样本肿瘤细胞的胞浆中均存在表达,其中高表达者38.46%(35/91),低表达者61.54%(56/91)。≤55岁患者中α-tubulin高表达者显著高于>55岁患者(χ2=6.267,P=0.012),Ⅰ期和Ⅱ期高表达者显著高于Ⅲ期患者(χ2=4.280,P=0.039),鳞癌中高表达者显著高于腺癌(χ2=4.067,P=0.044)。α-tubulin表达与患者性别、吸烟状况、肿瘤大小和淋巴结转移程度无关(P>0.05)。(见表1)
2.2 生存分析表明 α-tubulin高表达组中位生存期57个月,低表达组中位生存期35个月,两组生存期未见统计学差异(P=0.082)。但在≤55岁患者中,α-tubulin高表达组中位生存期76个月,低表达组中位生存期28个月,α-tubulin高表达者预后显著优于低表达者(P=0.011)(见图3)。在鳞癌患者中,α-tubulin高表达组中位生存期80个月,低表达组中位生存期37个月,α-tubulin高表达者预后显著优于低表达者(P=0.023)(见图4)。
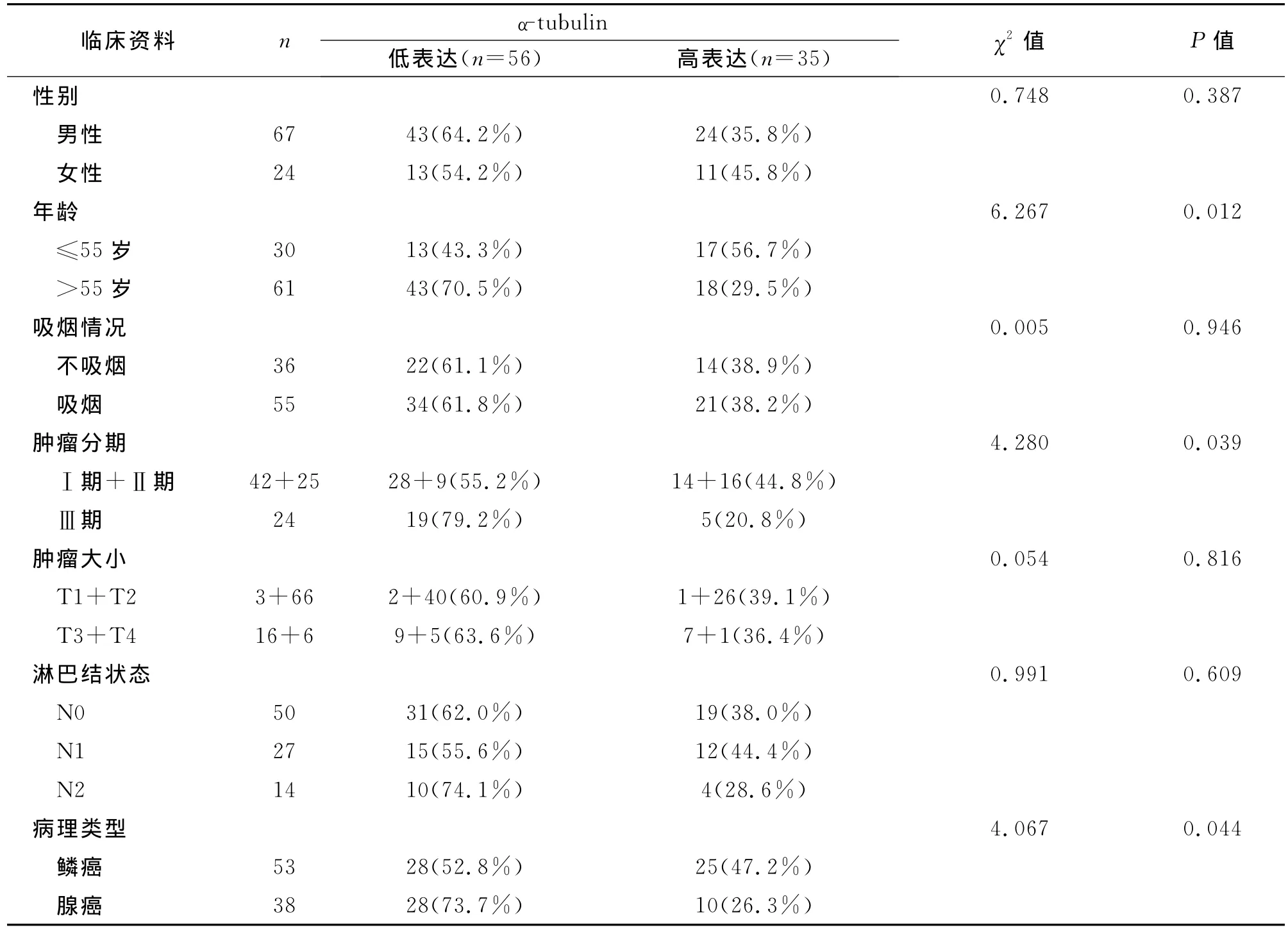
表1 α-tubulin在NSCLC癌细胞胞浆中表达情况
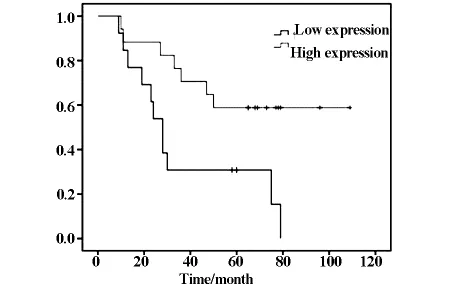
图3 年龄≤55岁患者α-tubulin低表达和高表达的生存曲线(P=0.011)
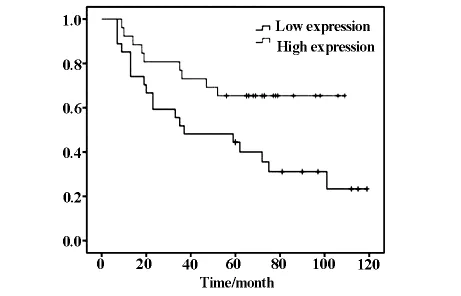
图4 鳞癌患者中α-tubulin低表达和高表达的生存曲线(P=0.023)
3 讨论
微管由α、β微管蛋白异源二聚体以及微管辅助蛋白组成,在微管组织中心中组装为单管、二联管(纤毛和鞭毛)、三联管(中心粒和基础小体)、纺锤体、基粒、轴突、神经管等结构[1],参与维持细胞形态,细胞内物质转运,有丝分裂,染色体分离等过程,尤其是微管不断延伸和缩短的特有动力学,在细胞有丝分裂和染色体的分离起关键作用[7]。当肿瘤细胞增殖活跃时,有丝分裂处于活跃状态,相应的微管蛋白异常表达。某些药物作用于微管蛋白使微管动力学受到影响,肿瘤细胞无法形成纺锤体,使细胞分裂停止在G2期(DNA合成期),促进细胞凋亡,从而抑制肿瘤生长[2,8,9],提示微管蛋白与肿瘤细 胞的增殖和凋亡有密切关系。本研究结果表明,α-tubulin在NSCLC中虽然存在非常广泛的表达,但高表达者仅有38.46%,而且早期NSCLC患者显著高于晚期患者,这与βⅢ-tubulin在卵巢癌中的表达截然不同,有研究表明βⅢ-tubulin高表达者卵巢癌的侵袭性更大且预后更差[10]。蛋白质发挥生物学功能不但与蛋白质的表达有关,也与蛋白质的转录后修饰有关,如α-tubulin和βⅢ-tubulin的转录后修饰机制不同,α-tubulin的转录后修饰与酪氨酸化、去酪氨酸化和乙酰化有关,而β-tubulin蛋白转录后修饰与磷酸化有关[11],而且有研究进一步证明参与α-tubulin酪氨酸化作用的微管蛋白酪氨酸连接酶(Tubulin Tyrosine Ligase,TTL)对动物肿瘤和人类肿瘤起负调节作用,TTL蛋白表达降低与肿瘤的发生、侵袭和不良预后有关[12,13]。同时有研究发现,αtubulin和β-tubulin对微管的稳定性作用不同,αtubulin与三磷酸鸟苷(guanosine triphosphate,GTP)或二磷酸鸟苷-Pi复合物(guanosine diphosphate-Pi,GDP-Pi)结合后,在微管的 N-端结构区域形成“帽子”结构,使微管结构稳定;β-tubulin与GTP或GDP-Pi结合后,易被水解成GDP,引起微管解聚[14],α-tubulin表达增高,微管稳定延伸,能够抑制肿瘤细胞的有丝分裂,因此可能与NSCLC中α-tubulin高表达者肿瘤侵袭性较小,预后相对较好有关。本研究还显示α-tubulin在不同年龄(≤55岁和>55岁)、不同病理类型(鳞癌和腺癌)患者中表达存在显著差异,这也提示α-tubulin在不同年龄和不同病理类型的NSCLC中的作用机制也可能存在显著差异,值得更深一步的研究。
总之,本研究初步揭示了α-tubulin在NSCLC中的表达状况及其临床意义,随着针对α-tubulin在NSCLC作用机制中的更深入研究,α-tubulin有可能在NSCLC诊断、分子靶向治疗以及化学治疗中成为非常有意义的生物标记物,从而更科学合理地指导NSCLC的临床诊疗。
[1]Hammond JW,Cai D,Verhey KJ,et al.Tubulin modifications and their cellular functions[J].Curr Opin Cell Biol,2008,20(1):71.
[2]Sève P,Reiman T,Dumontet C.The role of beta III tubulin in predicting chemoresistance in non-small cell lung cancer[J].Lung Cancer,2010,67(2):136.
[3]Molina JR,Yang p,Cassivi SD,et al.Non-small cell lung cancer:epidemiology,risk factors,treatment,and survivorship[J].Mayo ClinProc,2008,83:584.
[4]Umezu T,Shibata K,Kajiyama H,et al.Taxol resistance among the different histological subtypes of ovarian cancer may be associated with the expression of class III beta-tubulin[J].Int J Gynecol Pathol,2008,27(2):207.
[5]Sève P,Reiman T,Lai R,et al.Class III beta-tubulin is a marker of paclitaxel resistance in carcinomas of unknown primary site[J].Cancer Chemother Pharmacol,2007,60(1):27.
[6]Aoki D,Oda Y,Hattori S,et al.Overexpression of class III betatubulin predicts good response to taxane-based chemotherapy in ovarian clear cell adenocarcinoma[J].Clin Cancer Res,2009,15(4):1473.
[7]Margolis RL,Wilson L.Opposite end assembly and disassembly of microtubules at steady state in vitro[J].Cell,1978,13(1):1.
[8]Dumontet C,Sikic BI.Mechanisms of action of and resistance to antitubulin agents:microtubule dynamics,drug transport,and cell death[J].J Clin Oncol,1999,17(3):1061.
[9]Jordan MA,Wilson L.Microtubules as a target for anticancer drugs[J].Nat Rev Cancer,2004,4(4):253.
[10]Ferrandina G,Zannoni GF,Martinelli E,et al.ClassⅢ beta-tubulin overexpression is a marker of poor clinical outcome in advanced ovarian cancer patients[J].Clin Cancer Res,2006,12(9):2774.
[11]Banerjee A.Increased levels of tyrosinated alpha-,beta(III)-,and beta(IV)-tubulin isotypes in paclitaxel-resistant MCF-7breast cancer cells[J].Biochem Biophys Res Commun,2002,293(1):598.
[12]Mialhe A,Lafanechère L,Treilleux I,et al.Tubulin detyrosination is a frequent occurrence in breast cancers of poor prognosis[J].Cancer Res,2001,61(13):5024-5027.
[13]Lafanechère L,Courtay-Cahen C,Kawakami T,et al.Suppression of tubulin tyrosine ligase during tumor growth[J].J Cell Sci,1998,111(Pt2):171.
[14]Nogales E.Structural insights into microtubule function[J].Annu Rev Biochem,2000,69:277.
——水芹主要害虫识别与为害症状

