牛病毒性腹泻-粘膜病病毒TaqMan荧光定量RT-PCR检测方法的建立及初步应用
陈其兵,薛 霜,漆世华,朱 薇,张 萍,谢红玲,温文生,吴玉石
(武汉中博生物股份有限公司,武汉 430070)
牛病毒性腹泻病(bovine viral diarrhea,BVD)是一种在世界范围内广泛传播的牛羊传染病,其病原为黄病毒科瘟病毒属的牛病毒性腹泻-粘膜病病毒(bovine viral diarrhea virus,BVDV)。BVDV 是危害养牛业、养羊业和养猪业的重要病原之一,能引起感染动物产生以腹泻为主的一系列复杂的临床症状[1-3]。BVDV 感染可发生于子宫内[4],垂直感染使得胎牛血清、猪瘟细胞疫苗等很难控制BVDV污染,给畜牧业及相关生物制品领域造成了重大经济损失。
检测BVDV的方法很多,主要包括血清学中和试验、细胞分离培养、酶联免疫吸附试验、PCR技术等。血清学方法多存在费时、费力、准确率低等缺点。我国诊断BVDV国家标准技术采用培养细胞分离病毒的方法,但该方法费时费力,加之病毒分离率低,有些非致细胞病变型BVDV在细胞培养中不出现细胞病变,因而不利于大规模应用检测[5-6]。近几年发展起来的实时荧光定量PCR技术将传统PCR与荧光检测方法相结合,具有操作简便、结果直观、敏感性高、特异性强、重复性好等优点,已成为病原检测的重要方法。本研究建立了一种特异性的BVDV荧光定量RT-PCR快速检测方法,可用于BVDV的临床辅助诊断、快速定量检测以及对生物制品中是否污染BVDV进行监测。
1 材料与方法
1.1 材料
1.1.1 生物材料 牛病毒性腹泻-粘膜病病毒、猪瘟疫苗毒、猪繁殖与呼吸综合症病毒、MDBK细胞、胎牛血清由武汉中博生物股份有限公司保存,大肠杆菌DH5α感受态细胞购自北京全式金生物公司。
1.1.2 主要试剂 BamHⅠ限制性内切酶、TaqDNA聚合酶、M-MLV反转录酶、RNase Inhibitor、DNaseⅠ、T7体外转录试剂盒、DNA 片段回收纯化试剂盒、质粒快速提取试剂盒、病毒核酸提取试剂盒、荧光定量RT-PCR试剂盒(探针法)均购自大连宝生物工程有限公司,pEASY-T1克隆载体购自北京全式金公司。
1.2 方法
1.2.1 引物及探针设计 通过分析BVDV的保守基因片段,并结合荧光PCR引物探针设计特点,利用DNAStar软件进行同源性排序分析比较,选出在BVDV 5’UTR序列中种内保守种间特异的核苷酸片段,然后利用Primer Express及DNAStar软件设计筛选出最佳引物和探针组合,确定为本方法中所使用的引物和探针。
1.2.2 定量标准品的制备
1.2.2.1 体外转录模板的制备 以提取的BVDV核酸为模板扩增目的基因片段,经回收纯化后将其连接至pEASY-T1载体上。连接产物转化DH5α感受态细胞,经过抗性筛选、扩大培养后提取质粒。将经PCR初步鉴定为阳性的质粒送生物公司测序鉴定并及时保存阳性菌液和质粒。
1.2.2.2 体外转录标准品 将构建的阳性重组质粒经BamHⅠ酶切使质粒线性化,T7 RNA聚合酶37℃体外转录2 h,DNaseⅠ消化去除模板 DNA,酚/氯仿/异戊醇抽提纯化RNA,置于-70℃保存备用。经紫外分光光度计测定含量(连续测定5次取平均值),计算出每微升所含的拷贝数并进行10倍梯度稀释,作为定量标准品。
1.2.3 荧光定量RT-PCR检测方法的建立
1.2.3.1 反应条件的优化 根据宝生物One Step PrimeScript RT-PCR试剂盒说明书,用所制备的标准品对PCR反应条件和体系进行优化。
1.2.3.2 特异性实验 在相同的条件下,同时对未接毒的MDBK细胞、牛病毒性腹泻-粘膜病病毒、猪瘟疫苗毒和猪繁殖与呼吸综合症病毒提取核酸。应用优化后的PCR体系及条件对上述样品进行检测,同时以定量标准品和无菌水分别作为阳性和阴性对照,验证所建立检测方法的特异性。
1.2.3.3 敏感性试验 以10倍梯度稀释的标准品作为模板进行RT-PCR,得到相关标准曲线,确定最低检出量。
1.2.3.4 重复性试验 用所建立的方法对3组不同病毒含量的样品进行重复性测定,所得检测结果经统计学处理后,计算组内的变异系数(CV)。
1.3 临床样品的检测 用所建立的方法对10份胎牛血清样品和10份猪瘟细胞苗半成品进行检测,同时设立阴、阳性对照,计算阳性检出率。
2 实验结果
2.1 引物、探针设计 通过分析BVDV-Ⅰ型的保守基因片段,并结合荧光PCR引物探针设计特点,利用DNAStar软件进行同源性排序分析比较,选出在5’UTR序列中种内保守种间特异的核苷酸片段,然后利用Primer Express及DNAStar软件设计筛选出最佳引物和探针组合,确定为本方法中所使用的引物和探针(表1)。

表1 BVDV荧光定量RT-PCR引物和探针

2.2 反应条件优化 经相关实验优化后的反应体系和反应条件为:2×One Step RT-PCR BufferⅢ10 μL、10 μM TaqMan 探针 0.4 μL、10 μM 上游引物 0.4 μL、10 μM 下游引物 0.4 μL、TaKaRa Ex Taq HS 0.4 μL、Prime-Script RT Enzyme MixⅡ 0.4 μL、Rox Reference Dye 0.4 μL、DEPC H2O 5.6 μL、模板 2 μL。
扩增条件为:42℃ 5 min,95℃ 10 s,1个循环;95℃ 5 s,60℃ 40 s(收集荧光FAM),40个循环。
2.3 特异性试验 结果显示,牛病毒性腹泻-粘膜病病毒和阳性对照品检测结果为阳性,而猪瘟细胞毒、猪繁殖与呼吸综合征病毒、MDBK细胞和阴性对照品均为阴性(图1)。证明所建立的方法能特异性的检测出牛病毒性腹泻-粘膜病病毒。

图1 特异性试验结果
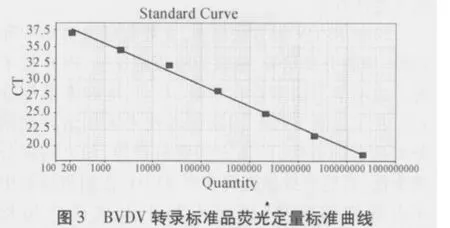
2.4 敏感性试验 以十倍系列稀释的BVDV转录RNA标准品(2.15×102~2.15×108拷贝/μL)作为模板进行检测,结果显示,在2.15×102~2.15×108拷贝/μL的范围内可以得到良好的动力学曲线(图2)且标准曲线较为理想(图3)。标准曲线的线性相关系数(R2)在0.99以上,提示误差较小,可信度较高。说明本方法可检测低至103~104拷贝/mL的病毒量。
2.5 重复性试验 所得检测结果经统计学处理后,计算组内的变异系数(CV),结果显示CV值均小于3%,说明差异不显著,该检测方法重复性较好(表2)。

表2 样品组间重复性检测
2.6 临床样品的检测 在所检测20份样品中,其中胎牛血清样品BVDV阳性4份(4/10),猪瘟细胞苗半成品BVDV阳性2份(2/10)。阳性检出率为30%,且阴、阳性对照均成立,检测结果见图4。

图4 临床样品检测结果
3 讨论
牛病毒性腹泻病至今仍是世界范围内严重威胁养牛业健康发展的传染病,世界各国对该病都十分重视,对其展开的研究力度逐年都在增加,近几年来我国牛感染BVDV并持续带毒的现象时有发生[7]。由于BVDV与猪瘟病毒同属于黄病毒科瘟病毒属的成员,具有较近的亲缘关系,两者的氨基酸同源性约为85%[8],在血清学上存在交叉反应,因而血清学方法难以区分BVDV和CSFV。在生产猪瘟细胞疫苗的过程中会用到胎牛血清、牛睾丸细胞等牛源制品,一旦这些制品中污染了BVDV,便会造成猪瘟细胞疫苗的污染。据相关报道,猪使用污染了BVDV的猪瘟疫苗后可感染BVDV,出现类似于猪瘟的临床症状和病理变化。另外,用含BVDV抗原和抗体的牛血清也会干扰猪瘟病毒的体外培养[9]。因而建立特异敏感的BVDV检测方法,有利于保障牛血清、猪瘟细胞活疫苗等的质量。
目前BVDV的诊断技术研究水平远远滞后于其他方面的研究进展,如何建立快速、准确的检测方法是当前BVDV防制工作的迫切要求。实时定量PCR方法操作简便、快速高效、具有较高的敏感度和特异性,而且封闭性好、不需要后续处理,大大降低了污染的可能性。显著的优越性使得该方法不仅在生物技术方面应用广泛,现今更作为一种诊断方法应用于临床。本研究建立了一种能够快速、特异、灵敏的检测BVDV的荧光定量RT-PCR方法,通过对20份胎牛血清和猪瘟细胞疫苗样品进行检测,发现其中6份样品污染了BVDV(6/20)。实验证实所建立的检测方法简便、快捷,具有较好的特异性、敏感性且重复性好。可用于临床及科研中对BVDV的快速定量检测和对牛血清及猪瘟兔化弱毒疫苗等生物制品中是否污染BVDV进行监测。但本研究中的引物和探针序列是根据BVDV-Ⅰ型设计的,猪瘟疫苗中是否有BVDV-Ⅱ型毒株的污染尚需用多种方法进一步检测才能确定。
[1]于大海,催砚林.中国进出境动物检疫规范[M].北京:中国农业出版社,1997:463-671.
[2]Terpstra C,Wensvoort G.Natural infections of pigs with bovine viral diarrhea virus associated with signs resembling swine fever[J].Res Vet Sci,1988,45:137-142.
[3]Loken T Buerkas.Experimental pestvirus infections in pregnant goats[J].Comp Path,1991,105:123-140.
[4]McClurkin A W,Littledike E T.Production of cattle immunotolerant to bovine viral diarrhea virus[J].Comp.Med,1984,48(2):156-161.
[5]Dubovi E.The diagnosis of bovine viral diarrhea infections:A laboratory view[J].Vet Med,1990,85:1133-1139.
[6]周绪斌,王新平,宣 华,等.鉴别牛病毒性腹泻病毒和猪瘟病毒的复合PCR方法的应用[J].中国兽医学报,2002,22(6):557-560.
[7]沈 敏,王新华,钟发刚.牛病毒性腹泻病毒流行的原因与防制近况[J].畜牧兽医科技信息,2002,(6):19-21.
[8]谢西峰,崔保安.牛病毒性腹泻的研究概况[J].中国兽医杂志,2001,37(11):29.
[9]Wensvoort G,Terpstra C.Bovine viral diarrhoea virus infections in piglets born to sows vaccinated against swine fever with contaminated vaccine[J].Res Vet Sci,1988,45(2):143-148.

