鸭髓样分化因子MyD88部分cDNA克隆及组织表达图谱分析
郭智莉,周作勇,聂 奎
(1.西南大学动物科技学院,重庆 北碚400715;2.西南大学荣昌校区动物医学系,重庆 荣昌402460)
髓样分化因子MyD88(myeloid differentiation factor 88,MyD88)最初被认为是一种髓样分化标记蛋白。1990年,Load发现了髓样分化基因家族成员中的新基因MyD88[1]。MyD88是Toll样受体(Toll-like receptors,TLRs)信号转导通路中关键的转接分子,具有使核转录因子κB(nuclear factor κB,NF-κB)活化转位进核,表达一系列特定的基因和致炎因子,如 TNF-α、IL-1和IL-18等。MyD88基因编码蛋白具有3个功能区域:N端的死亡结构域、中间区域及c端的TIR结构域。有文献表明,MyD88作为胞内能够介导10个TLRs家族的信号传导[2]。在人和鼠TLRs研究中发现,MyD88激活NF-κB途径介导了系统性红斑狼疮、类风湿性关节炎等自身免疫性疾病的发生[3],还导致心肌肥大[4]、参与了呼吸道炎症反应[5]和动脉粥样硬化斑块形成[6]等。
迄今为止,多个哺乳动物、鱼类、鸟类和无脊椎动物的MyD88分子已被鉴别,但是有关鸭的MyD88分子却未见报道。本试验以樱桃谷鸭为试验对象,对鸭MyD88部分cDNA进行克隆及生物信息学分析,并对MyD88mRNA在鸭不同组织中的转录情况进行检测。
1 材料与方法
1.1 试验动物 10日龄樱桃谷鸭,购自重庆荣昌某鸭厂。
1.2 主要试剂 大肠埃希菌DH5α为本实验室保存;RNAisoTMPlus、Taq酶、pMD 19-T、X-gal、RTPCR试剂盒、Amp,购自TaKaRa公司;胶回收试剂盒,购自OMEGA公司。
1.3 引物设计与合成 参照GenBank中已发表的鸡(NM_001030962)、人(NM_001172568)、家鼠(NM_198130)的 MyD88CDS序列,用DNAStar软件进行相似比对,在保守序列中用Primer5.0设计cDNA 引物,MyD88:F0 5′-GTTGGAGCAAACGGAGTTCA-3′,R0 5′-CCTGGGGAAAGACTAAGAGCA-3′,扩增片段为195bp;参照鸭(AY43-6595)GAPDH 基因序列设计引物,GAPDH:F1 5′-GCCCAGAACATTATCCCA-3′, R1 5′-AGGTCAGGTCCACGAACA-3′,扩增片段为152bp;由Invitrogen(上海)公司合成引物。
1.4 总RNA的提取 采鸭心脏、肝脏、脾脏等7种组织各0.1g。参照TaKaRa公司的RNAisoTMPlus试剂说明书提取各组织的总RNA,用1%琼脂糖凝胶电泳检验RNA完整性。-70℃保存备用。
1.5 RT-PCR扩增 以鸭组织总RNA为模板,按RT-PCR的方法扩增目的片段。cDNA反转录体系(10μL):5×Prime ScriptTMBuffer 2μL,Prime ScriptTMRT Enzyme Mix I 0.5μL,Oligo dT Primer(50μmol/L)0.5μL,Random 6mers(100μmol/L)0.5μL,Total RNA 3μL,RNase Free dH2O 3.5μL,37℃15min,85℃5s。PCR体系(25μL):cDNA 2μL,10×Buffer 2.5μL,dNTP Mixture 0.5μL,Mg2+1μL,引物F和 R各加入0.5μL,rTaq酶0.25μL,灭菌dH2O至25μL;扩增参数为:94℃预变性5min;94℃30s,60℃30s,72℃30 s,30个循环;72℃延伸5min。
1.6 目标基因的克隆及测序 将50μL RT-PCR产物经电泳后,按胶回收试剂盒回收目的片段。连接体系(10μL):4.2μL回收产物,0.8μL pMD 19-T,5μL SolutionⅠ,混匀4℃连接过夜;转化入100 μL DH5α感受态细胞,冰浴30min,42℃热冲击90 s,冰浴2min,加入890μL LB液体培养基,37℃振荡培养1.5h后将菌液涂于含IPTG+X-gal+Amp的LB固体培养基上,37℃过夜培养;挑选阳性单菌落接种于含Amp的LB液体培养基,37℃振荡过夜,菌液PCR鉴定后,送阳性克隆至Invitrogen(上海)公司测序。
1.7 序列分析 将测序所得部分cDNA序列在GenBank数据库中进行BLAST初步比较分析,利用DNAStar软件推测目的片段所编码的氨基酸序列,并用Clustal W方法比对目的氨基酸片段与其他物种MyD88氨基酸片段的同源性,建立系统进化树。
2 结果
2.1 鸭MyD88RT-PCR检测结果 以鸭脾脏cDNA为模板,采用RT-PCR方法扩增MyD88目的片段,经3%琼脂糖凝胶电泳后出现1条特异性条带,长度为195bp(图1)。将纯化的目的片段克隆到载体,重组质粒经菌液PCR鉴定,得到预期大小目的片段,命名为pMyD88。
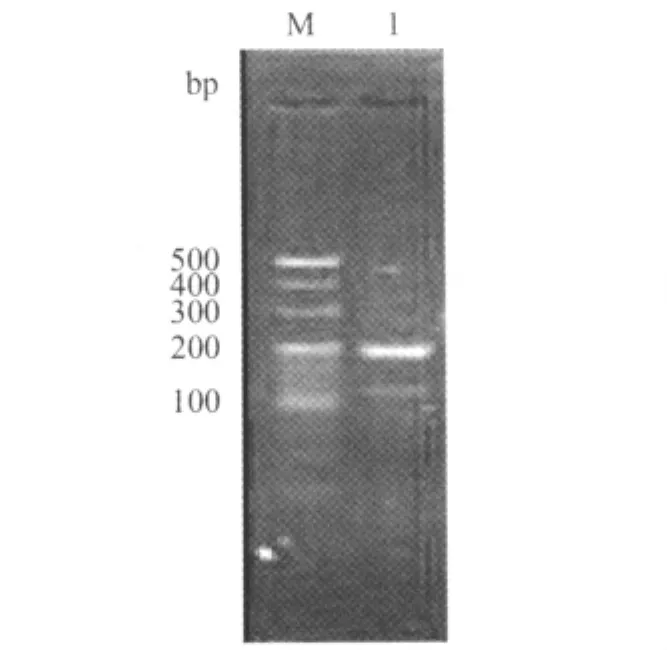
图1 MyD88部分基因RT-PCR产物电泳结果
2.2 MyD88测序及分析 阳性质粒测序后得到195bp的pMyD88基因序列:
GTTGGAGCAAACGGAGTTCAAGCTGAAGCTCT GTGTCTTTGACCGGGACGTCTTGCCAGGAACG TGCGTGTGGTCCATCAGCGGAGAGCTTATAGA AAGGAGGTGTCGGAGGATGGTGGTCGTCATTT CAGACGATTACCTGGAAAGCGACGAATGCGAC TTTCAGACCAAATTTGCTCTTAGTCTTTCCCCA GG
在GenBank数据库进行BLAST初步比较分析发现,pMyD88基因序列与G.gallus(NM_001030962.1)、M.gallopavo(XM_003206927.1)、T.guttata(XM_002196725.1)、R.norvegicus(NM_198130.1)、H.sapiens(NM_001172568.1)的相似性分别为92%、92%、89%、78%、76%。
2.3 MyD88氨基酸同源性及系统进化树分析 由pMyD88基因序列推导的氨基酸序列经BLAST分析,该cDNA部分基因位于编码MyD88分子TIR结构域内,与GenBank登录的其他物种相应MyD88TIR域氨基酸序列作同源性比对结果表明(图2),鸭 MyD88与鸡、火鸡、珍珠鸟的同源性最高,为97%~100%;与人、鼠、牛、猪、狗、马、兔、鲤鱼的同源性为83%~84%;与绵羊的同源性为 79%。
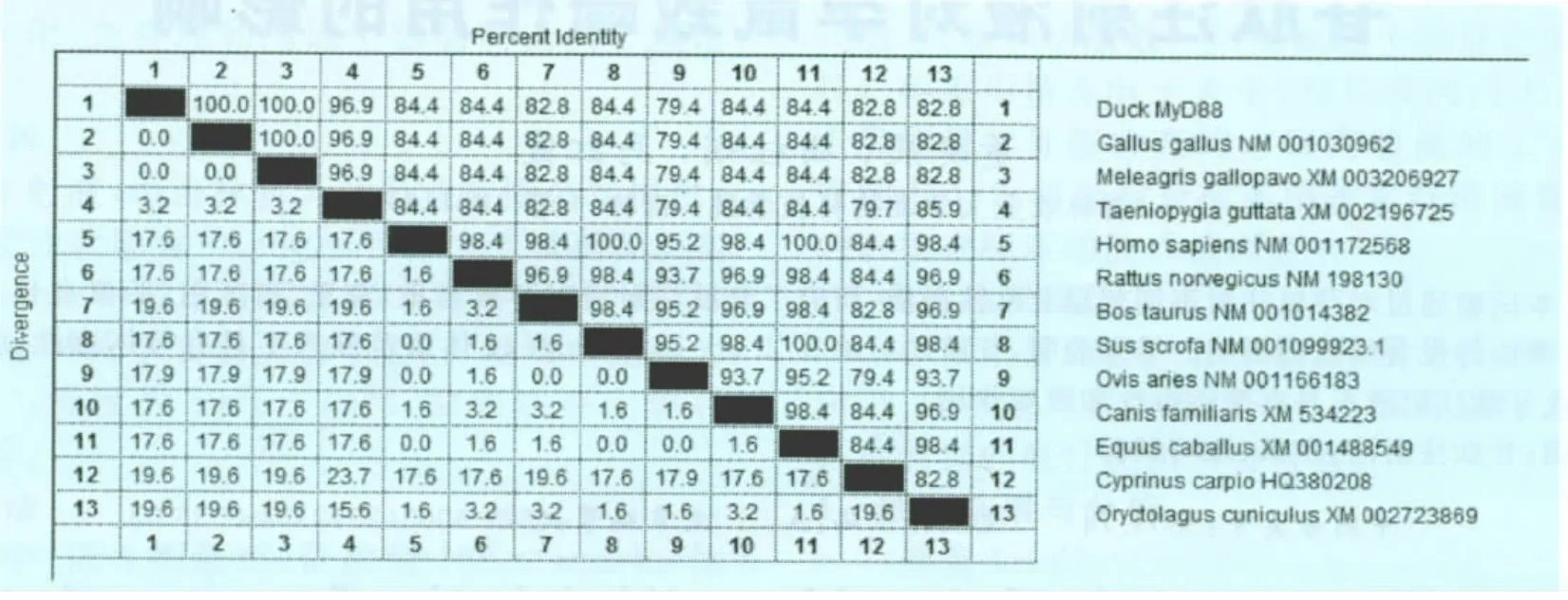
图2 pMyD88推导氨基酸序列与其他物种间的同源性比较
DNAStar软件进行系统进化树分析(图3),结果表明:鸭 MyD88与鸡的亲缘关系最接近,与火鸡、珍珠鸟的较为接近,与狗、鼠、兔、人、猪、马、绵羊、牛的亲缘关系依次渐远,与鲤鱼的亲缘关系最远;其中鸭与鸡、火鸡在分化年限上最接近,说明他们的MyD88有密切关系。

图3 pMyD88推导氨基酸序列与其他物种间的系统进化树
2.4 MyD88在鸭组织中分布 RT-PCR结果显示,以持家基因GAPDH为参照,MyD88基因在鸭心脏、肝脏、脾脏、肺脏、腔上囊中均有表达,且表达量存在差异,在肾脏、脑中未见转录产物(图4)。
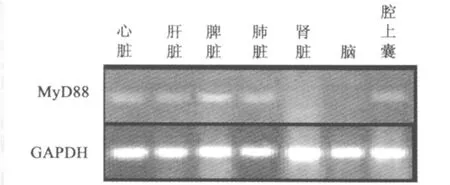
图4 鸭MyD88mRNA在组织中的转录情况
3 讨论
MyD88属于Toll/IL-lR家族和死亡结构域家族成员,MyD88的TIR结构域与TLRs和IL-1Rs的TIR相结合从而介导下游信号传导,最终诱导炎症细胞因子如IL-1、IL-6、IL-8、IL-12、TNF-α、干扰素和粘附因子等基因的表达,而通过抑制MyD88来减少细胞因子的表达能抑制疾病的发展[7]。MyD88分子在进化过程中具有较高的保守性,在各物种间TIR结果域的同源性明显高于死亡结构域。李强等[8]克隆出猪MyD88完整的CDS序列,与人、牛、小鼠和褐鼠的MyD88分子对比后同源性在78.2%~88.4% 之间。Yafeng Qiu等[9]得出鸡MyD88氨基酸序列与人、鼠MyD88同源性在70%左右。现还未见有关于鸭MyD88的研究,本试验克隆出鸭MyD88部分cDNA序列,氨基酸序列比对结果表明,鸭MyD88TIR结构域与禽鸟类同源性较高,在进化中有较高的保守性。
早期的研究认为,MyD88仅在骨髓组织中表达[1],但后来研究证明,MyD88可在哺乳动物的非骨髓组织中表达,且不同组织表达水平存在一定的差异,而且与动物年龄也有一定的关系[10]。以热灭活嗜水气单胞菌刺激中华鳖后48h内,肝、脾和肾组织中MyD88mRNA相对表达量均出现不同程度的增加[11]。本试验检测到鸭的心脏、肝脏、脾脏、肺脏、腔上囊均有MyD88mRNA转录,在肾脏、脑中未检测到,且不同组织中MyD88的表达丰度存在差异,表明MyD88分布于鸭的周围免疫器官、消化器官、呼吸器官、循环器官。提示MyD88在不同种属动物及不同组织部位具有生物多样性。
[1]Lord K A,Hoffman-Liebermann B,Liebermann D A.Nucleotide sequence and expression of a cDNA encoding MyD88,a novel myeloid differentiation primary response gene induced by IL-6[J].Oncogene,1990,5(7):1095-1097.
[2]Feng Y,Zhao H,Xu X,etal.Innate immune adaptor MyD88 mediates neutrophil reeruitment and myoeardial injury after isehemia-reperfusion in mice[J].Am J Physiol Heart Circ Physiol,2008,295:H1311-H1318.
[3]赵永刚,周艳春,李明才,等.TLR/MyD88信号通路与自身免疫性疾病[J].生命的化学,2008,28(4):457-460.
[4]李跃华,哈团柱,陈琪,等.MyD88依赖性核因子-κB信号途径在心肌肥大发生过程中的调控作用[J].中华医学杂志,2005,85(4):267-272.
[5]冯艳,王芳,陈襄文,等.MyD88缺去突变基因转染降低病原茵感染的人呼吸道上皮细胞IL-8的分泌[J].生物医学工程学杂志,2006,23(5):1092-1095.
[6]Björkbacka H,Kunjathoor V V,Moore K J,etal.Reduced atherosclerosis in MyD88-null mice links elevated serum cholesterol levels to activation of innate immunity signaling pathways[J].Nat Med,2004,10(4):416-421.
[7]唐光亮,范慧敏,刘中民.慢病毒介导siRNA干扰MyD88表达对大鼠肺泡巨噬细胞功能的影响[J].同济大学学报:医学版,2010,31(3):9-14.
[8]李强,李学伟,朱砺,等.猪 MyD88基因的克隆及组织表达谱分析[J].畜牧兽医学报,2009,40(10):1429-1434.
[9]Yafeng Qiu,Yang Shen,Xiangdong Li,etal.Molecular cloning and functional characterization of a novel isoform of chicken myeloid differentiation factor 88(MyD88)[J].Developmental and Comparative Immunology,2008(32):1522-1530.
[10]Tohno M,Shimazu T,Aso H,etal.Molecular Cloning and Functional Characterization of Porcine MyD88Essential for TLR Signaling[J].Cell Mol Immunol,2007,4(5):369-376.
[11]朱炳林,李俊,方维焕,等.中华鳖MyD88部分序列克隆及其在组织中的表达差异分析[J].水产学报,2010,34(7):1018-1023.

