亚抑菌浓度黏菌素对大肠杆菌外膜蛋白表达量及氧氟沙星摄入量的影响
魏述永,吴俊伟,陈红伟,李 赛,刘俊玮
(西南大学荣昌校区动物医学系,重庆 荣昌402460)
动物源大肠杆菌喹诺酮类药物(Qs)耐药性控制研究具有巨大的经济意义和社会意义,目前国内外研究主要集中在新药开发、外排泵抑制剂等方面[1-3],但新药开发并不是控制耐药性的有效手段,外排泵抑制剂研究距离实际应用也有很大的距离。本文在前期研究发现,亚抑菌浓度黏菌素可以增加FQs对耐药大肠杆菌抗菌作用的基础上[4],以亚抑菌浓度黏菌素处理大肠杆菌,探讨其对外膜蛋白表达量及OF摄入量的影响,从而为大肠杆菌对喹诺酮类药物耐药性控制提供新思路。
1 材料与方法
1.1 材料 大肠杆菌质控菌株ATCC25922,购自美国菌种保存中心;FQs耐药株29-2,西南大学荣昌校区药学教研室分离保存。硫酸黏菌素,含量98%,批号:0809051;氧氟沙星,含量99.4%,批号:200806023;均由重庆方通动物药业有限公司提供。蛋白提取相关试剂,均购自上海生工生物工程技术服务有限公司。Waters2695高效液相色谱仪,Empower色谱工作站,美国Waters公司。
1.2 色谱条件[5]Diamonsil C18柱(250nm×4.6 nm,5μm);流动相:0.05mol/L枸橼酸-乙腈(79∶21),用乙醇胺调节pH 值至4.0;流速:1.0mL/min;进样量:20μL;激发波长:295nm;发射波长:505nm;柱温:40℃;Waters2475荧光检测器。
1.3 黏菌素亚抑菌浓度的测定及细菌培养 采用临床和实验室标准协会(clinical and laboratory standards instituet,CLSI)推荐的琼脂稀释法测定黏菌素对受试菌的MIC,并以含1/2MIC黏菌素的LB培养液培养细菌过夜。
1.4 外膜蛋白提取、含量测定及SDS-PAGE 参照 Kalle B(1989)的方法并改进[6]。LB培养液培养至 OD600=1A,30mmol/L Tris Cl(pH 值7.5)洗涤湿菌1次,精密称取3.000 0g湿菌,40mL溶液(含冷30mmol/L Tris HCl、1mmol/L MgCl2、0.1 mg/mL DnaseⅠ、RnaseB,pH 值7.5)重悬,冰浴、超声破碎,2 000r/min离心10min,去除未破碎细胞,取上清加入终浓度2%十二烷基肌酸钠,20℃培养20min去除内膜及非膜蛋白,100 000g冷冻离心1h去上清,蒸馏水温和洗涤沉淀,1.1mL溶液(1%SDS、0.5mol/L NaCl、30mmol/L Tris HCl、10mmol/L EDTA,pH值7.5)溶解沉淀中的膜蛋白,超声裂解2min,37℃培养30min,100 000r/min冷冻离心15min,上清为膜蛋白。分别于260 nm、280nm处测定蛋白样品的吸光度,按照公式“蛋白浓度(mg/mL)=1.450A280-0.740A260”计算蛋白含量[7]。对蛋白样品进行SDS-PAGE检测,积层胶为5%,分离胶为8%,点样量均为10μL/孔。电泳完毕后以考马斯亮蓝R250对凝胶染色,过夜,用脱色液(含30%甲醇,10%冰醋酸)脱色至蛋白条带清晰为止。
1.5 细菌对OF的摄入动力学试验
1.5.1 标准曲线的绘制 将 OF用0.1mol/L盐酸甘氨酸(pH 值3.0)配成浓度为1×10-5、5×10-5、2×10-4、1×10-3、2×10-3、1×10-2、2×10-2mg/L和1×10-1mg/L,采用高效液相色谱荧光检测法测定相应峰面积后,绘制峰面积与OF含量的标准曲线。
1.5.2 菌体内 OF 摄入量的测定[8]将29-2和ATCC25922分别接种于20mL LB肉汤培养基中,37℃摇床培养至指数生长中期(OD650=0.7~0.8),4 000r/min(4℃)离心10min,收集菌体称重,用50 mmol/L PBS(pH 值7.0)冲洗2次,PBS重悬细菌(使细菌浓度为40mg/mL),37℃温浴10min;加Colisitin(0.25、0.125μg/mL)、OF(10μg/mL)于菌液中,分别在加入 OF后的10、30、60、120、180、300、600、900、1 500s时取样(每管取0.25mL);取样后,立即加1.25mL预冷的PBS(同上),8 000r/min(4℃)离心5min,沉淀用缓冲液洗1次,同样条件离心,弃上清,沉淀物加盐酸甘氨酸缓冲液(0.1 mol/L,pH 值3.0)1mL,26℃水浴2h;离心沉淀,取上清液用高效液相进行荧光检测。
1.6 处理前后受试菌对OF的MIC 采用临床和实验室标准协会(CLSI)推荐的琼脂稀释法测定Sub-Colistin处理前后受试菌对OF的MIC,比较处理前后药物敏感性变化。
2 结果
2.1 Sub-Colistin对受试菌OF MIC的影响 加入Sub-Colisitin后,质控菌、耐药菌对OF的敏感性升高1倍,见表1。
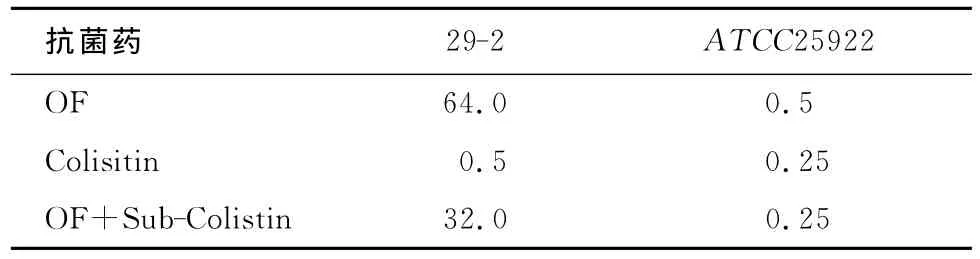
表1 受试菌的 MIC值(μg/mL)
2.2 外膜蛋白含量测定 见表2。
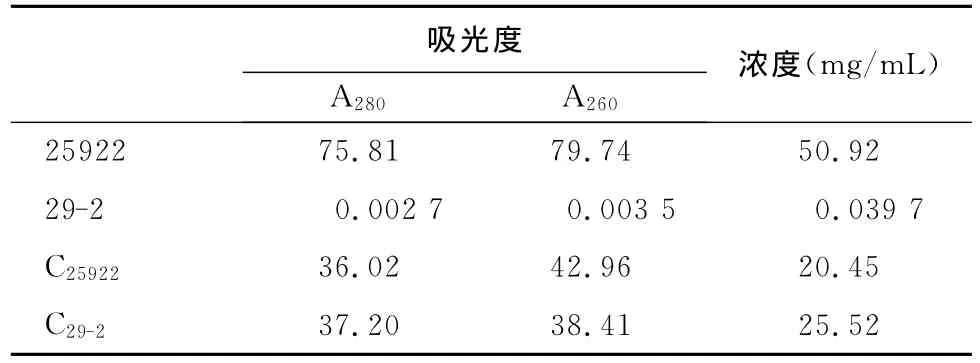
表2 外膜蛋白含量
2.3 SDS-PAGE结果 见图1。

图1 SDS-PAGE电泳结果
2.4 受试菌OF摄入量结果 见表3和图2。
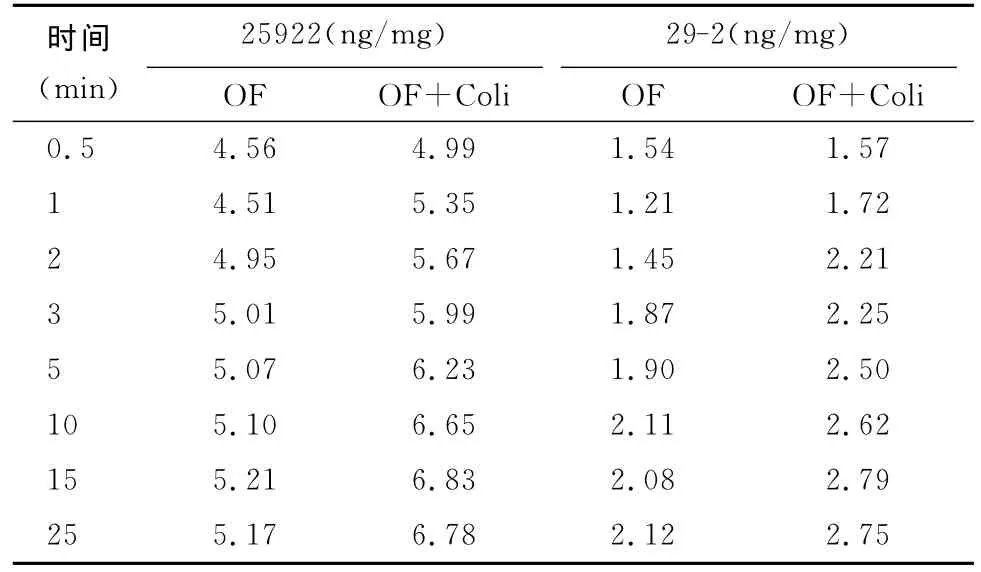
表3 受试菌OF摄入量
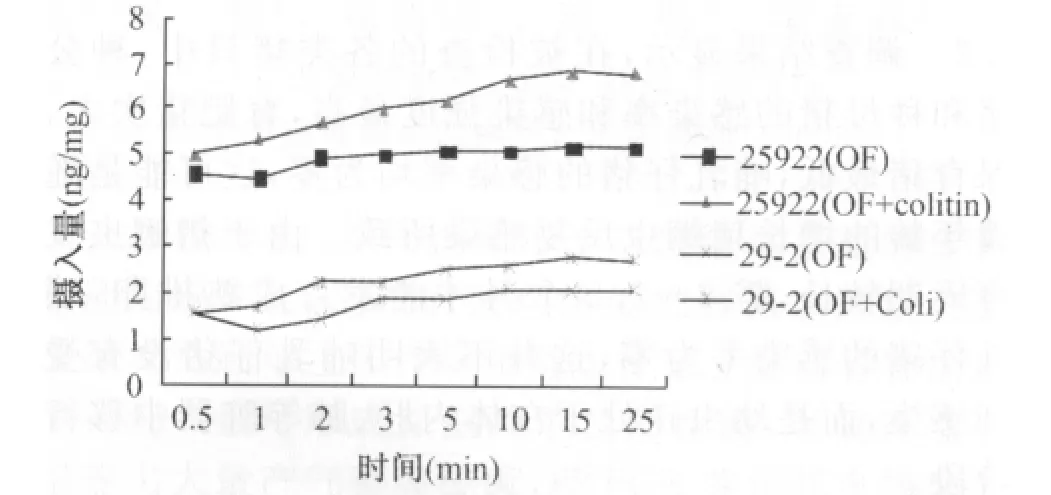
图2 OF菌体摄入量结果
3 讨论
喹诺酮类药物必须进入菌体内部才能发挥作用,大肠杆菌外膜上与Qs转运有关的有两个通道,分别称为OmpF和OmpC,当OMP表达量降低影响药物转运时,细菌即可发生耐药[7-8],但 Hirai K 对大肠埃希氏菌norC突变株的研究表明,仅由膜通透性降低所引起的药物蓄积浓度减少极其有限[9]。
本研究结果显示,ATCC25922与OF耐药菌29-2外膜蛋白有明显差异,29-2外膜蛋白表达量低(试验条件下为0.0397mg/mL),电泳检测没有蛋白条带显示,说明29-2存在外膜蛋白表达降低的耐药机制。Sub-Colistin处理后,29-2OMP表达量明显增多,达到 25.52mg/mL,与黏菌素处理后ATCC25922的表达量相当(20.45mg/mL),说明黏菌素可使29-2外膜蛋白表达量显著增加,但具体原因尚无相关报道,有待深入研究。质控菌黏菌素处理后,OMP量有所下降,可能与黏菌素本身抑菌作用有关。结合OF菌体摄入量分析,29-2的摄入量(1.21~2.79ng/mL)明显低于ATCC25922(4.51~6.83ng/mL),与其对 OF的敏感性相符,Sub-Colistin处理后,2株细菌OF的摄入量均增加1ng/mL左右(见2.4),说明Sub-Colistin处理对于质控菌及耐药菌OF摄入量的影响差异不大,这也是2株细菌Sub-Colistin处理后OF的敏感性仅升高1倍(见2.1)的原因。上述结果表明,Sub-Colistin处理后,耐药菌OMP表达量升高,但对大肠杆菌OF摄入量及敏感性的恢复作用有限,与Hirai K[9]报道相符。说明OMP表达量降低不是导致临床分离多重耐药大肠杆菌29-2对OF耐药的决定原因。
[1]Zheng J,Cui S,Meng J.Effect of transcriptional activators RamA and SoxS on expression of multidrug efflux pumps AcrAB and AcrEF in fluoroquinolone-resistant Salmonella typhimurium[J].Journal Antimicrob Chemother,2009,63(1):95-102.
[2]O'regan E,Quinn T,Pag SJM.Multiple regulatory pathways associated with high-level ciprofloxacin and multi-drug resistance in Salmonella enterica serovar enteritidis:in-volvement of RamA and other global regulators[J].Antimicrob Agents Chemother,2009,53(3):1080-1087.
[3]张志平.喹诺酮类抗菌药研究的新进展[C]//第四届全国喹诺酮类抗菌药科研与临床应用研讨会论文(摘要)汇编.成都:中国抗生素杂志社,2000:1-20.
[4]吴俊伟,杨俊卿.恩诺沙星与硫酸黏菌素联合抗菌活性的研究[J].西南农业大学学报,2006,28(4):558-561.
[5]Cattoir V,Lesprit P,Laseols C,etal.In vivo selection during ofloxacin therapy of Eseherichia coli with combined topoisomerase mutations that confer high resistance to ofloxacin but susceptibility to nalidixic acid[J].Journal Antimicrob Chemother,2006,58(5):1054-1057.
[6]Kalle B,Gehring S,Hiroshi N.Existence and Purification of Porin Heterotrimers of Escherichia coli K12OmpC,OmpF,and PhoE Proteins[J].The Journal of Biological Chemistry,1989,264(5):2810-2815.
[7]Lynch M J,Drusano G L,Mobley H L T.Emergency of resistance to Imipenem in pseudomonas aeruginosa[J].Antimicrob Agents Chemother,1987,31(12):1892-1896.
[8]Fabio F,Patricia N,Paula G,etal.Ciprofloxacin interactions with bacterial protein OmpF:Modelling of FRET from a multi-tryptophan protein trimer[J].Biochimica et Biophysica Acta,2007,1768:2822-2828.
[9]Hirai K,Aoyama H,Suzue S,etal.Isolation and characterization of norfloxacin-resistant mutants of Escherichia coli K-12[J].Antimicrob Agents Chemother,1986,30(2):248.

