mRNA差异显示法筛选黄花石蒜中加兰他敏合成相关基因
唐金凤,鲁耀邦,桂柳姿
(湖南中医药大学药学院,中药药性与药效三级科研实验室,省中药现代化研究实验室,湖南 长沙410208)
黄花石蒜(Lycoris aurea Herb.)系石蒜属植物,内含生物碱、多糖、黄酮、氨基酸及凝集素等化学成分[1-3],其中加兰他敏含量比石蒜属其他植物高[4]。加兰他敏是治疗阿尔茨海默氏病(AD)的首选药物之一。临床研究表明,加兰他敏可明显改善AD 患者的认知能力且毒副作用小,其作为治疗轻度至中重度AD 的药物已在欧盟国家上市[5-7]。通过相关文献研究发现:七月份的黄花石蒜花中加兰他敏的含量花中含量最高,茎(花葶)含量最少[8],另有文献表明花中花蕊部分加兰他敏含量最高[9],提示黄花石蒜不同部位中生物活性物质加兰他敏合成相关关键酶基因及加兰他敏生物合成代谢途径存在差异。目前加兰他敏生物合成代谢途径尚不明确,本实验以此为立题依据,借助近年来检测基因的一种高效方法—mRNA 差异显示技术(DD-PCR)[10],研究黄花石蒜的花蕊与花葶的差异表达,并对其克隆进行生物信息学分析,为黄花石蒜中加兰他敏合成代谢提供可靠的理论依据。
1 材料与方法
1.1 材料
黄花石蒜采自于湖南衡山,经湖南中医药大学中药鉴定教研室潘清平教授鉴定为石蒜科石蒜属植物Lycoris aurea Herb.。
1.2 主要试剂
RNA 提取试剂盒购自TIANGEN 公司;26 条随机引物和3 条锚定引物购自上海生物工程有限公司;反 转 录 酶M-MLV,RNasin Inhibitor 购 自Promega 公司;QIAEX Gel Extraction Kit 购自美国QIAGEN 公 司;PMD19-T Vector 购 自TaKaRa 公司。
1.3 方法
1.3.1 黄花石蒜花蕊与花葶总RNA 的提取 参照TIANGEN 植物总RNA 提取试剂盒的说明书进行操作[11]。
1.3.2 cDNA 合成 参照M-MLV 试剂说明书操作,反转录所用的锚定引物与PCR 所用的锚定引物一致,最后将合成的cDNA 保存于-20 ℃。
1.3.3 差异显示PCR 用3 种锚定引物与26 种随机引物的不同组合,分别以花蕊和花葶的反转录产物为底物进行156 个PCR 反应[11]。
1.3.4 差异显示片段的聚丙烯酰胺凝胶电泳(PAGE) PCR 产物在6%PAGE 胶上电泳,将PCR产物与6×loading buffer 以4∶1 比例混匀,上样,以8V/cm 的恒定电压电泳至溴酚蓝移出胶外,二甲苯氰FF 离胶底部1.5 cm 处,停止电泳。对凝胶进行染色参照梁宏伟等[12]改良的银染方法,于26 ℃60 r/min 震荡箱中振摇显影。用GIS-1000B Tanon 凝胶成像系统观察照相并保存图片。
1.3.5 PAGE 电泳差异显示片段的回收及回收片段的第二次PCR 反应 参照王永成等[13]的方法略有改进,用无菌水清洗胶若干次,将差异条带用消毒后的手术刀片切下并编号;用无菌水清洗条带2 次,每次200 μL;用灭菌的Tip 头将胶碾碎;加入30 μL无菌水,用封口膜将管口封严;沸水中煮8 min;4 ℃12 000 r/min 离心2 min,取3~4 μL 上清液进行第二次PCR,第二次PCR 反应体系与条件同第一次PCR 反应。通过1.2%琼脂糖凝胶电泳检测目的条带。
1.3.6 回收片段的克隆 (1)回收片段二次PCR 产物的纯化:参考QIAGEN 的琼脂糖凝胶DNA 回收试剂盒说明书中具体步骤进行。(2) 纯化产物的连接反应:参照TaKaRa 公司的PMD19-T Vector 说明书进行操作。(3)克隆:参照陶杰等[14]的方法进行。将克隆所得的阳性菌液送上海博尚公司进行测序。
1.3.7 差异显示片段序列比对及分析 在GenBank数 据 库(网 址 为:http://www.ncbi.nlm.nih.gov)中,将所测序列通过BLASTN 软件及BLASTX 软件进行分析,寻找与其它蛋白序列的同源性。
2 结果
2.1 mRNA 差异显示PCR
以随机引物与锚定引物配对,扩增cDNA,用6%聚丙烯酰胺凝胶电泳分离差异条带,如图1所示。
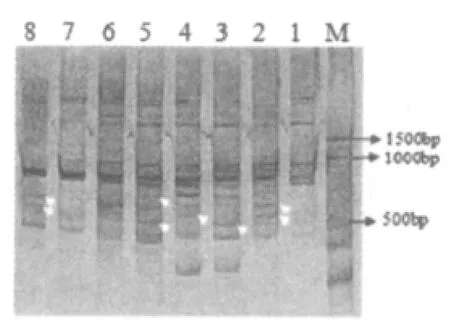
图1 6%聚丙烯酰胺凝胶电泳图
2.2 差异条带的第二次扩增及凝胶回收
从6%聚丙烯酰胺凝胶中回收差异条带,并进行第二次PCR 扩增,经1.2%琼脂糖凝胶电泳,证实其为单一条带,如图2所示。通过QIAGEN 公司提供的普通琼脂糖凝胶电泳DNA 回收试剂盒回收差异条带用于克隆。
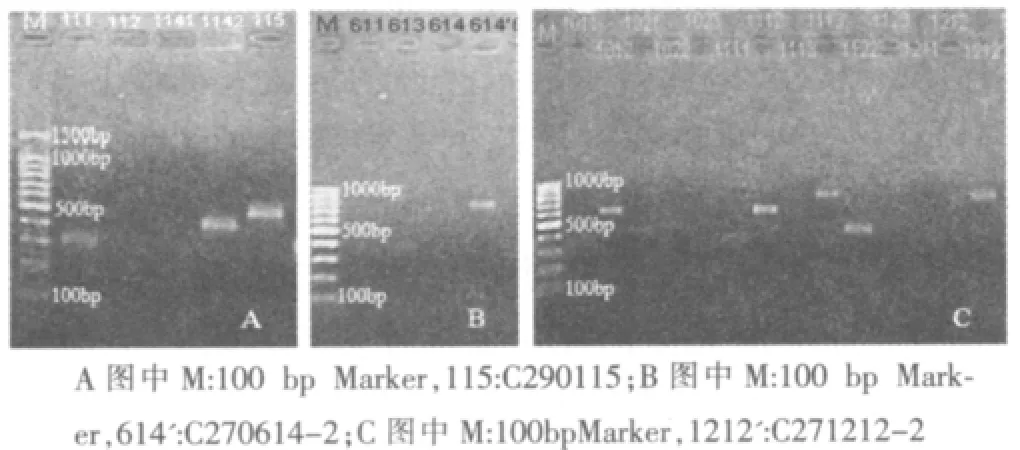
图2 差异条带琼脂糖凝胶回收电泳图
2.3 差异条带克隆及转化子的鉴定
将回收的差异DNA 条带连接至PMD19-T 载体中,转化后,将菌落进行PCR,经1.2%琼脂糖凝胶电泳,证实重组质粒中含有插入的目的基因片段(如图3)。
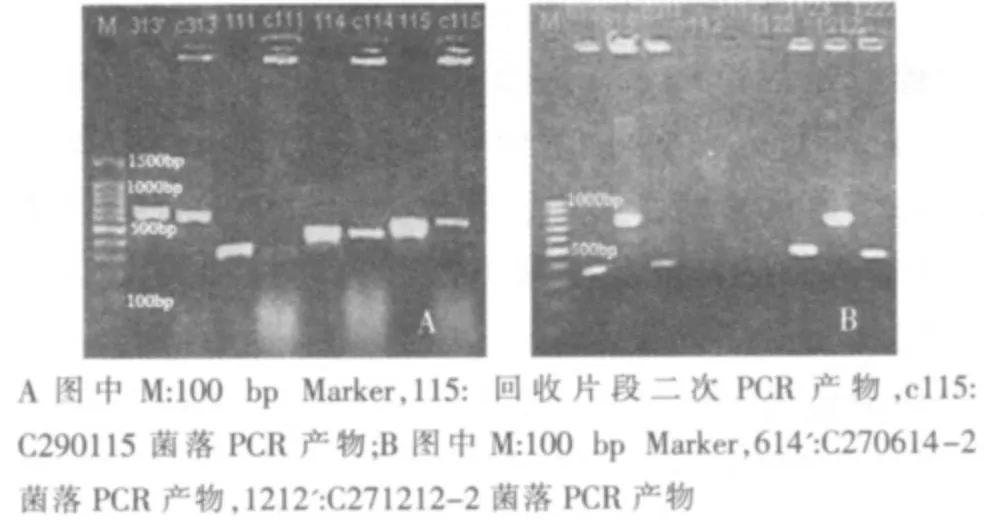
图3 目的基因的鉴定电泳图
2.4 差异条带的序列分析及同源性比较
本试验最终得到44 条差异条带,通过BLASTN数据库及BLASTX 数据库进行同源性比较,发现其中C290115 与快速碱化因子前体、C270614-2 与脱乙酰酶组蛋白14、C271212-2 与I 类热休克蛋白有较高的同源性。BLASTN 及BLASTX 比对如表1。

表1 差异片段在GenBank 中Blastn 及Blastx 分析
3 讨论
目前,对黄花石蒜的研究主要致力于愈伤组织培养[15-17]和化学成分[1-3]及植物组织中加兰他敏的定位方面[18],而未见加兰他敏生物合成代谢途径方面的研究报道。本试验旨在从基因转录水平研究加兰他敏生物合成代谢途径。我国20世纪60年代开始石蒜碱高含量植物的寻找工作,对石蒜属植物鳞茎中加兰他敏的含量测定的结果表明,黄花石蒜为石蒜属植物中加兰他敏的含量最高的物种之一[19]。7月份黄花石蒜花中加兰他敏含量最高,根次之,鳞茎和茎(花葶)中含量最少[8],此结果与李子璇等[9]发现结果一致,说明这个时期同一生存条件下石蒜中的加兰他敏主要富集于生殖器官,尤其花蕊中;8月份的黄花石蒜不同部位中加兰他敏主要集中在鳞茎中,须根、叶、花、花苔中则含量较少[21],说明这一时期下鳞茎是加兰他敏的主要储存部位。本试验通过比较7月份的黄花石蒜花蕊和花葶的基因转录水平上存在差异,筛选出的三个同源序列中其中快速碱化因子前体基因和脱乙酰酶组蛋白14 基因同源序列可能与加兰他敏的生物合成代谢途径有关,其功能的验证有待后续实验的进行。在黄花石蒜的花蕊中还克隆出热休克蛋白基因,推测其可能因外界气温的变化而调控加兰他敏的代谢及运输,此结果有待进一步研究。差异显示DD-PCR 克隆出的44 个差异条带中,大部分为未知,有待进一步验证及分析。
[1]杨 郁,黄胜雄,赵毅民,等.黄花石蒜中的黄酮类成分[J].天然产物研究与开发,2005,17(5):539-541.
[2]王晓燕,黄敏仁,韩正敏,等.石蒜属植物忽地笑中化学成分的GC-MS 分析[J].中草药,2007,38(2):188-188,217.
[3]孙 杨,彭 沥,陈 胜,等.温度、酸碱度和变性剂对黄花石蒜凝集素活性和构象的影响[J].四川大学学报:自然科学版,2008,45(6):1 514-1 518.
[4]肖培根.新编中药志[M].北京:化学工业出版社,2001:289-293.
[5]Luis Marco,Maria do Carmo Carreiras.Galathamine,a Natural Product for the Treatment of Alzheimer’s Disease [J].Recent Patents on CNS Drug Discovery,2006(1): 105-111.
[6]李子璇,江 海,曹小勇,等.石蒜植株中加兰他敏的分布与含量测定[J].江苏农业科学,2009(3): 290-292.
[7]栾 伟.石蒜中加兰他敏的微波辅助提取、分离和分析的研究[D].中山大学硕士学位论文,2004.
[8]聂媛媛,周海翔,彭 菲,等.HPLC 法测定黄花石蒜不同部位的加兰他敏含量[J].湖南中医药大学学报,2009,29(5):51-53.
[9]李子璇,江 海,曹小勇,等.石蒜植株中加兰他敏的分布与含量测定[J].江苏农业科学,2009(3):290-292.
[10]Liang P,Pardee A B.Differtential display of eukaryotic messenger RNA by mean of the polymerase chain reaction[J].Science,1992,257(5072):967-971.
[11]唐金凤,鲁耀邦,桂柳姿.黄花石蒜花蕊和花葶组织中总RNA 提取方法的比较[J].湖南中医药大学学报,2012,32(1):31-34.
[12]梁宏伟,王长忠,李 忠,等.聚丙烯酰胺凝胶快速、高效银染方法的建立[J].遗传,2008,30(10):1 379-1 382.
[13]王永成,巩振辉,李大伟,等.利用mRNA 差异显示技术克隆辣椒抗疫病相关基因片段[J].北方园艺,2008(12):149-152.
[14]陶 杰,单 颖,荆迎军,等.mRNA 差异显示法筛选和克隆东亚飞蝗抗药性相关基因[J].南开大学学报(自然科学版),2009,42(1):107-111.
[15]茹巧美,裴真明,郑海雷.忽地笑愈伤组织培养条件对加兰他敏合成的影响[J].广西植物,2010,30(3):411-415.
[16]赵志敏,钟湘云,杨 帅,等.黄花石蒜愈伤组织培养研究[J].湖南中医药大学学报,2009,29(5):48-50.
[17]肖 艳,彭 菲,王 清,等.黄花石蒜的组织培养研究[J].湖南中医学院学报,2006,26(1):27-28.
[18]王晓燕,王鹏凯,黄敏仁,等.加兰他敏在忽地笑营养器官中的定位(简报)[J].分子细胞生物学报,2007,40(5):339-345.
[19]袁菊红,胡绵好,夏 冰.石蒜属不同种间生物碱含量差异性研究[J].江西农业大学学报,2010,32(3):560-565.
[20]陈 斌.石蒜生物碱的高速逆流色谱制备、含量动态变化及合成途径关键酶PAL 基因核心片段克隆的研究[D].重庆:西南大学硕士学位论文,2009.

