月腺大戟与狼毒大戟对人肝癌细胞BEL-7402体外增殖的影响对比研究Δ
何华红,王华倩,严小红,李薇#(.广州市药品检验所,广州5060;.广东工业大学轻工化工学院,广州50006)
中药材种类繁多,异物同名、一药多源现象(多基源)给中药材标准制订和质量评价造成了极大的不便。随着中药药效物质基础研究的深入,药材质量标准的提升,多基源品种标准单列,一物一名是大势所趋。我国是中药材大国,为扩大药源,满足制药工业等需要,《中国药典》全面取消多基源品种的收载并不现实。但为了实现规范化、标准化,在科学研究的基础上,对多源性品种进行逐步的限制很有必要。化学成分或药理、药效差别甚远的多基源药材并列为一味药材并不合理,这必然会导致品种混乱和临床安全的不可控。
狼毒是2010年版《中国药典》(一部)正式收载的一类多基源中药材,其定义为大戟科植物月腺大戟(Euphorbia ebractedata)或狼毒大戟(Euphorbia fischeriana)的干燥根[1]。据文献查询和本课题研究结果表明,月腺大戟和狼毒大戟在毒理和药理、药效方面颇多不同,2010年版《中国药典》笼统将其收录定义为同一药材似有不妥,以现代药理方法对其进行毒理和药理、药效对比研究可以达到正本清源目的。据2010年版《中国药典》记载,狼毒有散结的功效,结在中医泛指一切有形的肿块或是气象不畅等证,有形的肿块有恶性肿瘤、良性肿瘤、囊肿、淋巴结肿大、皮下结节、皮疹等。本文主要对月腺大戟和狼毒大戟体外抗肿瘤活性进行对比研究。
1 仪器与材料
1.1 仪器
Axiovert 40CFI型倒置显微镜(德国蔡氏公司);Nu-425-400 E型生物安全柜、Nu-4750 E型CO2培养箱(美国Nuaire公司);Versa Max型连续波长酶标仪(美国Molecular Devices公司);RE-301型旋转蒸发仪(上海予正仪器设备有限公司)。
1.2 试药
月腺大戟购于安徽省亳州药材市场,狼毒大戟由康臣药业有限公司提供,均经广州市药品检验所中药室刘柏英主任药师鉴定为真品;RPMI 1640细胞培养基(美国Gibco公司);胎牛血清(杭州四季青生物工程材料有限公司,批号:100226);MTT(德国Sigma公司,批号:091206);胰蛋白酶(广州标迈生物科技有限公司,批号:201001);注射用环磷酰胺(CTX,山西普德药业股份有限公司,批号:20090902);其余试剂均为分析纯。
1.3 动物
SPF级SD大鼠40只,体重180~200 g,♀♂兼半,由广东省医学实验动物中心提供(动物生产许可证号:SCXK(粤)2008-0003)。
1.4 细胞株
人肝癌细胞株BEL-7402(购于中科院上海生命科学研究所细胞库),以RPMI1640培养液(含10%胎牛血清,100IU·mL-1青霉素与100 IU·mL-1链霉素),37℃、5%CO2、饱和湿度常规培养,传代。
2 方法
2.1 受试物的制备
药材打粉,37℃烘干,称取适量药粉,乙醇超声提取(2次,每次30 min,滤液无色),定性滤纸过滤,收集滤液,经0.45µm滤膜过滤,收集滤液,经旋转蒸发仪除去残留溶剂得浸膏,称取适量浸膏,用适当浓度的吐温80制成混悬液,备用。
2.2 分组与含药血清制备[2~4]
实验分为9组,即空白对照(等容生理盐水,ig)、溶剂对照(等容吐温80,ig)、CTX(100 mg·kg-1,ip)和月腺大戟高、中、低剂量(0.97、0.485、0.2425 g·kg-1,ig)以及狼毒大戟高、中、低剂量(0.05、0.025、0.0125 g·kg-1,ig)组。实验前禁食12 h,参考笔者以前急性毒性实验数据,月腺大戟和狼毒大戟均以其半数致死量(LD50)的1/5为高剂量(月腺大戟醇提浸膏为0.97 g·kg-1;狼毒大戟醇提浸膏为0.05 g·kg-1),1∶0.5为剂间比。每天给药1次,连续3 d。于末次给药后1 h在无菌条件下自腹主动脉采血,4℃下静置过夜,3500 r·min-1离心30 min,分离血清,将各组内大鼠血清等量混匀,56℃、30 min灭活,0.22µm滤膜过滤除菌,-20℃贮藏,备用。
2.3 MTT比色法测定生长抑制率(IR)[5]
BEL-7402细胞株常规培养,取生长旺盛对数生长期细胞常规消化,用新鲜含血清培养液配制成1×104个/mL,96孔板各孔加细胞悬液100 μL,37℃、5%CO2、饱和湿度常规培养,24 h后换成无血清的培养基,加入受试血清(每孔10 μL),各组均设6个复孔,另设置正常无血清的培养液空白对照组6孔(每孔100 μL),调零孔6孔(每孔只加100 μL无血清的培养液,不加细胞),继续培养72 h后,观察细胞形态。每孔加5 mg·mL-1的MTT溶液20 μL,置培养箱内继续培养5 h,弃去孔内液体,每孔加入200 μL二甲基亚砜(DMSO),慢速振荡10 min,于酶标仪570 nm波长处检测光密度(A)值,取6孔平均值。根据下式计算细胞IR:IR(%)=(1-实验组A值/空白对照组A值)×100%。
2.4 集落形成试验[6]
BEL-7402细胞株常规培养,取生长旺盛对数生长期细胞常规消化,用新鲜含血清培养液分级稀释,配制成200个/mL悬液,按每皿200个细胞接种于培养皿中,十字方向轻轻晃动培养皿,均匀分散细胞,37℃、5%CO2、饱和湿度常规培养24 h,弃去培养液,换成无血清的培养液,加入受试血清(每皿20 μL),各组均设3个复皿,常规培养2周,至肉眼可见克隆,终止培养,弃去培养液,用PBS小心浸洗2次,每皿加纯甲醇5 mL固定15 min,弃去固定液,加适量姬姆萨应用液染色15 min,流水缓慢洗去染色液,空气干燥,肉眼数克隆数,当不能分辨时在倒置显微镜下观察,以>50个细胞计数为1个克隆。按下式计算克隆形成率:克隆形成率(%)=克隆数/接种细胞数×100%。
2.5 统计学方法
SPSS13.0统计软件分析,MTT比色法检测采用双侧t检验,集落形成试验采用χ2检验,P<0.05为差异有统计学意义。
3 结果
3.1 含药血清对肿瘤细胞形态学的影响
倒置显微镜下观察可见,空白对照组与溶剂对照组细胞形态正常,密度大,细胞呈梭形,边缘清晰、光滑,贴壁性好;CTX组细胞贴壁差,细胞变圆,漂浮较多;狼毒大戟低剂量组细胞形态变化不大,贴壁性好,边缘清晰、光滑;狼毒大戟中剂量组细胞形态不规则,细胞边缘不齐;狼毒大戟高剂量组细胞贴壁更差,细胞变圆较多,漂浮细胞多见;月腺大戟各组细胞基本无明显变化。
3.2 含药血清对BEL-7402细胞增殖的影响
高、中剂量狼毒大戟能显著抑制BEL-7402细胞体外增殖,且其抑制效应呈剂量正相关;月腺大戟对BEL-7402细胞体外增殖无明显抑制作用。高、中剂量狼毒大戟能显著抑制BEL-7402细胞体外增殖,降低克隆形成率且其抑制效应呈剂量正相关;月腺大戟对BEL-7402细胞体外增殖和克隆形成率无明显抑制或降低作用。A与IR测定结果见表1;克隆数与克隆形成率测定结果见表2。
表1 A与IR测定结果(±s,n=6)Tab 1 Determination ofAand IR(±s,n=6)

表1 A与IR测定结果(±s,n=6)Tab 1 Determination ofAand IR(±s,n=6)
与空白对照组比较:*P<0.01vs.blank control group:*P<0.01
组别空白对照组溶剂对照组CTX组狼毒大戟高剂量组狼毒大戟中剂量组狼毒大戟低剂量组月腺大戟高剂量组月腺大戟中剂量组月腺大戟低剂量组剂量/g·d·kg--0.10000.05000.02500.01250.97000.48500.2425 A 0.835±0.0320.796±0.0360.263±0.037*0.241±0.015*0.583±0.060*0.810±0.0260.805±0.0370.813±0.0240.851±0.015 IR/%- 570*72*32*4443
表2 克隆数与克隆形成率测定结果(±s,n=3)Tab 2 Determination of amount and formation rate of clone(±s,n=3)
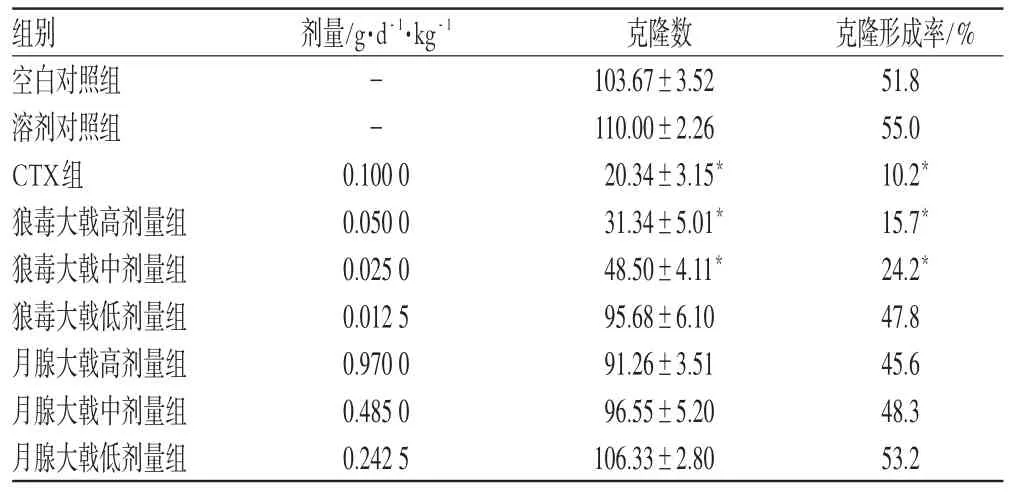
表2 克隆数与克隆形成率测定结果(±s,n=3)Tab 2 Determination of amount and formation rate of clone(±s,n=3)
与空白对照组比较:*P<0.01vs.blank control group:*P<0.01
组别空白对照组溶剂对照组CTX组狼毒大戟高剂量组狼毒大戟中剂量组狼毒大戟低剂量组月腺大戟高剂量组月腺大戟中剂量组月腺大戟低剂量组剂量/g·d-1·kg-1--0.10000.05000.02500.01250.97000.48500.2425克隆数103.67±3.52110.00±2.2620.34±3.15*31.34±5.01*48.50±4.11*95.68±6.1091.26±3.5196.55±5.20106.33±2.80克隆形成率/%51.855.010.2*15.7*24.2*47.845.648.353.2
4 讨论
狼毒体外抗肿瘤药效研究颇多,但存在几个问题:一是没有系统对比狼毒大戟和月腺大戟的体外抗肿瘤活性;二是多采用动物瘤株进行研究,存在人和动物的种属差异问题;三是多采用粗提物直接外加于体外培养细胞,这样一些非生理环境如中药粗制剂的杂质、电解质或鞣质所引起的培养液渗透压和pH等的改变会影响细胞的生长,导致一些假阳性的结果出现[2]。
采用血清药理学方法,取含药血清作用于体外培养人肿瘤细胞株可以克服以上的一些不足,较好地反映出狼毒体外抗肿瘤药理活性。通过系统对比狼毒大戟和月腺大戟的体外抗肿瘤活性,可以看出其不同点,为中药狼毒药材标准制订提供参考。
研究结果表明,狼毒大戟与月腺大戟对于人肝癌细胞BEL-7402体外增殖抑制活性有很大区别,狼毒大戟作用活性明显强于月腺大戟。2010年版《中国药典》笼统将其收录定义为同一药材似有不妥,对其进行系统对比研究很有必要,能达到正本清源,为标准制订提供实验依据的目的。
血清药理学方法也存在诸多待解决的问题,如无确定的最佳给药方案、最佳的采血时间,无法做到体外培养体系内药物浓度与血药浓度相等而又不影响细胞生长等。这些都有可能对实验结果造成影响,从而出现假阴性结果[7]。但在同样实验条件下,两种含药血清所得的结果对于对比其药理活性的不同是有参考价值的。
[1]国家药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:269.
[2]赵万红,曹永孝,袁泽飞.中药血清药理学的方法学探讨[J].中药新药与临床药理,2002,13(2):122.
[3]Iwama H,Amagaya S,Ogihain Y.Effect of shosaikoto,a Japanese and Chinese traditional herbal medicinal mixture on the mitogenic activitg of lipopolysaccharide:a new pharmacological testing method[J].J Ethnopharmacol,1987,21(1):45.
[4]李仪奎.中药药理实验方法学[M].上海:上海科学技术出版社,2006:50.
[5]杨 军,丁 敏,张太君,等.血清药理学方法观察复方斑蝥胶囊对人肝癌细胞SMMC-7721增殖的影响[J].中国药房,2005,16(4):262.
[6]段玉清,周 密,张海晖,等.莲房原花青素对黑色素瘤B16细胞的抑制作用[J].中国药学,2009,44(2):103.
[7]张红敏,谢春光,陈世伟.含药血清体外药理试验的评价[J].中国中西医结合杂志,2004,24(8):741.

