大豆凝集素的分离纯化及活性鉴定
车东升, 刘飞飞, 穆成龙, 张海全, 孙泽威, 秦贵信
(吉林农业大学 动物生产及产品质量安全教育部重点实验室, 动物科学技术学院, 长春 130118)
大豆凝集素(soybean agglutinin, SBA)是指对N-乙酰基D-半乳糖胺/D-半乳糖特异性结合、 由4个亚基构成四聚体的糖蛋白, 分子量约为120 000, 是大豆中主要的抗营养因子之一, 由Liener等[1]分离得到. 大豆凝集素的纯化富集对其在生物技术上的应用具有重要意义[2-5]. 由于传统大豆凝集素纯化方法的纯化效率较低, 纯品成本较高, 因此限制了其纯品在生物学、 医学和动物营养学等领域的应用. 大豆凝集素传统的纯化方法包括离子交换、 磷酸钙层析、 等电点沉淀和硫酸铵分级沉淀等. 张洪渊等[6]采用离子交换纤维素和羟基磷灰石(HA)柱层析等方法分离和纯化了大豆凝集素. 根据不同的亲和介质, 大豆凝集素亲和纯化体系主要分为半乳糖胺-CH-Sepherose 4B[7]、 N-乙酰基-D-半乳糖胺-Sepharose 6B[8-10]和瓜尔胶[5]亲和层析体系. 但以上体系均存在不足: 半乳糖胺-CH-Sepharose 4B的凝胶颗粒和孔径大小限制了流动相的速度; N-乙酰基-D-半乳糖胺-Sepharose 6B的配基N-乙酰基-D-半乳糖胺成本较高; 瓜尔胶纯化体系的效率和纯度较低. 针对上述问题, 本文以性能稳定的配基----半乳糖胺及高流速的琼脂糖固定相----FF-sepharose-4B为填料, 合成了一种廉价、 高效的大豆凝集素亲和层析填料, 降低了大豆凝集素纯化的成本.
1 材料与方法
1.1 试剂与仪器
大豆(丰交7607); FF-Sepharose 4B(美国GE公司); D-Galactosamine HCl(美国Sigma公司); 大豆凝集素标准品(美国Sigma公司); 标准蛋白质Marker(美国GE公司). 其他化学试剂采用国产分析纯.
自动液相色谱分离仪(上海沪西公司); 低温高速离心机(德国Sigma公司, 3K30型); 层析柱(1.5 cm×15 cm); UV1750型紫外可见光分光光度计(日本岛津公司); PHS-3C型酸度计(德国赛多利斯公司); DYY-2C型电泳仪(北京六一仪器厂); 凝胶成像分析仪(美国UVP公司); 透析袋(直径36 mm).
1.2 半乳糖胺-FF-Sepharose 4B填料的制备
1.2.1 凝胶的溶胀与洗涤 先将FF-Sepharose 4B在0.5 mol/L的NaCl溶液中吸水溶胀, 再用200 mL蒸馏水淋洗后经玻璃滤器过滤, 剩余液体由吸取器吸走, 并脱气.
1.2.2 胶基的活化 将10 g脱气后的凝胶悬浮于4 mol/L的NaOH溶液中, 加入18.75 mg NaBH4和5.5 mL C3H5ClO. 待凝胶悬浮液在室温下混合反应90 min后, 将凝胶倒入玻璃滤器中, 先用2 mol/L的NaOH淋洗, 再用蒸馏水稀释至中性, 凝胶依次通过蒸馏水和0.5 mol/L的NaOH淋洗, 脱气后备用.
1.2.3 半乳糖胺交联 将脱气后活化的凝胶悬浮于6 mL含有质量分数为10%半乳糖胺的0.5 mol/L的NaOH溶液中, 搅拌后在室温下静置过夜. 凝胶再用0.5 mol/L的NaOH溶液淋洗玻璃滤器, 衍生物由蒸馏水冲洗至pH为中性, 由0.15 mol/L的NaCl溶液平衡, 并在4 ℃保存备用.
1.3 大豆凝集素粗提液的准备
1.3.1 脱 脂 称取生大豆粉(丰交7607)50 g, 加入500 g正己烷, 室温下搅拌2 h, 静止后更换正己烷, 重复上述步骤3次, 风干后保存备用.
1.3.2 粗 提 取脱脂豆粉(丰交7607)10 g, 溶于500 mL质量分数为0.9%的NaCl溶液中充分搅拌, 以1 000 r/min离心15 min, 取上清液, 经0.45 μm微孔滤膜过滤后进行亲和层析.
1.4 亲和层析分离大豆凝集素
取25 mL胶装柱, 排气, 用质量分数为0.9%的NaCl溶液平衡12 h, 将过滤后的大豆粗提液100 mL 上柱, 并用自动层析仪监测流出层析柱溶液的吸光度, 上样完毕后用质量分数为0.9%的NaCl溶液洗涤杂蛋白, 待洗脱液吸光度回归基线时, 加入0.3 mol/L半乳糖洗脱液洗脱大豆凝集素蛋白, 收集目的蛋白洗脱峰至基线. 将收集目的蛋白溶液用质量分数为0.9%的NaCl溶液透析, 除去半乳糖. 透析后的大豆凝集素用聚乙二醇浓缩. 再将上述浓缩液分装(1 mL/瓶), 冻干, 低温保存.
1.5 GalN-FF-Sepharose-4B的再生
先用6 mol/L的盐酸胍洗脱2~3个柱床体积, 质量分数为0.9%的NaCl溶液平衡3个柱床体积, 再用质量分数为1%的NaOH溶液洗脱2~3个柱床体积, 最后用质量分数为0.9%的NaCl溶液平衡至洗脱液pH不再变化, 即可使GalN-FF-sepharose-4B再生.
1.6 大豆凝集素的分子量及纯度鉴定
将纯化获得的大豆凝集素进行SDS-PAGE检测[11], 检测其分子量及其纯度, 并与大豆凝集素标准品比较. SDS-PAGE步骤见文献[6], 分离胶质量分数为12%, 浓缩胶质量分数为5%, 平行灌制2块胶, 平行点样, 电泳完毕后, 一块凝胶用于考马斯亮蓝染色, 另一块用于免疫原性鉴定.
1.7 大豆凝集素免疫原性鉴定
采用Western blot方法对纯化的大豆凝集素进行免疫原性鉴定, 并与大豆凝集素标准品比较. 用1.6中制备的凝胶转膜[11]后, 取下PVDF膜, 先用蒸馏水洗涤5 min, 再用质量分数为3%的SBA于37 ℃孵育30 min, PBST洗涤3次, 每次3 min, 兔抗大豆凝集素多克隆抗体于37 ℃孵育30 min, PBST洗涤3次, 每次3 min, 羊抗兔IgG抗体于37 ℃孵育30 min, DAB显色3 min后终止反应.
1.8 大豆凝集素凝集活性的测定
采用兔红细胞凝集法鉴定大豆凝集素的凝集活性[12]. 制备兔醛化红细胞悬液, 将纯化的大豆凝集素按2倍梯度稀释在V型血凝版的微孔内, 每孔25 μL, 再加入等体积的醛化兔血红细胞, 于37 ℃孵育90 min. 观察血凝活性, 与标准品比较, 确定纯化后大豆凝集素的血凝活性.

图1 大豆凝集素亲和层析曲线Fig.1 Affinity chromatography curve of SBA
2 结果与分析
2.1 大豆凝集素亲和层析纯化
大豆凝集素亲和层析曲线如图1所示, 其中第一个峰为非特异性洗脱峰, 即杂蛋白的洗脱峰, 第二个峰为特异性峰, 即目的蛋白----大豆凝集素洗脱峰. 用GalN-FF-Sepharose 4B的亲和层析方法获得了大豆凝集素蛋白. 所得大豆凝集素经透析、 浓缩和冻干处理后, 经计算合成的层析填料每毫升能结合10 mg大豆凝集素.
2.2 大豆凝集素的分子量及纯度测定结果
将纯化的大豆凝集素和大豆凝集素标准品比较, 经SDS-PAGE检测, 二者分子量均为30 000, 如图2所示. 实验纯化所得大豆凝集素的分子量与理论值一致. 经UV凝胶分析软件测算的大豆凝集素纯度大于98%.
2.3 大豆凝集素免疫原性鉴定结果
利用大豆凝集素多克隆抗体, 对纯化后的大豆凝集素和标准品进行Western blot鉴定, 二者均在30 000处检测到阳性条带, 如图3所示. 表明纯化的大豆凝集素与标准品具有相同的抗原性, 且成分相同.

1. 低分子量蛋白Marker; 2. Sigma的大豆凝集素; 3. 本实验纯化的大豆凝集素.图2 SDS-PAGE结果Fig.2 Results of SDS-PAGE
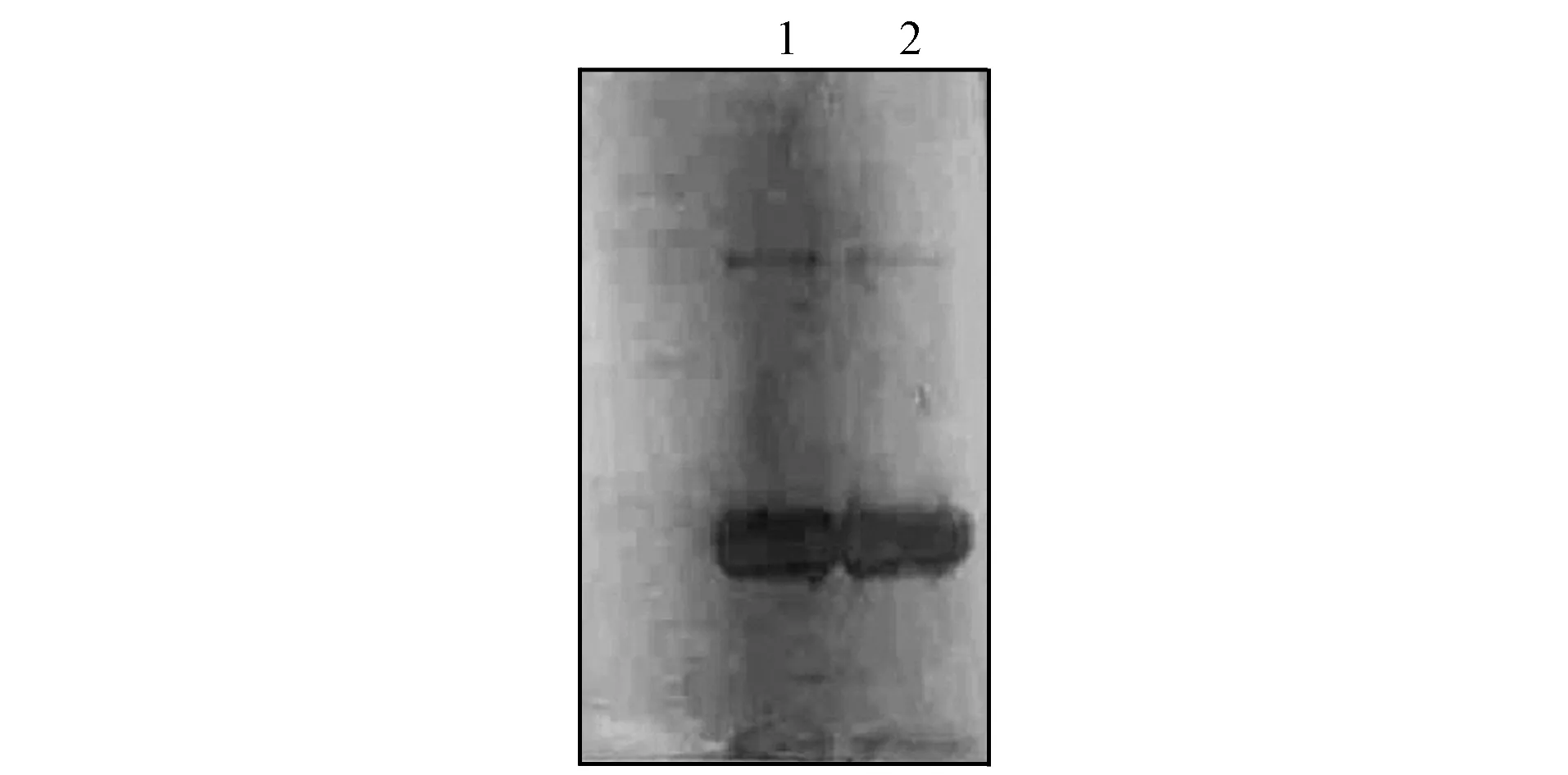
1. Sigma的大豆凝集素;2. 本文实验纯化的大豆凝集素.图3 大豆凝集素Western blot结果Fig.3 Western blot results of SBA
2.4 大豆凝集素凝集活性测定结果
本文采用自制的新鲜兔红细胞悬液, 检测纯化后大豆凝集素的凝集活性, 并与大豆凝集素标准品比较, 结果列于表1. 由表1可见, 纯化后大豆凝集素的血凝效价为1/210, 与标准品相符.
通常大豆凝集素是指分子量为120 000的四聚体, 由两种不同的亚基组成, 具有两个半乳糖结合位点[7]. 目前, 对大豆凝集素的抗营养作用研究较多, 但应用其纯品进行动物实验的研究大多集中在大鼠方面[13], 以家畜和家禽为对象的研究较少. 本文采用了较N-乙酰基半乳糖胺廉价的半乳糖胺为配基, 与FF-Sepharose 4B琼脂糖胶基以环氧结构交联制备填料纯化大豆凝集素, 降低了配基的成本. 采用FF-Sepharose 4B与Matsumoto等[14]合成的Ga1N-Sepharose CL-4B胶基相比, 其流速更快, 并通过超滤的方法将粗蛋白进行初步分离, 从而提高了纯化效率, 有利于规模化制备大豆凝集素. 纯化后的SBA经SDS-PAGE染色后, 其分子量与标准品的分子量一致, 表明分离得到的大豆凝集素纯度较高. Western blot鉴定结果表明, 纯化的SBA与标准品免疫原性相同.
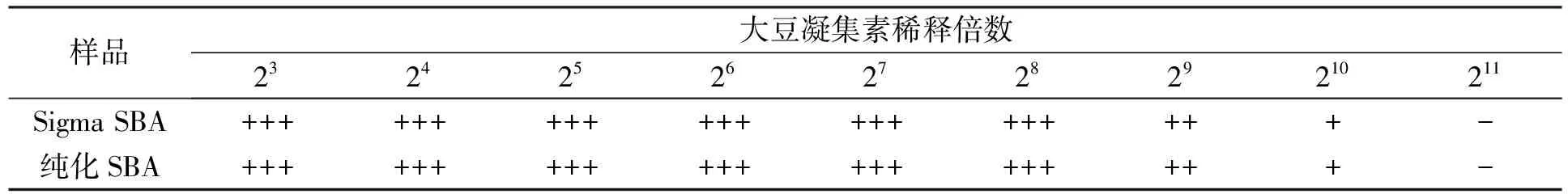
表1 兔红细胞凝集效价的比较
研究表明, SBA可凝集兔、 鼠、 奶牛和人等多种动物的红细胞、 T淋巴细胞和小肠上皮细胞等[15]. 本文利用大豆凝集素与兔红细胞结合产生凝集的特性, 对样品中的大豆凝集素凝集活性进行检测[16], 结果表明, 纯化后大豆凝集素的凝集效价为1/210, 与大豆凝集素标准品一致.
[1] Liener I E, Pallansch M J. Purification of a Toxic Substance from the Defatted Bean Flour [J]. Biol Chem, 1952, 197(1): 29-36.
[2] Sharon N, Lis H. Lectins as Cell Recognition Molecules [J]. Science, 1989, 246: 227-234.
[3] Liener I E. Plant Lectins: Properties, Nutritional Significance, and Function [M]. Washington DC: American Chemical Society, 1997: 31-43.
[4] Nagler A, Morecki S, Slavin S. The Use of Soybean Agglutinin (SBA) for Bone Marrow (BM) Purging and Hematopoietic Progenitor Cell Enrichment in Clinical Bone-Marrow Transplantation [J]. Mol Biotechnol, 1999, 11(2): 181-194.
[5] Friedman L, Brandon D L. Nutrition and Health Benefits of Soy Proteins [J]. J Agric Food Chem, 2001, 49(3): 1069-1086.
[6] ZHANG Hong-yuan, LIU Ke-wu, YANG Shou-zhong, et al. Purification of Lectin, Urease and Trypsin Inhibitor from Soybean [J]. Chinese Journal of Oil Crop Sciences, 1991(1): 41-44. (张洪渊, 刘克武, 杨守忠, 等. 大豆凝集素、 脲酶和胰蛋白酶抑制剂的分离纯化 [J]. 中国油料作物学报, 1991(1): 41-44.)
[7] LI Zhen-tian, QIAO Shi-yan, LI De-fa, et al. Establishment of Indirect Inhibiting ELISA Method to Detect Soybean Agglutinin in the Soybean Products [J]. Chinese Journal of Animal Science, 2004, 40(8): 9-11. (李振田, 谯仕彦, 李德发, 等. 间接抑制酶联免疫吸附法测定大豆凝集素方法的建立 [J]. 中国畜牧杂志, 2004, 40(8): 9-11.)
[8] Vretblad P. Purification of Lectins by Biospecific Affinity Chromatography [J]. Biochem Bio Phys Acta: Protein Structure, 1976, 434(1): 169-176.
[9] 张惟杰. 糖复合物生化技术研究 [M]. 杭州: 浙江大学出版社, 1994: 488-489.
[10] LI Zhen-tian, LI De-fa, QIAO Shi-yan, et al. Anti-nutritional Effects of a Moderate Dose of Soybean Agglutinin in the Rat [J]. Areh Anim Nutr, 2003, 57(4): 267-277.
[11] 郭尧君. 蛋白质电泳实验技术 [M]. 北京: 科学出版社, 1999.
[12] Sharon N, Goldstein I J. Lectin: More Than Insecticides [J]. Science, 1998, 282: 1047.
[13] ZANG Jian-jun. Effects of Soybean Agglutinin on Pancreatic Growth and the Activities of Pancreatic [D]: [Ph D Thesis]. Beijing: China Agricultural University, 2006. (臧建军. 大豆凝集素对大鼠胰腺生长及胰酶活性的影响 [D]: [博士学位论文]. 北京: 中国农业大学, 2006.)
[14] Matsumoto I, Ito Y, Seno N. Preparation of Affinity Adsorbents with Toyopearl Gels [J]. Journal of Chromafography A, 1982, 239(30): 747-754.
[15] Liener I E. Implications of Antinutritional Components in Soybean Foods [J]. Crit Rev Food Sci Nutr, 1994, 34(1): 31-67.
[16] Haemaggutinins J W G. Toxic Constituents in Plant Foodstuffs [M]. New York: Academic Press, 1980.

