DATS对LPS诱导ALI小鼠抗氧化功能及ICAM-1表达的影响
朱桂军,孟志强,李 娟,武新慧,王澜涛,陈玉红,胡振杰
(1.河北医科大学第四医院重症医学科,河北 石 家庄 050011;2.邢台医学高等专科学校,河北 邢台 054000)
急性肺损伤(acute lung injury,ALI)的发病机制复杂,至今尚无特殊有效的治疗方法。肺部氧化/抗氧化平衡失调在ALI病程中起重要作用。炎症反应时的氧化应激是ALI的重要发病机制之一,减少活性自由基团的产生,保护氧化/抗氧化平衡,是ALI研究的一个重要方面[1-2]。二烯丙基三硫(diallyl trisulfide,DATS)是大蒜提取物的主要有效成分,具有明确的抗氧化作用[3-4]。我们前期研究表明,预防性应用DATS对脂多糖(lipopolysaccharide,LPS)诱导的小鼠具有保护作用[5]。本研究主要探讨DATS的抗炎及抗ALI作用是否与其抗氧化作用有关。
1 材料与方法
1.1 实验动物及分组 健康♂无热原昆明(KM)小鼠48只,体质量18~22 g之间,河北省实验动物中心提供。于控制的条件下饲养,12 h∶12 h光-暗周期,给予标准小鼠饲料。实验动物适应环境后,腹腔注射脂多糖(lipopolysaccharide,LPS(E.coli0111:B4,Sigma公司)建立小鼠肺损伤模型[6]。实验动物随机分为4组:① ALI组,每天腹腔注射等体积生理盐水1次,连续注射7 d后,腹腔注射LPS 10 mg·kg-1;② DATS预防组,每天腹腔注射DATS(大蒜素注射液,山东鲁抗辰欣药业有限公司,国药准字:H20054020,)30 mg·kg-1一次,连续注射 7 d后,腹腔注射LPS 10 mg·kg-1;③ DATS治疗组,每天腹腔注射与DATS等体积生理盐水1次,连续注射7 d后,腹腔注射 LPS 10 mg·kg-1,之后30 min再腹腔注射DATS 30 mg·kg-1一次;④生理盐水对照组,每天腹腔注射与DATS等体积生理盐水1次,连续注射7 d。各组动物(n=6)于注射LPS后2 h、6 h脱颈处死。留取左肺,测定肺组织湿/干重。将右肺中叶固定于4%多聚甲醛溶液中,用免疫组化法检测ICAM-1。再将生理盐水灌洗剩余的右肺,滤纸吸干,即刻保存于-70℃液氮中,用于测定肺组织MPO、MDA、SOD、T-AOC。
1.2 肺系数、肺组织湿/干重比的测定 实验结束时准确称量小鼠体重。各组动物于2 h、6 h脱颈处死,迅速开胸取肺脏,吸干表面血污后,称重。再取左肺,滤纸吸干表面水份,称肺湿重(W),计算肺系数(肺系数/%=肺重量/体重×100%)。再将肺组织置于80℃烤箱内烘干72 h至完全脱水,称量肺干重(D)并计算肺湿干重比(W/D)以估计各组肺组织水肿程度。
1.3 MPO、MDA、SOD 和 T-AOC测定 试剂盒购自南京建成生物医学工程研究所,按试剂盒操作说明书进行。
1.4 肺组织ICAM-1测定及半定量分析 采用免疫组织化学法检测ICAM-1表达情况。石蜡包埋肺组织切片,常规二甲苯脱蜡,梯度乙醇水化,0.01 mol·L-1PBS洗3 min×2次。3%过氧化氢室温孵育10 min消除内源性辣根过氧化物酶活性。抗原修复后用封闭液室温孵育1 h,洗涤后滴加一抗(兔抗鼠ICAM-1单克隆抗体,北京博奥森生物技术有限公司),37℃孵育2 h,PBS冲洗3遍。亲和素标记的二抗室温孵育2 h,PBS冲洗3遍,辣根过氧化物酶标记的卵亲蛋白-亲和素复合物室温孵育1 h,PBS冲洗4遍,每次5 min,DAB显色。梯度乙醇脱水、二甲苯透明,中性树脂封片。利用HMIAS-2000高清晰度彩色医学图像分析软件进行分析,以平均光密度为指标,每个时间点每组随机抽取不同切片5张,每张切片于光镜下(10×40)随机选取5个视野,测定平均光密度值取平均值,反映ICAM-1的表达强度。
1.5 统计学分析 用SPSS13.0统计分析软件进行统计学分析,数据用±s表示,多组均数比较行单因素方差分析(ANOVA),两两比较用最小显著差法(least significant difference,LSD);两组均数比较行独立样本t检验(independent-samplesttest)。
Tab 1Effect of DATS on lung coefficient and pulmonary W/D in different groups(±s,n=6)
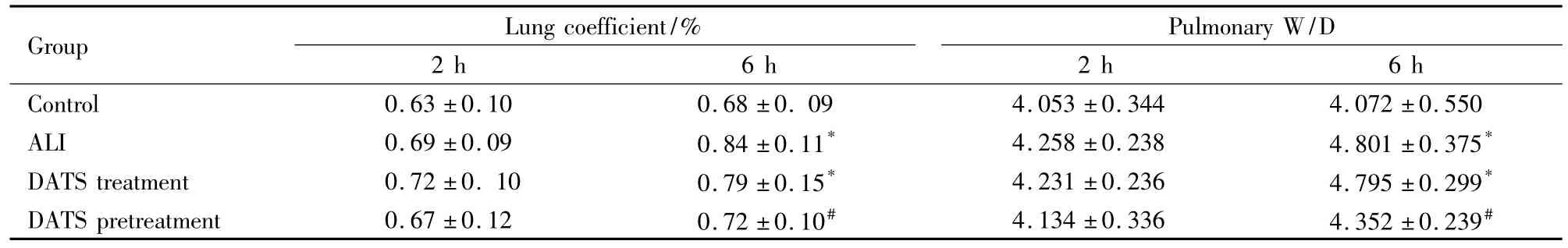
Tab 1Effect of DATS on lung coefficient and pulmonary W/D in different groups(±s,n=6)
*P<0.05 vs control group;#P<0.05 vs ALI group
Group Lung coefficient/%2 h 6 h Pulmonary W/D 2 h 6 h Control 0.63 ±0.10 0.68 ±0.09 4.053 ±0.344 4.072 ±0.550 ALI 0.69 ±0.09 0.84 ±0.11* 4.258 ±0.238 4.801 ±0.375*DATS treatment 0.72 ±0.10 0.79 ±0.15* 4.231 ±0.236 4.795 ±0.299*DATS pretreatment 0.67 ±0.12 0.72 ±0.10# 4.134 ±0.336 4.352 ±0.239#
2 结果
2.1 肺系数及肺W/D的变化 ALI组,2 h肺系数、肺W/D较对照组无明显变化,6 h肺系数、肺W/D较对照组升高(P<0.05),表明出现肺水肿。6 h时,DATS预防组肺系数、肺W/D与ALI组相比下降(P<0.05),表明肺水肿有所减轻。但DATS治疗组与ALI组相比肺系数、肺W/D无明显改善(P>0.05)。见 Tab 1。
2.2 肺组织匀浆中反映氧化损伤和抗氧化指标的变化 注射LPS后2 h、6 h,ALI组小鼠肺组织匀浆中MPO活性、MDA含量均明显高于对照组(P<0.05),SOD活性和T-AOC活性则明显低于对照组(P<0.05)。预防性给予DATS与ALI组相比较,MPO活性、MDA含量明显降低(P<0.05),而SOD活性及T-AOC活性明显升高(P<0.05),DATS治疗组与ALI组相比,4项指标差异均无显著性(P>0.05),见 Tab 2。
2.3 肺组织ICAM-1的表达变化 对照组肺组织ICAM-1表达大部分位于气道粘膜上皮细胞,只有少数血管内皮细胞呈棕黄色的阳性着色分布,染色较浅淡,阳性信号较弱。ALI组小鼠在注射LPS后2 h及6 h,肺组织ICAM-1阳性细胞分布明显增多,在气道粘膜上皮细胞和血管内皮细胞均可见深黄色阳性表达,且染色程度加深。DATS预防组的ICAM-1阳性表达介于LPS组和对照之间。图像分析证明,ALI组ICAM-1的平均光密度较对照组升高(P<0.05),DATS预防组ICAM-1的平均光密度较ALI组降低(P<0.05),DATS治疗组较ALI组差异无显著性(P>0.05)。见 Fig 1、2,Tab 2。
Tab 2The MPO,SOD,T-AOC activity,MDA content and ICAM-1 expression in the lung tissue in different groups(±s,n=6)
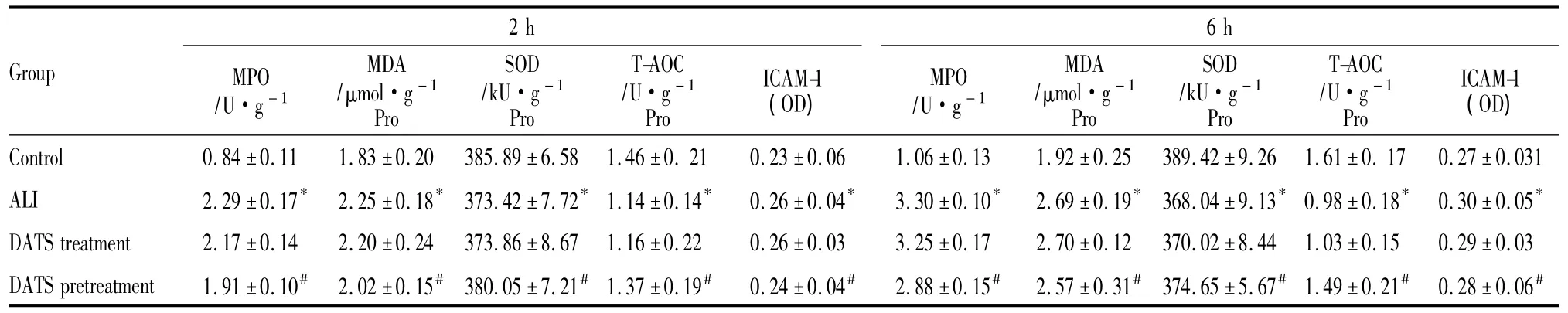
Tab 2The MPO,SOD,T-AOC activity,MDA content and ICAM-1 expression in the lung tissue in different groups(±s,n=6)
*P<0.05 vs control group;#P<0.05 vs ALI group
Group 2 h MPO/U·g-1 MDA/μmol·g-1 Pro SOD/kU·g-1 Pro T-AOC/U·g-1 Pro ICAM-1(OD)6 h MPO/U·g-1 MDA/μmol·g-1 Pro SOD/kU·g-1 Pro T-AOC/U·g-1 Pro ICAM-1(OD)Control 0.84 ±0.11 1.83 ±0.20 385.89 ±6.58 1.46 ±0.21 0.23 ±0.06 1.06 ±0.13 1.92 ±0.25 389.42±9.26 1.61±0.17 0.27 ±0.031 ALI 2.29 ±0.17* 2.25 ±0.18* 373.42 ±7.72*1.14 ±0.14* 0.26 ±0.04* 3.30 ±0.10* 2.69 ±0.19* 368.04 ±9.13*0.98 ±0.18* 0.30 ±0.05*DATS treatment 2.17 ±0.14 2.20 ±0.24 373.86 ±8.67 1.16 ±0.22 0.26 ±0.03 3.25 ±0.17 2.70 ±0.12 370.02 ±8.44 1.03 ±0.15 0.29 ±0.03 DATS pretreatment 1.91 ±0.10# 2.02 ±0.15# 380.05 ±7.21#1.37 ±0.19# 0.24 ±0.04# 2.88 ±0.15# 2.57 ±0.31# 374.65 ±5.67#1.49 ±0.21# 0.28 ±0.06#
3 讨论
本研究结果表明,给小鼠腹腔注射LPS后6 h肺系数、肺组织W/D较对照组升高,表明出现了明显的肺水肿,证实ALI模型复制成功。预防性应用DATS可降低肺系数及肺组织W/D,说明DATS减轻了ALI的肺水肿程度。这种作用是否与其抗氧化作用有关呢?我们进一步观察了氧化应激指标的变化。
ALI时,多形核中性粒细胞(polymorphonuclear leucocyte,PMN)在肺部被激活后处于“呼吸爆发”状态,耗氧量大增,产生过量的氧自由基,参与ALI的发生[7]。MPO是中性粒细胞嗜天青颗粒所释放的过氧化物酶类,其活性的高低与PMN的数量成正比,是 PMN 积聚的指标[8-9]。本实验结果表明,注射LPS后2、6 h小鼠肺组织MPO活性较对照组明显增高,反映了PMN在肺内的大量扣押和积聚。
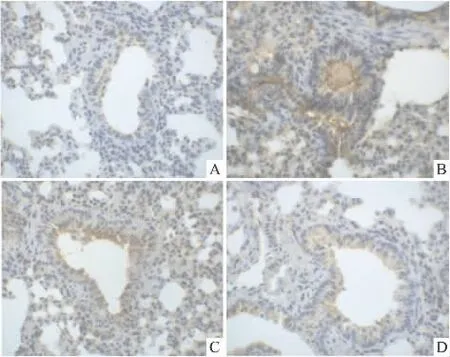
Fig 1 The expression of ICAM-1 in lung tissues at 2 h after LPS injection(400×)
ALI时PMN在肺内扣押,主要是由于LPS激活了肺血管内皮细胞,使其表面的黏附分子ICAM-1表达增加,导致内皮细胞与PMN的黏附性增强,使PMN易于通过血管壁参与局部炎症反应。我们同时也观察到,注射LPS后2、6 h,ICAM-1在肺组织的表达明显增加,并且不仅局限于气道粘膜上皮细胞,在血管内皮细胞表达增加更为明显,表明ICAM-1参与了肺组织炎症和肺水肿的发生。ICAM-1的表达水平与肺损伤程度密切相关[10],可作为检测血管内皮细胞活化损伤的标志物,预测ALI的严重程度[11]。本实验观察到,预防性应用DATS可使ALI小鼠肺组织中 ICAM-1的表达受到抑制,尤其是肺血管内皮细胞的阳性信号减弱明显,MPO的活性也明显降低。说明DATS可通过抑制ICAM-1的表达减少PMN与血管内皮细胞的黏附,减少PMN等炎症细胞在肺组织的扣押,由此减少氧自由基的产生,从而减轻肺损伤。
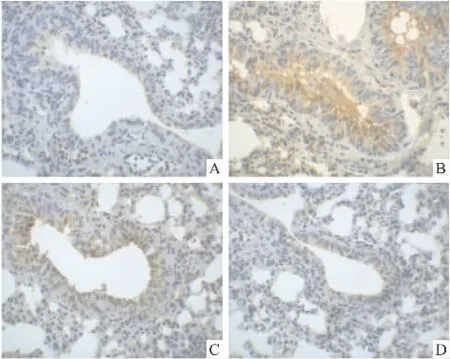
Fig 2 The expression of ICAM-1 in lung tissues at 6 h after LPS injection(400×)
ALI时过量的氧自由基不仅来源于PMN的“呼吸爆发”,同时也和机体抗氧化机制障碍有关。SOD是氧自由基的清除剂,是机体抗氧化体系中一个重要的酶[12],其活力高低间接反映机体清除氧自由基的能力。T-AOC是机体清除自由基的重要指标,它的测定结果克服了单一的抗氧化指标难以全面反映组织抗氧化能力的不足[13]。本实验中,ALI组小鼠肺组织SOD和T-AOC的活性均明显减低,表明机体总的抗氧化能力下降,清除氧自由基减少;而应用DATS可使SOD活性及T-AOC活性有所恢复,表明其可增强机体的抗氧化能力。此外,肺组织MDA的含量在ALI小鼠明显增加,反映了肺组织脂质过氧化损伤程度加重。MDA是氧自由基攻击生物膜中多不饱和脂肪酸所形成的脂质过氧化物,它的增加表明器官组织内存在脂质过氧化损伤的程度。ALI时SOD活性下降和MDA含量升高反映了机体氧化/抗氧化平衡的失调,预防性应用DATS可升高SOD活性降低MDA含量,纠正这种氧化/抗氧化的失衡,对机体起到保护作用。
综上,预防性应用DATS可在一定程度上减轻肺组织的氧化应激反应以及ICAM-1的表达,从而发挥抗ALI作用。
[1]Chow C W,Herrera Abreu M T,Suzuki T,et al.Oxidative stress and acute lung injury[J].Am J Respir Cell Mol Biol,2003,29(4):427-31.
[2]Matthay M A,Zimmerman G A,Esmon C,et al.Future research directions in acute lung injury:summary of a National Heart,Lung,and Blood Institute working group[J].Am J Respir Crit Care Med,2003,167(7):1027-35.
[3]Wu C C,Sheen L Y,Chen H W,et al.Effects of organosulfur compounds from garlic oil on the antioxidation system in rat liver and red blood cells[J].Food Chem Toxicol,2001,39(6):563-9.
[4]Liu K L,Chen H W,Wang R Y,et al.DATS reduces LPS-induced iNOS expression,NO production,oxidative stress,and NF-kappaB activation in RAW 264.7 macrophages[J].J Agric Food Chem,2006,54(9):3472-8.
[5]朱桂军,李淑瑾,胡振杰,等.DATS通过NF-κB抑制LPS诱导小鼠肺泡巨噬细胞促炎细胞因子表达[J].中国药理学通报,2007,23(12):1580-4.
[5]Zhu G J,Li S J,Hu Z J,et al.DATS inhibited LPS-induced proinflammatory cytokines expression in mouse alveolar macrophages cell line MH-S by inhibiting NF-κB activation[J].Chin Pharmacol Bull,2007,23(12):1580-4.
[6]Kabir K,Gelinas J P,Chen M,et al.Characterization of a murine model of endotoxin-induced acute lung injury[J].Shock,2002,17(4):300-3.
[7]王 乐,刘 伟,廖琳玲,等.地昔帕明对小鼠内毒素急性肺损伤的影响[J].中国药理学通报,2010,26(1):63-5.
[7]Wang L,Liu W,Liao L L,et al.Influence of desipramine on lipopolysaccharide induced acute lung injury in mice[J].Chin Pharmacol Bull,2010,26(1):63-5.
[8]Bradley P P,Priebat D A,Christensen R D,et al.Measurement of cutaneous inflammation:estimation of neutrophil content with an enzyme marker[J].J Invest Dermatol,1982,78(3):206-9.
[9]Sun B,Sun H,Liu C,et al.Role of CO-releasing molecules liberated CO in attenuating leukocytes sequestration and inflammatory responses in the lung of thermally injured mice[J].J Surg Res,2007,139(1):128-35.
[10]Yokomura I,Iwasaki Y,Nagata K.Role of intercellular adhesion molecule-1 in acute lung injury induced by candidemia[J].Exp Lung Res,2001,27(5):417-31.
[11]Pittet J F,Machersie R C,Martin T R,et al.Biological markers of acute lung injury:prognostic and pathogenetic significance[J].Am J Respir Crit Care Med,1997,155(4):1187-205.
[12]Kinnula V L,Crapo J D.Superoxide dismutases in the lung and human lung diseases[J].Am J Respir Crit Care Med,2003,167(12):1600-19.
[13]Doreswamy K,Shrilatha B,Rajeshkumar T,et al.Nickel-induced oxidative stress in testis of mice:evidence of DNA damage and genotoxic effects[J].J Androl,2004,25(6):996-1002.

