乙醛酸化学镀铜工艺
杨防祖, 姚光华, 周绍民
(厦门大学化学化工学院固体表面物理化学国家重点实验室,福建厦门 361005)
乙醛酸化学镀铜工艺
杨防祖, 姚光华, 周绍民
(厦门大学化学化工学院固体表面物理化学国家重点实验室,福建厦门 361005)
研究了以乙醛酸为还原剂的化学镀铜工艺、镀层结构和形貌。其镀液组成和操作条件为:28.0g/L CuSO4·5H2O,44.0g/L EDTA-2Na,10.0mg/L α,α'-联吡啶,10.0mg/L 亚铁氰化钾,9.2g/L乙醛酸,pH为11.5~12.5,θ为40~50℃。实验结果表明,化学镀铜溶液较稳定;镀液温度和硫酸铜质量浓度提高,铜沉积速率增大;较高的镀液温度下,化学镀铜反应的活化能较低,镀液稳定性下降;镀液pH在11.5~12.5可获得较好的铜镀层;随乙醛酸和络合剂质量浓度提高,铜沉积速率变化不大,但过量的乙醛酸导致镀液的稳定性降低;铜镀层为面心立方混晶结构,呈光亮的粉红色块状形貌,有较高的韧性。
化学镀铜;乙醛酸;镀液稳定性
引 言
非导电材料的金属化,涉及机械粗化、化学除油、化学粗化、敏化与活化、化学沉积铜以及可能的电沉积铜加厚等一系列复杂的工艺过程。自20世纪50年代起,铜化学沉积应用于塑料和陶瓷等非金属表面处理[1-2]、印制线路的孔金属化[3]、超大规模集成电路中的硅芯片加工[4-6]及柔性线路板喷墨打印金属浆料后的铜加厚[7-8]等。传统的仍在大量使用的化学沉积铜是以甲醛为还原剂、EDTA和酒石酸钾钠为单独或混合络合剂的基本溶液组成[3,5]。化学沉积铜镀液和添加剂的作用已有报道[9-11]。
众所周知,甲醛有毒且易挥发,对人体和环境有害,已不能满足当前清洁生产和环境保护的要求。目前研究甲醛的替代物有次磷酸钠、二甲基胺硼烷、肼、葡萄糖和乙醛酸等[12-13]。如果以次磷酸钠或二甲基胺硼烷为还原剂,铜沉积层中含磷或硼,导致微电子线路电阻的提高。乙醛酸因其标准氧化电位(-1.01V)与甲醛相近而受到广泛关注[14-15]。本文以乙醛酸取代甲醛作为化学镀铜的还原剂,在已有研究基础上[16-17],探索镀液主盐、络合剂、还原剂、pH、反应温度和沉积时间等对铜沉积速率、镀液稳定性的影响,以及镀层的形貌和结构。
1 实验方法
1.1 镀液组成、操作条件及工艺流程
镀液组成及操作条件:28.0g/L CuSO4·5H2O,44.0g/L EDTA-2Na,10.0mg/L α,α'-联吡啶,10.0 mg/L亚铁氰化钾,9.2g/L乙醛酸,pH 为 11.5~12.5(用 NaOH 或 H2SO4调节),θ为40~50℃,用化学纯试剂和去离子水配制溶液。
化学镀铜工艺流程:以 2.0cm ×2.0cm ×0.2 cm的紫铜片为基体,经碱洗(20%NaOH溶液,室温)→水洗→酸洗(10%硫酸溶液,室温,30s)→水洗→离子钯液活化(100mg/L PdCl2,室温,2min)→水浸洗→化学镀铜。镀槽为250mL的烧杯,镀液体积150mL,镀件悬挂于镀液中。镀槽置于HH-6数显恒温水浴锅中,以维持反应温度恒定。
1.2 沉积速率的测定
沉积速率用常规的质量法测定,使用灵敏度为0.1mg的电子天平,称量镀前和镀后样品的质量差,化学沉积速率由单位时间、单位基体面积计算求得。
1.3 化学镀铜层的结构
化学镀铜层结构检测在D/max-RC转靶X-射线衍射仪(XRD)上进行(日本理学RIGAKU公司生产),Cu 靶,管电压 40kV,管电流 30mA,狭缝1°DS-1°SS-0.15mm RS,以石墨单色器滤波,扫描速度6°/min。所有衍射谱都经过 Kα1,Kα2分离。
采用ITACHI S-4800扫描电子显微镜(SEM)(日本日立公司生产)观察镀层形貌,电压10kV,真空度优于 0.1Pa。
2 结果与讨论
2.1 化学镀铜反应随时间的变化特性
在化学镀铜溶液配方的基础上,确定pH为12.0,θ为40℃时,铜沉积质量随时间的变化示于图1。结果表明,铜沉积质量随时间的延长呈线性增加,即沉积速率基本恒定。假设 ρ(铜)为8.9 g/cm3,则平均沉积速度为0.28μm/h。显然,沉积速率很低。然而,本实验镀液表现出良好的稳定性,化学沉积120min后,化学镀铜溶液稳定,镀层表面呈光亮和均匀的紫铜色,有较高的韧性。

图1 铜沉积质量随时间的变化
2.2 pH对沉积速率的影响
图2为在强碱性溶液中,乙醛酸化学镀铜沉积速率随pH的变化。化学镀铜θ为50℃,t为1h。由2图可知,以乙醛酸作还原剂,铜沉积反应需要较高的pH。实验发现,pH<11时化学沉积反应难以发生;pH>12.5时,镀液开始分解;pH>11时,铜沉积速率随pH提高迅速增大,并逐渐趋于稳定。因此,适宜的 pH 为11.5 ~12.5。
化学镀溶液为热力学不稳定体系。化学镀过程中,总是发生还原剂的氧化反应、金属(络合)离子的还原反应以及可能的析氢反应。对于以乙二胺四乙酸二钠为络合剂的乙醛酸化学镀铜溶液,则表现为铜离子的还原反应和乙醛酸的氧化反应。由乙醛酸的氧化反应方程式可知,镀液pH将影响氧化过程的电极电位,从而影响Cu的沉积速率。提高镀液pH,有利于促进乙醛酸的氧化和提高Cu的沉积速率。然而,在碱性介质中,乙醛酸会发生康尼查罗反应(歧化反应)。提高化学镀铜溶液的pH可提高歧化反应的速率,造成乙醛酸的消耗、降低沉积速率和镀液稳定性。

图2 铜沉积速率随pH的变化
2.3 温度对沉积速率的影响
化学镀铜可以在常温下进行,但沉积速率很低。温度对铜的化学沉积的影响,如图3所示。结果表明,当θ≤50℃时,铜的沉积速率随温度的升高迅速增大;当θ≥50℃时,随温度的升高,铜的沉积速率增加相对缓慢。尽管在不同温度下获得的铜镀层均呈粉红色,但随着温度提高,镀液的稳定性降低。θ≤40℃时镀液稳定;θ≥50℃时镀液有逐渐分解的倾向,并在镀液底部出现铜沉积物。

图3 铜沉积速率随温度变化
通过阿仑尼乌斯方程,作铜沉积速率K的对数随绝对温度T的倒数变化关系,可以计算出铜沉积过程的活化能E,实验结果如图4所示。由图4可知,θ高于或低于50℃时,lnK~1/T分别呈近乎线性关系,根据lnK=lnA-E/RT(A为常数,R为气体常数),斜率为 k=-E/R,经计算,θ高于50℃时k1=-1.84,低于 50℃时的 k2=-5.21,可得 E1=15.3 kJ/mol和 E2=43.3kJ/mol。由实验现象和活化能计算结果可知,温度较低时镀液稳定,活化能高,反应速度慢;温度较高时,镀液活化能降低,反应速度加快,发生镀液分解和乙醛酸歧化反应的倾向增大。不同的k1和k2值,说明在不同的温度范围,铜化学沉积的反应机制可能发生了变化。

图4 lnK~1/T曲线图
2.4 硫酸铜、乙醛酸和络合剂对沉积速率的影响
化学镀铜θ为50℃,t为1h,硫酸铜质量浓度对铜沉积速率的影响如图5所示。由图5可以看出,镀液中较高的铜离子将促进铜在基体表面的扩散,使铜离子在基体表面的沉积速率增大。镀液中足够量的铜离子是获得较高沉积速率的基本保证,但根据实验现象发现,硫酸铜浓度过高,镀液的稳定性降低。因此,镀液中c(Cu2+)为0.15mol/L较为适宜。

图5 c(Cu2+)对沉积速率的影响
乙醛酸和络合剂EDTA浓度对沉积速率的影响结果如表1所示。由表1可以看出,铜化学沉积速率并未因镀液中乙醛酸浓度的改变而发生明显的变化。显然,过量的乙醛酸对反应速度没有影响。然而,乙醛酸浓度提高,不仅促进其歧化反应,而且导致镀液的稳定性降低。镀液θ为50℃,c(乙醛酸)为0.25mol/L时,镀液容易分解。
保持镀液中的硫酸铜质量浓度不变,改变络合剂的质量浓度,所得镀层质量基本保持不变。说明络合完全后,铜的沉积速率并不因络合剂质量浓度的增大而减小;适当游离络合剂的存在,对铜的沉积没有影响。

表1 c(乙醛酸)和ρ(络合剂)对沉积速率的影响
2.5 反应机理初探
在实验中,铜化学沉积时发生的主要反应,阳极反应:

阴极反应:

总反应:
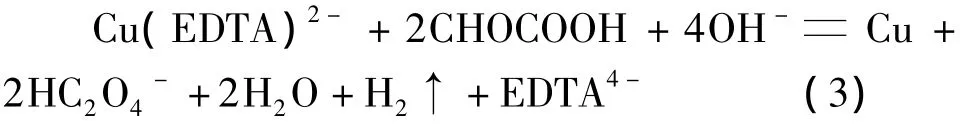
可能发生的副反应:

由化学反应方程式(1)可以看出,铜化学沉积过程中伴随着大量析氢过程。根据铜沉积速率不随还原剂质量浓度变化而改变的事实,推测反应机理可能为乙醛酸催化脱氢使二价铜发生还原。镀液中发生的副反应,如生成Cu2O,乙醛酸和Cu2O的歧化反应,使镀液稳定性下降。
2.6 镀层的结构与形貌
以不锈钢为基体化学镀铜后,将镀层与基体剥离,对镀层进行XRD和SEM测试,结果如图6所示。由图6(a)XRD谱图表明,铜镀层为面心立方结构,出现(111)、(200)、(220)和(311)晶面衍射峰,多个晶面衍射峰的出现,说明铜镀层为混晶结构,没有出现除铜之外物质的晶面衍射峰。结合镀层外观为光亮粉红色,说明铜层纯度较高,镀层中不含杂质或杂质量很少。由图6(b)SEM照片表明,铜镀层表面由块状物构成,团块之间存在界限。
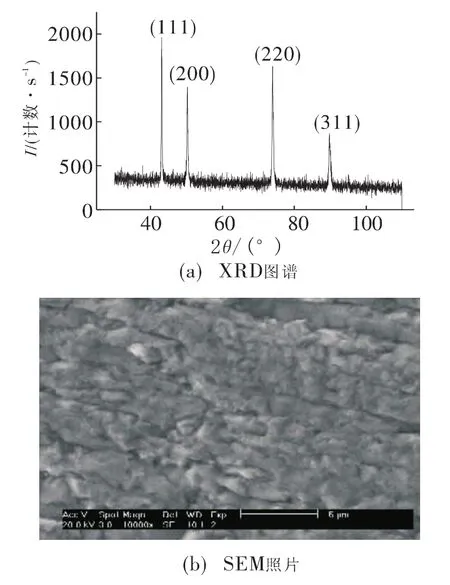
图6 铜镀层结构与表面形貌
3 结论
乙醛酸可以取代甲醛作为化学镀铜的还原剂,所得镀层呈光亮的粉红色,有较高的韧性,工艺较稳定。发展乙醛酸化学镀铜新技术,无疑具有实际应用价值。本文成功地实现了以乙醛酸为还原剂的化学镀铜,揭示了镀液组分及沉积条件的影响以及镀层的结构和形貌,为取代甲醛化学镀铜、获得性能更加优良的化学镀铜新工艺提供坚实的基础。
[1]Chu S Z,Sakairi M,Takahashi H.Copper electroless plating at selected areas on aluminum with Pulsed ND-YAG laser[J].Journal of the Electrochemical Society,2000,147(4):1423-1434.
[2]胡光辉,杨防祖,林昌健,等.陶瓷基上化学镀铜[J].电镀与涂饰,2001,20(2):1-4.
[3]Steinhauser E.Potential low-cost palladium-alternatives for activating electroless copper deposition [J].Circuit World,2010,36(3):4-8.
[4]Cho S K,Lim T,Lee H K,et al.A study on seed damage in plating electrolyte and its repairing in Cu damascene metallization[J].Journal of the electrochemical Society,2010,157(4):D187-D192.
[5]Lee C H,Kim A R,Koo H C,et al.Effect of 2-mercapto-5-benzimidazolesulfonic acid in superconformal Cu electroless deposition [J].Journal of the electrochemical So-ciety,2009,156(6):D207-D210.
[6]Chou Y H,Sung Y,Liu Y M,et al.Defect-free copper filling using nonisothermal electroless deposition with fluorocarbon surfactant[J].Journal of the electrochemical Society,2008,155(12):D791-D797.
[7]Huang S C,Tsao T C,Chen L J.Selective electroless copper plating on poly(ethylene terephthalate)surfaces by microcontact printing[J].Journal of the electrochemical Society,2010,157(4):D222-D227.
[8]Moebius A,Elbick D,Weidlich E R,et al.Plasma-printing and galvanic metallization hand in hand-A new technology for the cost-efficient manufacture of flexible printed circuits[J].Electrochimica Acta,2009,54(9):2473-2477.
[9]Duda L.Effect of isomeric dipyridyls on electroless copper deposition from EDTA solutions[J].Plating & Surface Finishing,1998,(7):60-63.
[10]Wu H Y,Kang E T,Neoh.Electroless deposition of copper on surface modified poly(terafluoroethylene)films from graft copolymerization and silanization[J].Langmuir,2000,16:5192-5198.
[11]Hsu D T,Iskandar M,Shi F G,et al.Compatibility of the low-dielectric-content poly(arylether)with the electroless copper deposition solution [J].Journal of the Electrochemical Society,1999,146(12):4565-4568.
[12]杨防祖,杨斌,陆彬彬,等.以次磷酸钠为还原剂化学镀铜的电化学研究 [J].物理化学学报,2006,22(11):1317-1320.
[13]Steinhaeuser E,Stamp L,Brandt L.Chemical“kick start”for the autocatalytic formaldehyde-free electroless copper plating process [J].Circuit World,2010,36(2):20-23.
[14]Shacham-Diamand,Yosi Y.Electroless deposition using glyoxylic acid as reducing agent for ultralarge-scale integration metallization[J].Electro-Chem.Solid-State Lett.,2000,3(6):279-282.
[15]Honma H,Kobayashi T.Electroless copper deposition process using glyoxylic acid as a reducing agent[J].Journal of the Electrochemical Society,1994,141(3):730-733.
[16]吴丽琼,杨防祖,黄令,等.乙醛酸化学镀铜的电化学研究[J].电化学,2005,11(4):402-405.
[17]申丹丹,杨防祖,吴辉煌.2-2'联吡啶和亚铁氰化钾对乙醛酸化学镀铜的影响[J].电化学,2007,13(1):67-69.
An Electroless Copper Plating Process Using Glyoxylate as Reductant
YANG Fang-zu,YAO Guang-hua,ZHOU Shao-min
(College of Chemistry and Chemical Engineering,State Key Laboratory of Physical Chemistry of Solid Surfaces,Xiamen University,Xiamen 361005,China)
An electroless copper plating process using glyoxylate as reductant was developed,structure and surface morphology of the deposit were also studied.The bath composition and operating conditions were:28.0g/L CuSO4·5H2O,44.0g/L EDTA·2Na,10.0mg/L α,α’-bipyridyl,10.0mg/L potassium ferrocyanide,9.2g/L glyoxylate,pH 11.5 ~12.5,temperature 40 ~50℃.Experimental results showed that:the electroless copper plating bath was quite stable;the copper deposition rate would increased in case of bath temperature and copper sulfate concentration increased;the bath stability would decreased due to lower activation energy of copper deposition in case of higher temperature;the qualified copper coating could be obtained only at a proper bath pH range of 11.5 ~12.5;the copper deposition rate would not be affected by concentrations of glyoxylate and complexing agent evidently,whereas excessive content of glyoxylate would cause the bath stability decreased;the copper coating had a FCC mixed crystal structure with blocky grains、pink/bright appearance and good ductility.
electroless copper plating;glyoxylate;bath stability
TQ153.14
A
1001-3849(2012)03-0001-05
2011-07-22
国家自然科学基金(20873114,20833005);国家重点基础研究发展规划项目(973)(2009CB930703)

