超声辅助低水比提取无患子皂素工艺过程研究
赵丹青,苏肇秦,张卫明,孙达峰,朱莉伟,蒋建新*
无患子(Sapondus mulorossi)是无患子科无患子属的一种落叶乔木,在东南亚各国、我国的台湾省及淮河以南各省均有分布,具有耐干旱贫瘠、生长迅速、抗病虫害等特点[1]。无患子皂素是从无患子果皮中提取出的苷类化合物,主要包括以下类型:五环三萜类齐墩果烷型皂苷、四环三萜类大戟烷型皂苷、达玛烷型皂苷和倍半萜皂苷,其中以三萜类皂苷为主[2]。无患子皂素是一种天然的表面活性剂,具有良好的乳化、分散、发泡、湿润等功效,并且均有抗菌、镇痛、消炎的药理作用,可应用于洗涤、医药、纺织、日用化工等领域。无患子皂苷的提取方法主要包括水提法和有机溶剂提取法。水提法得率较高,但也会同时将一些单糖、低聚糖、氨基酸、蛋白质等提取出来,从而使得提取物中皂苷纯度偏低[1]。此外,水提法存在用水量大,废水排放多等缺点。而有机溶剂法成本偏高,且部分有机溶剂具有一定程度的毒性。
超声波作为一种高效节能的新兴应用技术,近年来在植物化学领域得到了广泛应用。超声波作用于提取体系中,可以产生声空化效应,这种效应产生的强大压力可以造成植物细胞壁的瞬间破坏,同时超声波产生的振动可以促进植物细胞内物质的释放、扩散及溶解,从而提高提取率[3]。目前超声技术应用于无患子皂素提取工艺未见报道,本课题就低水比下超声辅助的无患子皂素提取工艺进行研究,以期为无患子皂素的生产提供依据,提高生产效率,降低水耗。
1 材料与方法
1.1 材料与试剂
无患子果皮,产于福建,丙酮、无水乙醇、浓硫酸、香草醛均为分析纯。
1.2 仪器
HF-5B超声循环提取机(宁波新芝生物科技股份有限公司),B-260旋转蒸发仪(上海亚荣生化仪器厂),UV-2000紫外分光光度计(尤尼柯仪器有限公司),KQ-200VDB双频数控超声波清洗器。
1.3 实验方法
1.3.1 检测方法
采用紫外分光光度比色方法,显色剂为香草醛- 浓硫酸[4]。
1.3.1.1 试剂的配制
80 g/L香草醛溶液:0.8 g香草醛溶于10 mL无水乙醇;
体积分数77%硫酸:硫酸(质量分数95%)77 mL加到23 mL去离子水中。
1.3.1.2 标准样品的制备
取无患子果皮,粉碎过20目筛,取物料40 g,以液料比1∶4加入无水乙醇,在40℃下超声提取30 min,功率800 W。旋转蒸发回收乙醇,用3倍体积丙酮沉降。滤渣烘干后用热乙醇溶解,再加丙酮沉降,重复3次,得到黄褐色无患子皂素标准品。
1.3.1.3 50%乙醇为溶剂的定量方法
(1)精确称取制得的无患子皂素标准品25 mg,溶于50%乙醇中,定容至25 mL;
(2)确定最大吸收波长:取标准溶液0.5 mL,准确加入80%香草醛溶液0.5 mL,于冰水中加入77%硫酸液4 mL,摇匀,于60℃加热15 min,然后置于冷水浴中冷却10 min,取出后用紫外分光光度计在400-600 nm扫描;
(3)标准曲线的绘制:分别取标准溶液0.1、0.2、0.3、0.4、0.5 mL,置于带塞试管中,并加水至溶液体积为0.5 mL,按(2)加试剂反应后,在最大吸收波长下测定其吸光度,并以吸光度对浓度绘制标准工作曲线。
1.3.1.4 水为溶剂的定量方法
(1)称取制得的无患子皂素标准品25 mg,溶解于水中,定容至25 mL;
(2)同1.3.1.3(2)步骤;(3)同1.3.1.3(3)步骤。
1.3.1.5 提取液皂素含量的测定
取无患子提取液样品0.5 mL于比色管中,准确加入80%香草醛溶液0.5 mL,于冰水中加入77%硫酸液4 mL,摇匀,于60℃加热15 min,然后置于冷水浴中冷却10 min,以未加入试剂的样品为空白,在最大吸收波长下测定其吸光度
1.3.2 无患子皂素超声提取单因素实验
实验对超声时间、料液比、超声功率和提取温度进行单因素探索,分别考察这五个因素对皂素收率的影响。
1.3.2.1 超声时间
称取约12 g的无患子果皮粉,以料液比1:6加入去离子水,超声功率800 W,提取温度60℃,反应过程中使用香草醛-浓硫酸显色法测定提取液中的皂素含量,得到皂素提取率随超声时间的变化曲线。
1.3.2.2 料液比
称取约12 g的无患子果皮粉,分别以固液比1∶4、1∶5、1∶6、1∶7、1∶8加入去离子水,超声功率 800 W,提取温度60℃,超声时间20 min,使用香草醛-浓硫酸显色法测定提取液中的皂素含量。
1.3.2.3 超声功率
称取约12 g的无患子果皮粉,以料液比1∶6加入去离子水,提取温度60℃,超声时间20 min,分别考察不同超声功率 400、600、800、1 000、1 200 W 对皂素得率的影响。
1.3.2.4 提取温度
称取约12 g的无患子果皮粉,以料液比1∶6加入去离子水,超声时间20 min,功率800 W,考察不同温度 30、40、50、60、70 ℃对皂素得率的影响。
2 结果与讨论
2.1 无患子皂素UV定量方法
2.1.1 最大吸收波长
两种溶剂显色体系的全波长扫描如图1所示,分别在462 nm(50%乙醇)和540 nm(水)处得到最大吸收,与魏凤玉等[5]及杨志斌等[6]得到的无患子皂素最大吸收峰接近(分别为478 nm和541 nm)。比较两条吸收曲线可见,以50%乙醇为溶剂时,出现单峰且吸光度较高;而以水为溶剂时,峰值吸光度较低,且540 nm也是还原糖的最大吸收波长,若选择此波长作为检测波长,将会对结果造成较大影响。因此选择50%乙醇作为检测溶剂。由于本研究中无患子皂素提取采用水为溶剂,因此在检测前需加入相同体积的无水乙醇。

图1 两种溶剂(50%乙醇和水)的全波长扫描
2.1.2 显色温度和显色时间
根据文献报道,三萜类皂苷检测时的温度大多在60~80℃,为探索温度对显色反应的影响,实验检测了0.5 mg/mL标准溶液在不同显色温度下的吸光度,结果如表1所示。吸光度随着温度的上升发生少量的增加,对结果影响很小,所以实验选择最低温度60℃作为显色温度。此外,在60℃下改变显色时间,结果如表2所示。随着显色时间的增长,吸光度逐渐增加,显色反应越完全。10 min的吸光度较高,且与15 min吸光度较接近,因此确定显色时间为15 min。

表1 加热温度的选择

表2 显色时间的选择
2.1.3 稳定性
为了考察测试方法的稳定性,在一定时间内测定已显色的样品溶液的吸光度,结果如表3所示。显色后10 min内吸光度较稳定,15 min后发生较大增长。一个可能的原因是乙醇的挥发造成溶液颜色加深,使得吸光度升高。在魏凤玉等[5]的研究中,当显色时间从50 min延长到60 min时,吸光度产生了明显的下降。这与我们的检测结果相反。他们的解释是,显色反应生成的络合物也可能在空气中氧化变性,造成吸光度的下降。因此,对吸光度的检测应该在显色反应后的10 min内进行,并注意比色管的密封。
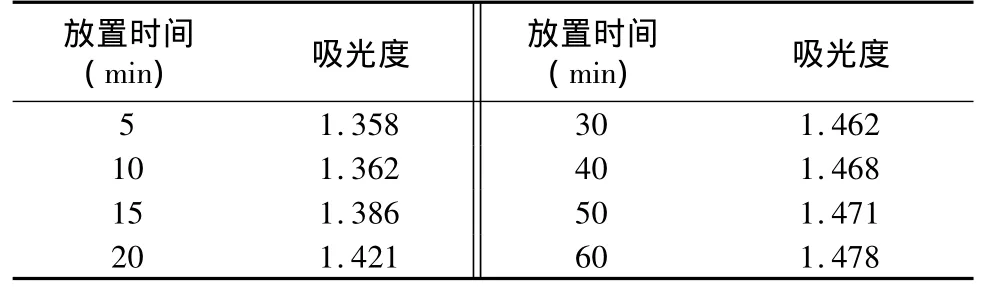
表3 吸光度随放置时间的变化
2.1.4 标准曲线
在462 nm下绘制标准曲线,如图2所示。得到吸光度(A)与皂素浓度(C)的关系为:C=0.3201A+0.063,R2=0.9998。即无患子皂苷在0.1~0.5 mg/mL内吸光度与浓度呈良好的线性关系。则根据下式计算样品中的无患子皂素含量:
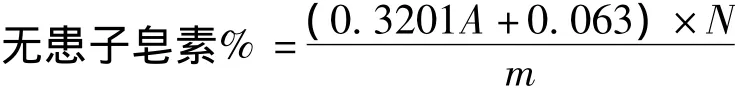
其中:A为样品吸光度,V为样品体积 (mL),m为样品质量(mg),N为稀释倍数。
2.1.5 加标回收率
精确吸取无患子提取液100μL,分别30、40、50、60、70μL无患子皂苷标准品溶液(浓度:1 mg/mL),用分光光度法测定吸光度,计算加标回收率。如表4所示,平均加标回收率为102.05%,RSD为1.53%(n=5),所以此检测方法可信度较高,检测结果接近真实值。
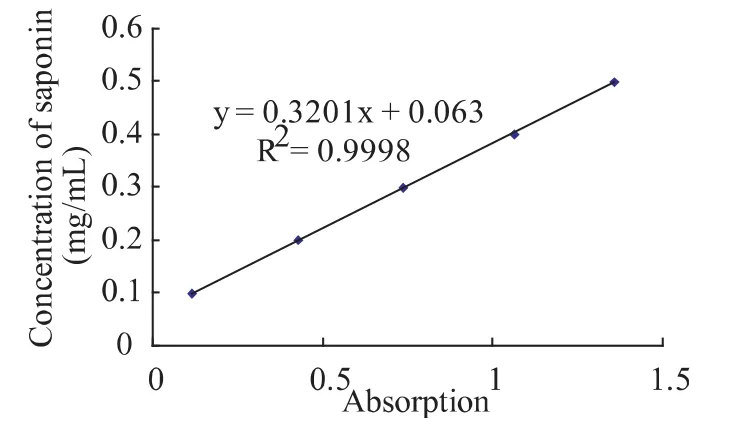
图2 无患子皂苷的标准曲线
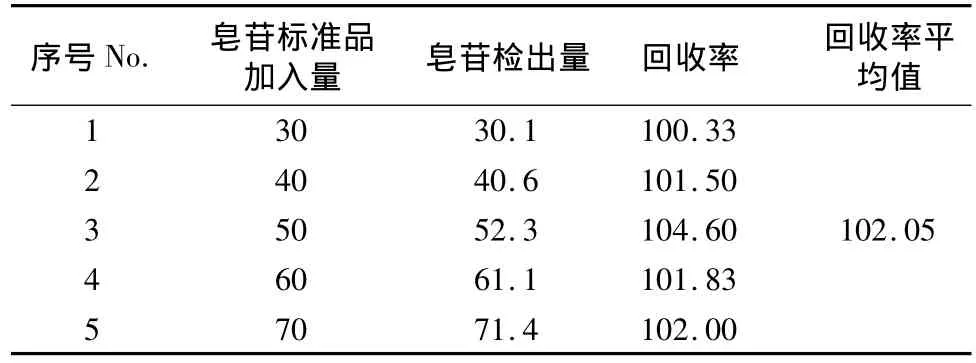
表4 加标回收率测定结果
2.2 超声提取时间对皂素提取的影响
原料以料液比1∶6加入去离子水,超声功率800 W,提取温度60℃,考察不同超声提取时间对皂素提取的影响(图3)。从结果可以看出,随着超声时间的延长,皂素的得率也随之升高。20 min时,提取率为37.21%,而当时间进一步增长时,皂素得率并没有大幅提高。这是因为固液界面层的皂素浓度梯度是超声法提取的主要推动力,提取初期,固相和液相的皂素浓度差较大,因此提取速率快,提取率增加明显,而随着提取时间的延长,溶剂中皂素的浓度逐渐增大,与固相的浓度差逐渐减小,因而推动力变小,所以提取速率减缓,提取率增加不明显,直至推动力为零,皂素不再溶出,提取达到平衡。所以20 min以后,延长时间对提取的增进作用不明显。基于以上原理以及对能耗的考虑,确定20 min为最适超声提取时间。
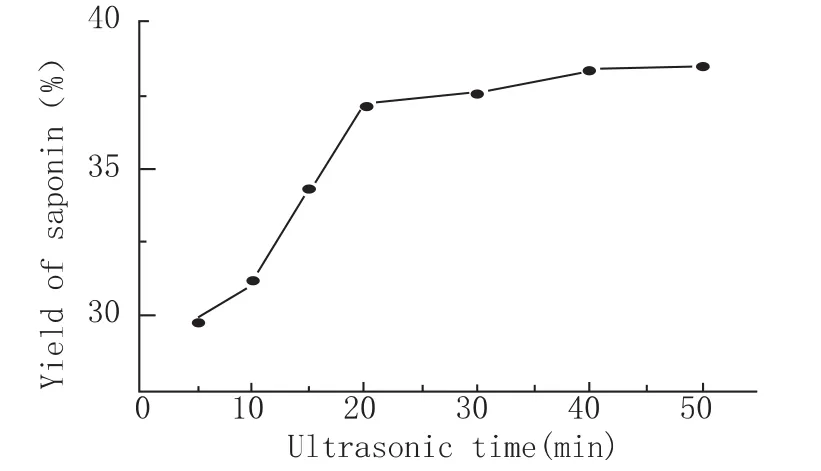
图3 超声时间对皂素提取得率的影响
2.3 料液比对皂素提取的影响
原料中加入一定量去离子水,超声功率800 W,提取温度60℃,超声时间20 min,考察不同料液比(原料质量与溶剂体积之比,g·mL-1)对皂素提取的影响(图4)。当加水比从1∶4提高到1∶6时,皂素提取得率由34.20%上升到了37.32%。提高加水比可以增进原料与水的有效接触,增加传质面积[7],提高细胞壁内皂苷向水扩散的速率,从而提高提取得率。而当加水比超过1∶6时,提取得率的增幅已经很小。这说明当液料比足以保证溶剂完全浸润物料并有效溶解皂素后,传质面积固定,加水比德进一步提高将不再影响固液传质速率,反而会增加溶剂投入和回收成本,带来不必要的能耗。故综合考虑采取1∶6的液料比进行提取。
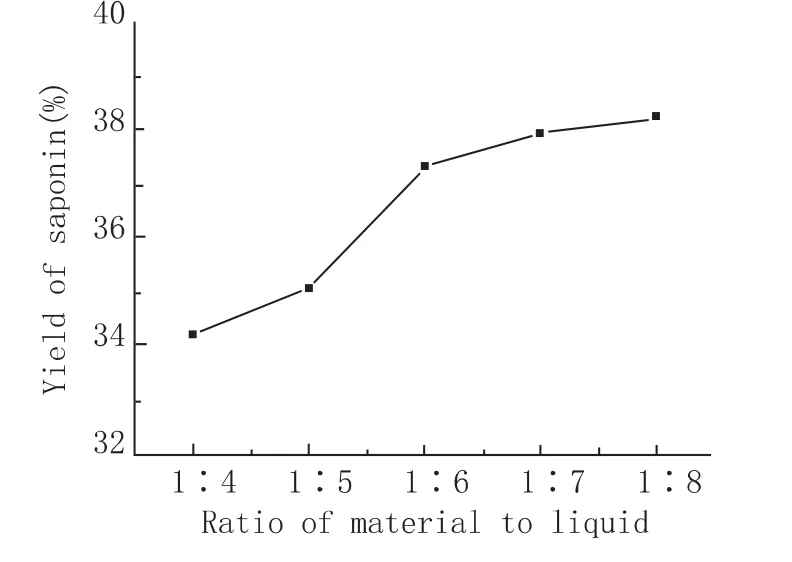
图4 料液比对皂素提取率的影响
2.4 超声功率对皂素提取的影响
原料以料液比1∶6加入去离子水,提取温度60℃,超声时间20 min,考察不同超声功率对皂素提取的影响(图5)。由图可以看出,皂素提取得率随着超声功率的升高而先升后降,在1 000 W有皂苷最大提取率(37.40%)。这是由于对于一定频率和一定发生面的超声波来说,功率增大,声强(功率/面积)随之增大,从而声压幅值以及液体中的压力也增大,空化泡崩塌所需的时间将缩短。因此单位时间内超声产生的空化效应增多,从而有利于皂素的溶出。而当声强继续增大时,过高的声强产生出大量空泡,这些空泡会反射声波,减少能量的传递,不利于提取[8]。另外,由于超声处理的无选择性,高强度的超声处理会使空化作用在打破细胞壁的同时破坏皂素结构,造成皂素的损耗。因此,实验中出现了皂素提取率先升高后降低的现象。由于800 W和1 000 W下的皂苷提取率接近,且出于对节能因素的考虑,选择800 W作为最适超声频率。
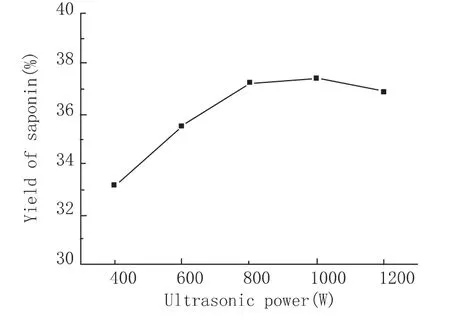
图5 超声频率对皂素提取得率的影响
2.5 温度对皂素提取的影响
原料以料液比1∶6加入去离子水,超声时间20 min,功率800 W,考察不同温度对皂素提取的影响(图6)。皂素提取得率随着温度上升而提高,并在60℃达到最大值(37.36%)。这是由于温度的升高可以降低溶液粘度,促进扩散;另一方面,粘滞系数的下降有利于空化泡的产生,增进空化作用,因而增进皂素的提取。但当温度继续升高至70℃时,提取率发生了大幅下降,这可能是由于升高温度导致的蒸汽压上升会使得空化强度或空化效应下降,从而不利于提取过程的强化。同时,过高温度对超声换能器的压电性能会有影响[9]。因此选择60℃作为最适温度。

图6 提取温度对皂素提取率的影响
3 小结
无患子果皮占到全果的55.6%[10],采用超声波辅助法从无患子果皮中提取皂素是可行并且有效的。在超声波作用下提取无患子皂素的得率受多种因素影响,如超声提取时间、料液比、超声功率和提取温度等,实验得出较佳的提取工艺参数为:超声频率20 kHz,超声时间 20 min,料液比 1∶6,超声功率800 W,提取温度60℃,皂素提取得率为37.27%。低水比超声波辅助法提取无患子皂素可以减少过程用水量,降低能耗,提高皂素得率。
致谢:本项目研究原料由福建三青生态农林发展有限公司协助采集,表示感谢!
[1] 黄素梅,王敬文,杜孟浩,等.无患子的研究现状及其开发利用[J].林业科技开发,2009,23(6):1-5.
[2] 周露,赵友兴.无患子属的化学成分及研究进展[J].天然产物研究与开发,2007,19:558-561.
[3] 韩枫,李稳宏,李冬,等.响应曲面法优化超声波提取薯蓣皂素工艺研究[J].食品科学,2007,28(7):96-100.
[4] 侯如燕,宛晓春,黄继轸.油茶皂苷标准品的制备及定量方法的比较[J].食品与发酵工业,2005,8(12):62-63.
[5] 魏凤玉,张静,解辉.无患子总皂苷含量的测定[J].天然产物研究与开发,2008,20:81-83.
[6] 杨志斌,杨柳,李晖.无患子有效化学成分的分析研究[J].湖北林业科技,2010,5:32-34.
[7] 潘鹤林,陈晨,商利容.黄姜皂素提取新工艺研究[J].高校化学工程学报,2011,25(2):296-301.
[8] 周国仪,吴琼,刘华曦,等.超声辅助提取芝麻叶黄酮[J].武汉工业学院学报,2007,26(2):17.
[9] 刘昌盛,黄风波,夏伏建,等.超声波法提取茶皂素的工艺研究[J].中国油料作物学报,2006,28(2):203-206.
[10] 周自圆,朱莉伟,李雪,等.不同居群无患子果实组成比较研究[J].中国野生植物资源,2011,30(4):61-65.

