太湖霍甫水丝蚓(Limnodrilus hoffmeisteri Claparède)的时空格局*
李 艳,蔡永久,秦伯强,龚志军**
(1:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京210008)
(2:中国科学院研究生院,北京100049)
太湖霍甫水丝蚓(Limnodrilus hoffmeisteri Claparède)的时空格局*
李 艳1,2,蔡永久1,2,秦伯强1,龚志军1**
(1:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京210008)
(2:中国科学院研究生院,北京100049)
2005年1-12月对太湖霍甫水丝蚓进行了逐月调查.太湖霍甫水丝蚓年均密度和生物量分别为3273.75 ind./m2和4.697 g/m2,均在2月份达到最大值.根据体长频数分布的周年变化,推测太湖霍甫水丝蚓一年有三代.太湖霍甫水丝蚓密度和生物量在空间上表现出明显的差异性,且随季节变化较小,其高值区域均出现在太湖北部梅梁湾和竺山湾及西部河口湖区,而在其它区域的现存量均较低.分析表明太湖霍甫水丝蚓空间差异可能与营养水平、底质类型、可摄食的食物及生境的稳定性等因素有关.
太湖;时空分布格局;霍甫水丝蚓;富营养化
霍甫水丝蚓(Limnodrilus hoffmeisteri Claparède)是一种世界性分布的水栖寡毛类,耐污性较强,能在低氧环境下正常生长繁殖,甚至在短期缺氧环境下也能生存,常在有机污染严重的水体中大量出现,被用作有机污染或富营养化的标志性指示种[1-2].霍甫水丝蚓的栖居方式是将身体的前段埋于底泥中,后段露于水中且不停摆动进行呼吸,它们吞食底泥,摄取其中的有机质,因此与底质性质关系极为密切.霍甫水丝蚓也是淡水水生食物链的重要一环,是鱼类或其它水生动物的优良饵料,在湖泊生态系统食物网中具有重要作用.
国外对霍甫水丝蚓进行水质评价也颇为普遍,对其生活史、分布特点、种群变化及其与环境的相互关系都有过一些研究,而目前国内对霍甫水丝蚓种群生态学的研究还不多见,且相关研究主要集中在生理生态学、毒理学等方面,对各类水体中霍甫水丝蚓的时空分布特征,特别是大型浅水湖泊中霍甫水丝蚓的种群特征及其与环境因子关系的研究更少[1,3-8].
太湖是一个典型的大型浅水湖泊,湖中底栖动物资源非常丰富.近年来,随着太湖富营养化的加剧,太湖底栖动物的群落结构、时空分布等都发生了很大的变化,虽然目前对太湖底栖动物的调查较多[9-12],但对特定物种的生态学研究却较为缺乏.因此我们根据对太湖底栖动物的前期调查,选取现阶段广泛分布于太湖、具有代表性的优势种——霍甫水丝蚓为研究对象,试图弄清太湖霍甫水丝蚓的时空分布特征及生活史,探讨环境因子对其空间分布的影响,以期能为长江中下游地区浅水湖泊的水质生物监测与水环境管理提供数据支持.

图1 太湖采样点分布Fig.1 Distribution of 32 sampling sites in Lake Taihu
1 材料和方法
1.1 研究地点及采样点布设
太湖是中国第三大淡水湖,位于长江三角洲南缘(30°55'40″~ 31°32'58″N,119°52'32″~120°36'10″E),实际水面面积为 2338 km2,湖岸线总长 495 km2,平均水深 1.9 m[12].近年来,由于人类不当的生产活动和环境污染以及污染后治理措施的滞后,导致太湖水质不断恶化,富营养化趋势日趋严重,蓝藻水华频频暴发[11,13].太湖富营养化程度最严重的区域是北部梅梁湾和竺山湾[12].根据对太湖底栖动物的前期调查,在太湖布设32个采样点(图1)研究全湖霍甫水丝蚓的时空分布特征,并选取霍甫水丝蚓数量较多的2个采样点研究其生活史,其分别为梅梁湾的TH1和竺山湾的 TH16,采样时间为2005年 1-12月,每月采样1次,采集时重复3次;其余30个采样点每季度采样1次,采样时间为2005年2月、5月、8月和11月.
1.2 标本的采集和处理
样品定量采集使用1/40 m2改良Peterson采泥器,泥样经60目尼龙网筛洗净后,在白瓷盘中将样本挑出,并置于10%福尔马林溶液中保存.霍甫水丝蚓幼小个体的体长在解剖镜下测定,较大的个体用游标卡尺直接测量.称量湿重时,先用滤纸将标本体表的水分吸去,直至滤纸上没有湿的印迹为止,然后置于电子天平上称量,最终结果折算成单位面积的密度和生物量.
1.3 数据处理
利用地理信息系统软件ArcGIS 9.2模拟霍甫水丝蚓空间分布格局,在已生成的1∶50000太湖轮廓图及样点分布图的基础上,以密度和生物量为变量,利用反距离权重法插值运算.
为研究霍甫水丝蚓与生态因子的关系,本文采用对应于采样月份水体和沉积物的理化参数,数据由中国科学院南京地理与湖泊研究所太湖湖泊生态系统研究站提供,其理化因子的测定方法参考文献[14].本文采用的数据均为多次采样数据的平均值.由于多数理化指标之间存在共线性,直接作相关分析并不合适,因此本文选择对环境指标作主成分分析(Principal Component Analysis,PCA).主成分分析是将多个变量通过线性变换得到较少个数综合变量,新的变量彼此独立,又能综合反映变化前变量所包含的信息.主成分分析利用统计软件PAST 1.99,分析前对数据进行标准化(平均值=0,标准差=1),其后利用相关分析检验各主成分与霍甫水丝蚓密度对数的相关性.由于TH21、TH27和TH29三个点未采集到霍甫水丝蚓,在PCA和相关分析时将其剔除.
2 结果
2.1 太湖各湖区的基本理化特征
为便于分析说明霍甫水丝蚓的空间分布特征,特将太湖划分为北部湖区、西部大浦口(TH10)、湖心区(TH7、TH8、TH18、TH19 和 TH30)、南湖区(TH11、TH20、TH21、TH22、TH23、TH26、TH27、TH28 和 TH29)和东太湖(TH12、TH24 和 TH25),将北部湖区又细分为梅梁湾(TH0、TH1、TH3、TH4、TH5、TH6、TH9、TH15 和TH32)、竺山湾(TH16和TH17)和贡湖湾(TH13、TH14和TH31).梅梁湾、竺山湾和西部大浦口的DO和pH值均低于其他湖区,但TOC、CODMn和BOD5值则均高于其他湖区,且绝大多数形态的氮磷浓度明显高于其他湖区,说明这些湖区富营养化程度较其他湖区高(表1).

表1 太湖各湖区理化环境条件Tab.1 Physical and chemical conditions in each part of Lake Taihu
2.2 太湖霍甫水丝蚓的空间分布格局
2.2.1 太湖霍甫水丝蚓现存量的分布格局 太湖霍甫水丝蚓年平均密度的最高值出现在太湖北部竺山湾,为13800 ind./m2,梅梁湾和大浦口区域的密度值也相对较高,整体从北向南有一定的梯度变化.太湖霍甫水丝的年平均生物量变化与年平均密度变化相似,最高值也出现在竺山湾,为29.1 g/m2,整体也有从北向南逐渐降低的趋势(图2).
2.2.2 太湖霍甫水丝蚓不同季节的空间分布 从不同季节霍甫水丝蚓空间分布格局可以看出(图3),冬季(12、1、2月)是一年中霍甫水丝蚓密度和生物量最大的时期.霍甫水丝蚓的密度和生物量最高值均出现在竺山湾,分别为17080 ind./m2和68.2 g/m2.春季(3-5月)太湖霍甫水丝蚓的密度、生物量与冬季相比有所减小,但是分布范围都有向北延伸的趋势.竺山湾仍然是密度和生物量的高值区,最大值分别为11440 ind./m2和13.9 g/m2.该时期东太湖出现霍甫水丝蚓,但密度和生物量较低.夏季(6-8月)是一年中霍甫水丝蚓密度和生物量最小的时期.该时期霍甫水丝蚓的密度和生物量的高值区转移至西岸大浦口,最大值分别仅为6920 ind./m2和8.8 g/m2,竺山湾的密度和生物量的值较之更低.与夏季相比,霍甫水丝蚓的密度和生物量在秋季(9-11月)明显增加,但分布范围向北回缩.密度和生物量的高值区又出现在竺山湾,最大值则分别为25120 ind./m2和33.6 g/m2,大浦口密度和生物量也相对较高.值得注意的是,夏季在东太湖出现了一定规模的霍甫水丝蚓分布,这在其他季节中没有发现.总体而言,太湖霍甫水丝蚓分布主要集中在太湖北部的竺山湾、梅梁湾和西部的大浦口,且密度和生物量的高值区在一年中的大部分时间都位于竺山湾.
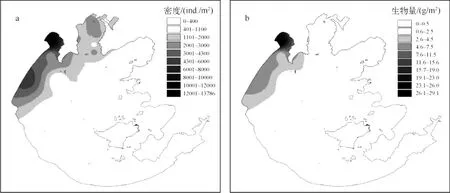
图2 太湖霍甫水丝蚓密度(a)和生物量(b)分布Fig.2 Spatial patterns of the density(a)and biomass(b)of L.hoffmeisteri in Lake Taihu

图3 不同季节太湖霍甫水丝蚓密度和生物量的空间分布格局Fig.3 Spatial patterns of the density and biomass of L.hoffmeisteri in Lake Taihu in different seasons

图3(续) 不同季节太湖霍甫水丝蚓密度和生物量的空间分布格局Fig.3(cont.) Spatial patterns of the density and biomass of L.hoffmeisteri in Lake Taihu in different seasons

图4 太湖TH16采样点霍甫水丝蚓现存量的月动态Fig.4 Monthly dynamics of density and biomass of L.hoffmeisteri at station TH16 in Lake Taihu
2.3 太湖霍甫水丝蚓现存量的季节变化
鉴于2005年TH1样品中霍甫水丝蚓数量过少,故只选取TH16分析其密度和生物量季节动态.霍甫水丝蚓在TH16的年均密度和生物量分别为 11973 ind./m2和 28.1 g/m2.在温度较低的冬季霍甫水丝蚓的密度较低,进入春季后密度缓慢增加,春末夏初时密度开始下降,至8月份密度降至最低,为232 ind./m2,9月份水丝蚓的密度开始缓慢增加,11月份剧烈增加达到最大值,为33520 ind./m2.霍甫水丝蚓的生物量月动态变化大致与密度变化相似,但生物量在冬季12月份达到最大值(图4).
2.4 太湖霍甫水丝蚓体长频率分布和变化
TH1、TH16两点的体长频率分布略有差异(图5),这可能是由于两个采样点的生境条件和底质性质不同造成的,但是其表现出相似的规律性.以小个体的出现作为霍甫水丝蚓繁殖的标志,小个体共出现三次,第一次大概在3、4月,第二、三次分别在7月和11月,以此可以推测出从2005年1-12月太湖霍甫水丝蚓有三个世代;各个世代之间没有明显的分界(图5),且已观察到整年中都有性成熟个体,说明世代之间有重叠,从而推测太湖霍甫水丝蚓一年中有相当大部分时间都可繁殖.另外,霍甫水丝蚓冬季的个体明显大于其他季节,而夏季个体最小.

图5 太湖霍甫水丝蚓的体长频率分布Fig.5 Frequency histograms of the body length of L.hoffmeisteri in Lake Taihu

表2 主成分分析结果,包括前3个主成分的特征值、方差解释率及与环境变量的相关性Tab.2 Statistical characteristics of PCA,including the eigenvalues,percentage of variance explained,and correlations for each environmental variable for the first 3 principle components
2.5 太湖霍甫水丝蚓的分布与环境因子的关系
将太湖各理化因子的多次采样数据平均后通过PCA分析(图6)可以看出太湖理化因子的空间格局.其中前两轴的解释率较高,分别为45.95%和21.80%,而第三轴解释率相对较低(8.70%),说明前两轴已能很好地反映环境的变化情况(表2).进一步分析发现第一主成分PC1与和BOD5有较高的正相关,与 Cond、CODMn和TNs也有较高的正相关,而与DO、pH有较高的负相关,这些变量主要反映了水体的营养水平;第二主成分PC2与SD、TPs有较高的正相关,与有较高的负相关,主要反映了水体物理环境条件.相关分析表明霍甫水丝蚓密度对数值与PC1呈显著正相关(r=0.630,P <0.001,图 7),而与PC2和PC3相关性均不显著.
3 讨论
3.1 不同湖泊中霍甫水丝蚓现存量的差别
霍甫水丝蚓在淡水湖泊中广泛分布,随环境条件的不同其现存量有明显差异.根据文献报道,统计了巢湖、镜泊湖、武汉南湖等湖泊中霍甫水丝蚓的现存量(表3),对比发现霍甫水丝蚓密度有随着湖泊富营养化程度的增加而增加的趋势,这与龚志军等的研究结果一致[15].富营养化程度最高的巢湖霍甫水丝蚓的密度却相对较低,其原因可能是其水深相对较高的缘故[16-17],也可能是水体污染程度过高造成底质缺氧从而抑制了霍甫水丝蚓的生长繁殖而造成的[18-20].
底栖动物密度与可利用的浮游植物、可获得的食物量、水深、温度、营养盐、溶解氧水平以及底质中有机质的含量等均有一定的相关性[20].其中底质是决定颤蚓类分布和密度的关键因子,底质中存在的大量有机物质为颤蚓类提供了丰富的食物,从而会增加颤蚓类的密度[21-25].Kennedy通过对欧洲四个地区湖泊的调查认为水丝蚓属的密度在时间和空间上变化与非生物因素无关,但是根据已有的调查研究发现,霍甫水丝蚓的密度会随着水体中的有机质升高而增加,而随湖泊深度的增加而减少,另外Seys等发现底质类型也会对霍甫水丝蚓的密度产生影响[16-17,26-28].

图6 太湖32个采样点(点)环境因子(矢量线)的主成分分析Fig.6 An ordination bi-plot of PCA shows all 32 sampling sites(dots)and environmental variables(vector lines)

图7 29个采样点霍甫水丝蚓密度对数值与PC1得分的相关性分析Fig.7 Relationship between logarithmic density of L.hoffmeisteri and PC1 scores at 29 sampling sites
3.2 太湖霍甫水丝蚓空间分布差异
霍甫水丝蚓主要栖居于沉积物表层,靠摄取其中的有机质为食物,因此沉积物的性质和可获得的食物直接决定着霍甫水丝蚓的数量.本研究发现太湖中霍甫水丝蚓的分布呈现出明显的空间差异性,相关分析发现霍甫水丝蚓密度与反应水体营养状态的第二主成分显著相关,而水体的营养水平直接影响着底质特征和食物资源.霍甫水丝蚓的高值区域出现在太湖北部梅梁湾、竺山湾及几个河口采样点,而这些区域是太湖富营养化最严重,水华暴发最频繁的区域.该地区属于淤泥粘土底质[11-12],由于藻类沉降和外缘有机质输入较多,沉积物中的有机质、总氮、总磷都显著高于其他湖区[12,34],从而为其提供了丰富的食物来源;此外该地区沉积物呈还原状态,含氧量较低,相较于其它底栖生物,耐污能力较强的霍甫水丝蚓更容易生存,因而在这些区域霍甫水丝蚓的密度和生物量均最高.贡湖湾、湖心区及南湖区霍甫水丝蚓密度较低,这可能与其底质类型及沉积物中有机质含量较低有关.Anlauf等研究发现颤蚓类喜生活于淤泥及细颗粒的沉积物,且正颤蚓主要选择摄食粒径小于63 μm的有机颗粒物[35-36].而这些区域沉积物属于粉砂、粘土质粉砂类型,粒径范围较广,有机物质含量较少,不利于霍甫水丝蚓的掘穴活动和食物摄取[11-12,38-39].此外,湖心区和南湖区开阔水域受风浪扰动强烈,表层沉积物再悬浮非常频繁,从而导致栖息生境并不稳定,这也在一定程度上限制了小个体种类(如霍甫水丝蚓)的栖居[40],蔡永久等近期研究发现这些区域的优势种主要为大个体的软体动物[41].东太湖和东部湖湾水生植物丰富,水体透明度高,浮游植物较少,虽沉积物中有机质含量较高,但主要是水生植物碎屑,而相对于外源有机质和藻类残体而言,植物碎屑较难被霍甫水丝蚓摄食消化,从而导致其密度也较低.

表3 不同营养水平湖泊霍甫水丝蚓的密度差异Tab.3 Density of L.hoffmeisteri in lakes with contrasting trophic status
3.3 太湖霍甫水丝蚓的生活史
霍甫水丝蚓分布于世界各地,其生活史在不同地区表现出一定的差别.Brinkhurst综合欧洲的研究材料,认为霍甫水丝蚓在欧洲的繁殖季节为水温较高的夏季(水温超过15℃时),但是在亚热带的广州,霍甫水丝蚓繁殖季节为12月至翌年的4月,较欧洲提前了2~3个月,然而在夏季的8月份该种群中几乎不出现成熟个体[7,43].但温度并不是影响霍甫水丝蚓生活史的唯一因素,栖息地生产力的高低也是一个重要影响因素,生产力越高,繁殖周期越短,但繁殖期越长[44-45].在不同地区,水丝蚓可以一年一代,也可以一年繁殖三代以上[45-46].与太湖所处纬度相近,且也具有较高富营养化水平的武汉东湖,其霍甫水丝蚓为一年三代,与本文的结论一致[47].太湖霍甫水丝蚓的繁殖高峰为冬季,成熟个体数量较多、体型较大,它们和新生个体构成了种群数量高峰,因此太湖霍甫水丝蚓在冬季生物量和密度全年最大;年轻一代则在春季产卵,从而在初夏形成种群数量的另一高峰,但由于太湖地区夏季温度较高,对霍甫水丝蚓的生长,发育和繁殖产生不良影响,该时期太湖霍甫水丝蚓的个体较小,密度和生物量全年最小;而这些个体会于秋季末和冬季成熟并在冬季进行生殖.上述结果与Kennedy对北威尔士霍甫水丝蚓的研究结果相一致,但与武汉南湖霍甫水丝蚓的生物量密度变化有一点差异,王银东等发现该湖霍甫水丝蚓密度在春季(4月)最高,而由于自然死亡和被铺食等原因,霍甫水丝蚓的密度在冬季逐渐下降[31,45].
3.4 太湖霍甫水丝蚓历史的变化情况
由于霍甫水丝蚓能耐受有机物大量被分解时造成的低氧甚至缺氧环境,而其他底栖动物在这种环境下往往受到抑制甚至死亡,所以在水体富营养化严重时可以发现大量的霍甫水丝蚓.本文通过PCA分析发现太湖霍甫水丝蚓的密度分布与水体营养水平呈显著正相关,太湖水体富营养化程度由北向南逐渐降低,而太湖霍甫水丝蚓则主要集中在污染最严重,水华暴发最频繁的北部梅梁湾和竺山湾区域,其密度也由北向南而逐渐减少.这个空间变化趋势似乎与梅梁湾霍甫水丝蚓的历史变化有一定的相似性.
梅梁湾1960s以来不断受到生活工业污水影响,水质由Ⅱ~Ⅲ类不断恶化至劣V类,水生植被分布面积不断缩减直至消亡,是太湖水体富营养化过程的典型湖区.据以往调查,该地区1960s以河蚬、环棱螺为主要种类(88、26 ind./m2),环节动物和水生昆虫密度仅为37 ind./m2;1980s除了河蚬和环棱螺外,出现了较多的颤蚓科种类,特别是在0#点附近水丝蚓密度达到2148 ind./m2;1990s此区域底栖动物优势种已变成了摇蚊属幼虫和水丝蚓,其中6#点霍甫水丝蚓的密度高达3315 ind./m2,占该点位底栖动物总密度的97%[42];最近调查结果则显示寡毛类水丝蚓已成为此地区的绝对优势种(占总密度的94.6%),平均密度与相对重要性指数最高[9,11-12,41].这表明随着时间的推移,霍甫水丝蚓逐渐代替其他底栖动物成为该地区的绝对优势种,梅梁湾富营养化程度呈现越来越严重的趋势.
致谢:中国科学院南京地理与湖泊研究所太湖湖泊生态系统研究站提供2005年水体和沉积物理化数据,在此表示衷心感谢!
[1]Aston RJ.Tubificids and water quality:a review.Environmental Pollution,1973,5:1-10.
[2]Brinkhurst RO,Jamieson BG.Aquatic Oligochaete of the world.Edinburgh:Oliver& Boyd,1971:860.
[3]Chapman PM.Relative tolerances of selected aquatic oligochaetes combination of pollutants and environmental factors.Aquatic Toxicity,1982,2:69-78.
[4]Cairns J.A simple cost-effective multispecies toxicity test using organisms with a cosmoplitan distribution.Environmental Monitoring Assessment,1986,6:207-220.
[5]Chapman PM.The sediment quality triad approach to determining pollution-induced degradation.Science of the Total Environment,1990,37:75-86.
[6]蔡晓明.羽摇蚊幼虫和霍甫水丝蚓的生态毒理学研究.应用生态学报,1991,2(1):52-57.
[7]杞 桑.广州地区水栖寡毛类霍甫水丝蚓的繁殖周期.暨南大学学报:自然科学,1992,13(3):68-71.
[8]王丽珍,李 砥.滇池摇蚊科幼虫和水丝蚓属的生物学特性分析.水利渔业,2004,24(2):48-50.
[9]中国科学院南京地理研究所.太湖综合调查初步报告.北京:科学出版社,1960.
[10]孙超白,周凤帆.底栖动物评估.上海师范学院学报,1983:71-82.
[11]黄漪平.太湖水环境及其污染控制.北京:科学出版社,2001:72-80.
[12]秦伯强,胡维平,陈伟民.太湖水环境演化过程与机理.北京:科学出版社,2004.
[13]秦伯强.长江中下游浅水湖泊富营养化发生机制与控制途径初探.湖泊科学,2002,14(3):193-202.
[14]黄祥飞.湖泊生态调查观测与分析.北京:中国标准出版社,1999.
[15]龚志军,谢 平,唐汇涓等.水体富营养化对大型底栖动物群落结构及多样性的影响.水生生物学报,2001,25(3):210-216.
[16]Probst L.Sublittoral and profundal Oligochaeta fauna of the Lake Constance(Bodensee-Obersee).Hydrobiologia,1987,155:277-282.
[17]Särkkä J.The occurrence of oligochaetes in lake chains receiving pulp mill waste and their relation to eutrophication on the trophic scale.Hydrobiologia,1987,155:259-266.
[18]Verdonschot PFM.Oligochaetes and eutrophication:an experiment over four years inoutdoor mesocosms.Hydrobiologia,1996,334:169-183.
[19]Volpers M,Neumann D.Tolerance of two tubificid species(Tubifex tubifex and Limnodrilus hoffmeisteri)to hypoxic and sulfidic conditions in novel,long-term experiments.Archiv für Hydrobiologie,2005,164:13-38.
[20]James WM.Some factors influencing the density of invertebrates near a sewage outfall.Hydrobiologia,1978,61:81-93.
[21]Grigelis A.The oligochaete fauna and the dynamics of the numerical strength and biomass of Ilyodrilus hammoniensis Mich.and Psammoryctes barbatus(Grube)in Lake Disnai.Inv Acad Sci Lithuania SSR(B),1961,3(26):145-152.
[22]Hiltunen JK.Some oligochaetes from Lake Michigan.Transaction of the American Foundrymen's Society,1967,86:433-454.
[23]Johnson MG,Brinkhurst RO.Associations and species diversity in benthic macroinvertebrates of Bay of Quinte and Lake Ontario.Fisheries Research Board of Canada,1971,28:1683-1697.
[24]Maciorowski AF,Benfield EF,Hendricks AC.Species composition,distribution and abundance of Oligochaetes in the Kanawha River,West Virginia.Hydrobiologia,1977,(1):81-91.
[25]Lang C.Factorial correspondence analysis of Oligochaeta communities according to eutrophication level.Hydrobiologia,1978,57(3):241-247.
[26]Kennedy CR.The distribution and habitat of Limnodrilus Claparede(Oligochaeta:Tubificidae).Oikos,1965,16:26-38.
[27]Lin KJ,Yo SP.The effect of organic pollution on the abundance and distribution of aquatic oligochaetes in an urban water basin,Taiwan.Hydrobiologia,2008,596:213-223.
[28]Seys J,Vincxl M,Meire P.Spatial distribution of Oligochaetes(Clitellate)in the tidal freshwater and brackish parts of the Schelde estuary(Belgium).Hydrobiologia,1999,40(6):119-132.
[29]胡忠军,孙月娟,刘其根等.浙江千岛湖深水区大型底栖动物时空变化格局.湖泊科学,2010,22(2):265-271.
[30]刘曼红,马成学,左彦东等.镜泊湖大型底栖动物群落调查.水生生态学报,2009,(4):1-7.
[31]王银东,熊邦喜,杨学芬.武汉市南湖大型底栖动物的群落结构.湖泊科学,2005,17(4):327-333.
[32]王丑明,谢志才,宋立荣等.滇池大型无脊椎动物的群落演变与成因分析.动物学研究,2011,32(2):212-221.
[33]高 峰,尹洪斌,胡维平等.巢湖流域春季大型底栖动物群落生态特征及与环境因子关系.应用生态学报,2010,21(8):2132-2139.
[34]李 江,金相灿.太湖不同营养水平湖区沉积物理化性质和磷的垂向变化.环境科学研究,2007,20(4):64-69.
[35]Anlauf KJ,Moffitt CM.Models of stream habitat characteristics associated with tubificid populations in an intermountain watershed.Hydrobiologia,2008,603:147-158.
[36]Rodriguez P,Martinez-Madrid M,Arrate JA et al.Selective feeding by the aquatic oligochaete Tubifex tubifex(Tubificidae,Clitellata).Hydrobiologia,2001,463(1):133-140.
[37]Wachs B.The oligochaete fauna of running waters,with special consideration of the relationship between the colonization by Tubificidae and substrate.Translation series;Fisheries and marine service,Canada.Freshwater Research Board No.2663.Archiv für Hydrobiologie,1967,63:310-386.
[38]Birtwell IK.Ecophysiological aspects of tubificids in the Thames estuary[Ph.D.thesis].London:University of London,1972.
[39]Lazim MN,Learner MA.The influence of sediment composition and leaf litter on the distribution of tubificid worms(Oligochaeta).Oecologia,1987,72:131-136.
[40]Moss B,Timms M.Predation,sediment stability and food availability as determinants of the benthic invertebrate fauna in two shallow lakes.Hydrobiologia,1989,185:249-257.
[41]蔡永久,龚志军,秦伯强.太湖大型底栖动物群落结构及多样性.生物多样性,2010,18(1):50-59.
[42]陈伟民,郭晓鸣,Reeze B.太湖梅梁湖区底栖动物的研究.见:蔡启铭编.太湖环境生态研究(一).北京:气象出版社,1998:125-133.
[43]Brinkhurst RO.Observations on the biology of lake-dwelling Tubificidate.Archiv für Hydrobiologie,1964,60(40):385-418.
[44]Lazim MN,Learner MA.The life-cycle and productivity of Tubifex tubifex(Oligochaeta;Tubificidae)in the Moat-Feeder Stream,Cardiff,South Wales.Holarctic Ecology,1986,9:185-192.
[45]Kennedy CR.The life history of Limnodrilus hoffmeisteri Clap.(Oligochaeta:Tubificidae)and its adaptive significance.Oikos,1966,17:158-168.
[46]Potter DWB,Learner MA.A study of the benthic macro-invertebrates of a shallow eutrophic reservoir in South Wales with emphasis on the Chironomidae(Diptera);their life histories and production.Archiv für Hydrobiologie,1974,70:186-226.
[47]Yan YJ,Liang YL.Abundance and production of Limnodrilus Hoffmeisteri(Oligochaeta:Tubificidae)in algae-dominated Lake Houhu(Wuhan,China).Chinese Journal of Oceanography and Limnology,2002,20(1):81-85.
Temporal and spatial patterns of Limnodrilus hoffmeisteri Claparède in Lake Taihu
LI Yan1,2,CAI Yongjiu1,2,QIN Boqiang1& GONG Zhijun1
(1:State Key Laboratory of Lake Science and Environment,Nanjing Institute of Geography and Limnology,Chinese Academy of Sciences,Nanjing 210008,P.R.China)
(2:Graduate University of Chinese Academy of Sciences,Beijing 100049,P.R.China)
The population of Limnodrilus hoffmeisteri Claparède in Lake Taihu(Eastern China)was investigated in 2005 by monthly sampling.The annual average density and biomass of this worm were 3273.75 ind./m2and 4.697 g/m2,respectively.Both population density and biomass peaked in February.According to the annual dynamics of the frequency distributions of body length,the species had three generations and reproduced in considerable time throughout the year.The results showed a strong clumped distribution pattern of L.hoffmeisteri but it changed little among seasons.The highest population density and biomass of L.hoffmeisteri were found in Meiliang Bay,Zhushan Bay and the river-mouths areas in the west,while other places of the lake had very low worm density.The key factors regulating this spatial distribution pattern may be nutrient state,types of substrate,food availability and habitat stability.
Lake Taihu;temporal and spatial distribution patterns;Limnodrilus hoffmeisteri Claparède;eutrophication
http://www.jlakes.org.E-mail:jlakes@niglas.ac.cn
ⓒ2012 by Journal of Lake Sciences
* 国家重点基础研究发展计划“973”项目(2008CB418103)、国家自然科学基金项目(40730529,31070418)和西湖水专项课题(2009ZX07106-002)联合资助.2011-06-01收稿;2011-08-16收修改稿.李艳,女,1984年生,硕士研究生;E-mail:0107liyan@163.com.
** 通信作者;E-mail:zjgong@niglas.ac.cn.

